毛竹笋醋醋酸菌的筛选
涂 佳,艾文胜,杨 明,蒲湘云,孟 勇,李美群
(湖南省林业科学院,湖南 长沙 410004)
毛竹笋醋醋酸菌的筛选
涂 佳,艾文胜,杨 明,蒲湘云,孟 勇,李美群
(湖南省林业科学院,湖南 长沙 410004)
以商业醋酸菌、红曲醋分离的醋酸菌、山西陈醋分离的醋酸菌和笋醋自然发酵的醋酸菌为发酵菌种,采用纯化培养、产酸定性试验初筛出4株醋酸菌。再经过耐酒精试验,产酸速度试验和遗传稳定性试验,得到一株醋酸菌Z2。结果表明:确定醋酸菌Z2产酸速率快、产酸酸度高,遗传较稳定,对其进行16SrDNA测序分析鉴定为巴氏醋酸杆菌。
毛竹;毛竹笋;毛竹笋醋;醋酸菌;筛选
竹笋自古以来就是我国“菜中珍品”,其口感香脆,营养丰富,深受消费者欢迎。湖南地区竹笋资源丰富,毛竹春笋发笋期时间集中,发笋量大,随着春季气温的升高,采收后的毛竹春笋易出现脱壳、纤维化、褐变老化现象,限制了毛竹春笋的大规模流通和生产加工[1]。
醋作为我国传统的食品之一,距今已有3000多年历史[2]。在中国,随着社会经济的发展、人们物质生活水平的提高、消费观念的转变以及对醋功能了解的加深、消费口味的变化适应,醋作为饮料逐渐被人们所接受。目前高档果醋饮品、果醋保健品等果醋产品在欧美、日本等发达国家市场广阔[3]。而发达国家的果醋发展历史正是我们国家果醋市场的发展方向。由此开发毛竹笋醋这种天然发酵果醋饮料的大市场正在孕育形成,并将不断地发展。毛竹笋醋能充分还原竹的原始风味,在功效和经济上都具有合理性。它还能弥补竹类功效饮料市场的产品,适应市场的多元化需求。
该研究的目的在于为开发毛竹笋醋提供发酵技术支撑。毛竹笋醋的研制能为竹笋的加工利用开辟新途径,打破竹笋用于制笋干、保鲜笋和玉兰片的传统局面。毛竹笋醋加工设备简便,同时加工原料要求低,加工笋干和保鲜笋的加工剩余物都可以利用,不仅解决了大量鲜笋鲜销不完的困境也解决了笋干和保鲜笋加工剩余物污染环境的弊端。
在毛竹笋醋生产中,醋酸菌的性能对产品质量、发酵效率和产品中活性因子的含量有很大影响。所以,筛选适合毛竹笋醋生产的醋酸菌是毛竹笋醋开发过程中的关键。
1 材料与方法
1.1 材 料
1.1.1 醋酸菌
AS 1.41、HNCC3.008(购自湖南省微生物研究所)、HNCC3.004(购自湖南省微生物研究所)、A1-5(红曲醋分离)、S1-5(山西陈醋分离)、Z1-5自然发酵笋醋中分离。
1.1.2 原 料
毛竹春笋原料采自湖南省湘潭市林业科学研究所和望城县乌山林场
1.1.3 试 剂
酵母膏、葡萄糖、琼脂粉、无水乙醇、氯化铁、碳酸钙、氢氧化钠,细菌基因组DNA提取试剂盒
1.1.4 培养基
液体培养基:1g酵母浸膏,lg葡萄糖,1.5g碳酸钙,96.5mL蒸馏水,自然pH值于高压杀菌锅121℃灭菌30min,冷却后加2mL无水乙醇备用。
固体培养基:在液体培养基的基础上加入1.5%的琼脂于121℃灭菌30min,冷却备用。
保藏培养基:1%酵母浸膏,l%葡萄糖,1.5%碳酸钙,1.5%琼脂,自然pH值,接种前加2%(v/v)无水乙醇,接种后32℃培养48h后液体石蜡封存冷藏[4]。
1.2 方 法
1.2.1 菌种分离筛选流程
菌种→活化→增殖培养→稀释分离→纯化→定性试验→斜面保藏→初筛→复筛→菌种鉴定
1.2.2 菌种活化过程
商业菌种活化:用浸过75%酒精的脱脂棉擦净安瓿瓶,用酒精灯外焰加热安瓿瓶顶端,待玻璃烧红后滴少量无菌水于安瓿瓶顶端使之破裂,用剪刀轻轻敲碎安瓿瓶。加入少量无菌水入安瓿瓶内,摇匀后吸取0.1mL菌液琼脂斜面上,剩余的菌液注入液体培养基内,在32℃温度下培养[5]。
1.2.3 菌种纯化
取一定醋液,接种于液体培养基中,转速115r/min,32℃震荡培养48h后,1mL增殖液,用无菌水稀释到10-5、10-6、10-7、10-8浓度,取各浓度稀释液0.2mL,均匀涂布接种于固体培养基上。32℃培养72h后,挑选透明圈大,菌落丰厚,且占生长优势的单菌落进行纯化[6]。将纯化后的菌落接种于保藏培养基中。
1.2.4 醋酸菌定性试验
将纯化后的醋酸菌接种于液体培养基中,32℃培养48小时后,取出液体培养基在2 000r/min离心20min后,吸取10mL上清液,用0.01mol/L氢氧化钠中和至pH7.0,将中和液体煮沸后加入5滴8%氯化铁溶液,如果有红褐色沉淀即为醋酸菌[7]。
1.2.5 初筛方法
将分离纯化的菌株斜面活化,接种到液体培养基扩大培养后,以10%的量接种量接种到酒精度为10°Be′的竹笋酒的液体培养基中,放入振荡培养箱中于 115r/min,32℃培养,发酵15天后,测总酸含量,同时比较各菌株发酵效果,选出酸味浓郁,产酸量高的菌株[8]。
1.2.6 复筛方法
经过初筛的保存菌种经过斜面化后,接种到液体培养基扩大培养后接入竹笋汁发酵酒液中,接种量为10%,32℃,115r/min培养48h,测发酵液总酸。综合比较各个醋酸菌的发酵性能,最终筛选出合适竹笋酒发酵醋母[9]。
1.2.6.1 酒精耐受性
将初筛的4种醋酸菌分别于6°Be′、8°Be′、10°Be′,12°Be′、14°Be′竹笋酒含量的液体培养基中,转速为115r/min,32℃培养15天,测总酸含量mg/100mL[10]。
1.2.6.2 产酸速率
将初筛的4种菌种按10%(v/v)的接种量接入含有10°Be′竹笋酒液体培养基中,32℃静止培养,分别于培养至第2、4、6、8、10、12、14、16d时测其产酸量,从中筛选出产酸性能良好的醋酸菌[11]。
1.2.6.3 发酵产酸转化率的测定:
发酵产酸转化率=[产酸量/(发酵酒精含量×1.304)]×100%,其中,产酸量的单位为g/L;
1.2.6.4 遗传稳定性试验
在固体斜面培养基中将Z2传代5次,观察培养后的菌落特征和革兰氏染色后的形态。含有10°Be′竹笋酒液体培养基中,转速为115r/min,32℃培养15天,测定每代的总酸含量。
1.2.7 总酸含量的测定:GBT5009.41-2003
将筛选出的醋酸菌分别接种于含有竹笋酒的液体培养基中,于恒温箱32℃培养3d后取3mL发酵液,加20mL蒸馏水,3滴0.5%酚酞酒精溶液,同时只用pH计,用标定0.01mol/L 的NaOH溶液滴定至pH8.2同时颜色变为浅粉红色;其中,由耗用的NaOH溶液的体积计算样品中的含酸量(以醋酸计)。

式中:X:试样中总酸的含量,g/100ml;V1测定用试样液滴定耗用的NaOH的体积数,mL;V2试剂空白滴定耗用的NaOH的体积数,mL;c为NaOH标准滴定溶液的浓度,mol/L;0.060为醋酸的分子量;V试样体积,mL。
1.2.8 菌种鉴定16S rDNA
1.2.8.1 醋的预处理
取30g湿重醋醅样品,用150mL 0.1mol/L的磷酸盐缓冲液(pH 7.0)悬浮,收集上清。上清液9 000r/min离心5min,弃上清,收集沉淀(菌体)。磷酸盐缓冲液(pH 7.0)洗涤菌体,9 000r/min离心5min。-20℃冻存[12]。
1.2.8.2 样品总DNA提取
样品4℃ 9 000r/min 离心5min,弃上清,加入600mL预热的CTAB。4℃ 9 000 rpm离心10min,取上清。加入等体积的氯仿-异戊醇(24∶1)混匀,4℃ 9 000r/min离心5min。取上清,加入等倍体积的异丙醇,4℃ 10 000r/min离心5min。取沉淀,加1mL 75%酒精洗涤2~3次,4℃ 10 000r/min离心2min。取沉淀,加入1mL无水乙醇,-20℃静置1h后,4℃ 10 000r/min离心5min。去上清,干燥沉淀。加1mL Rnase,30mL LTE完全溶解DNA[13-14]。
2 结果与分析
2.1 产醋酸定性试验结果
通过产酸定性试验,18株醋酸菌AS 1.41、HNCC3.008、HNCC3.004、A1-5、S1-5、Z1-5 离心上清液均与氯化铁络合成红褐色的沉淀,证明18株菌种均为醋酸菌。
2.2 菌种的初筛
将商业菌种AS 1.41、HNCC3.008、HNCC3.004和自行分离纯化的菌种H1-5,S1-5,Z1-5进行初筛。以10%的接种量接种到酒精度为10°Be′的竹笋酒的液体培养基中培养15天后总酸含量见表1。由表1可以看出H2、H3、H4、Z1、Z2、Z3、Z4 均超过 3g/100ml。
醋酸菌在平板培养基上生长时消耗培养皿中的酒精,将乙醇转变为乙醛再变为乙酸。乙酸可以与培养基中碳酸钙发生反应在培养基上形成透明圈,产酸越强透明溶钙圈就越大。结合总酸含量及溶钙圈大小作为筛选菌种的标准,选出溶钙圈排名前四的H2、H3、Z2、Z3进行复筛。
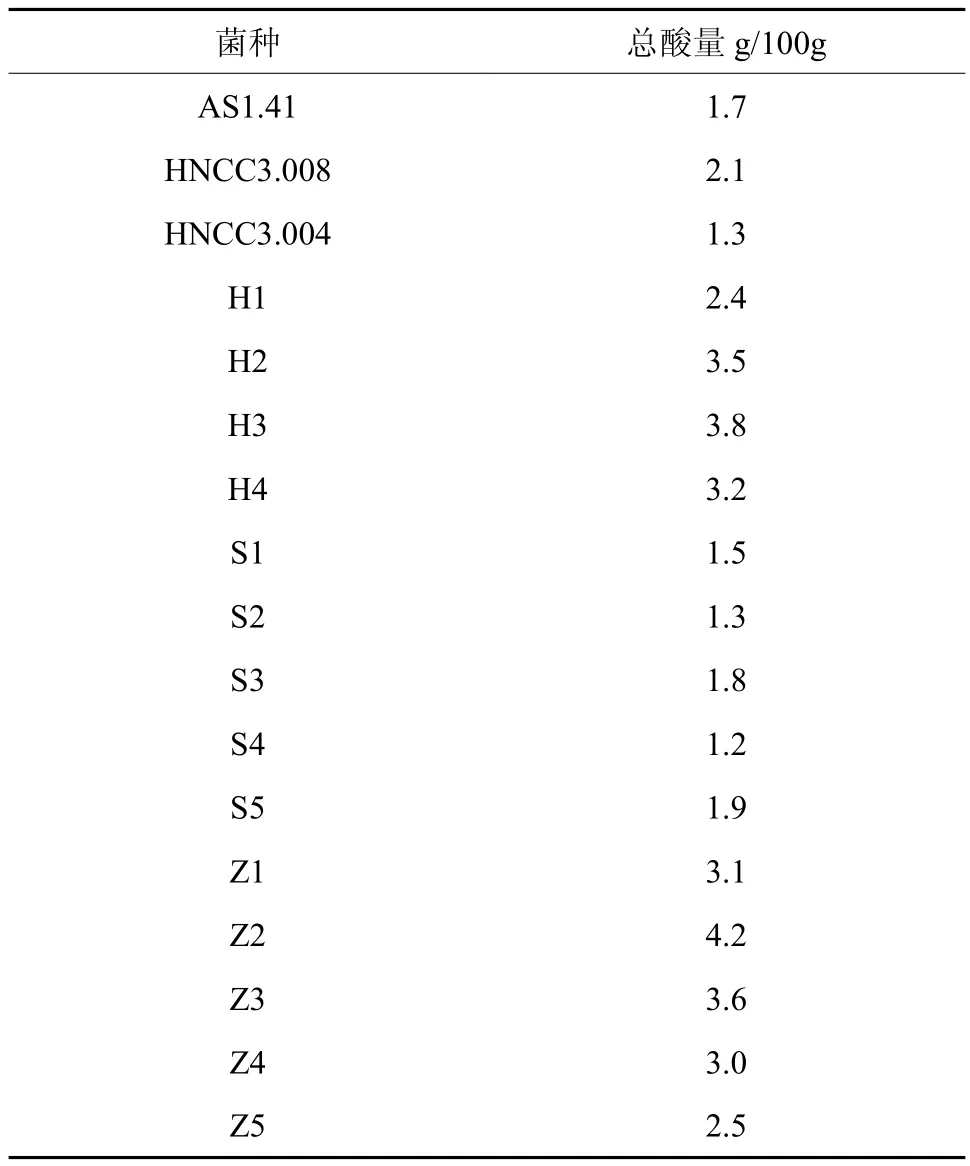
表1 各醋酸菌初筛产酸量Table 1 Acid yield of preliminary selected strains
2.3 菌种复筛
2.3.1 菌株的酒精耐受性
由图1可知,随着酒精度的提升H3和Z2的产酸能力越来越大。H2酒精度到12°Be′时产酸能力最大,之后就逐渐降低。Z3酒精耐受性较差,当酒精度为10°Be′时达到产酸能力高峰,之后产酸能力逐渐减弱。由此得出Z2和H3的酒精耐受性是最好的。
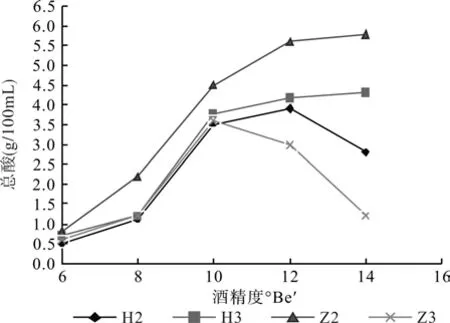
图1 4种菌株的酒精耐受性Fig.1 Tolerance of 4 strains to ethanol
2.3.2 菌株产酸速度试验
从图2可以看出,Z2发酵的前8天产酸速度较慢,发酵的第8天到第10天产酸速度有个突越。H3发酵的前10天速度很慢,发酵的第10天到第12天产酸速度有个突越。Z2的发酵突越时间较早,且产酸能力较强。

图2 2株菌株的醋酸产酸速度Fig.2 Acetic acid producing speeds of 2 strains
2.3.3 菌种的发酵产酸转化率
Z2菌株在竹笋酒精度为12°Be′时,分别在第2天、第4天、第6天、第8天、第10天、第12天、第14天、第16天、第18天、第20天计算其发酵产酸转化率见表2。当发酵的18天发酵产酸转化率达到最高稳定值98%。
2.3.4 遗传稳定性
将Z2斜面培养传代5次,观察菌落特征和革兰氏染色后的个体形态均一致,个体形态正常。各代产酸能力见表3。
由表2可知,Z2在传代过程中遗传到第四代开始,产酸能力有所下降,下降幅度仅为2.3%,稳定性比较好。

表2 Z2菌株不同时间发酵产酸转化率Table 2 Percent conversion of fermentation and producing acid of Z2 strains at different time

表3 遗传稳定性试验Table 3 Results of genetic stability tests
2.4 16S rDNA鉴定
2.4.1 PCR扩增

PCR扩增体系(10mL)Buffer 1mL dNTP 0.75mL DNA 0.5mL primer+ 0.5mL primer- 0.5mL Taq酶 0.1mL水6.65mL共 10mL
PCR扩增条件,94℃ 预变性5min,94℃变性30s,52℃退火 30s,72℃延伸30min,循环35次。72℃延伸10min,4℃保持,1.0%的琼脂糖凝胶电泳,95 V 30min检测扩增片段,见图3。16S扩增中正负引物分别为27F和1492R。

图3 Z2的PCR扩增图谱Fig.3 Agarose gel electrophoresis analysis of Z2
2.4.2 测序基序列分析
挑选阳性克隆送中美泰和生物技术(北京)有限公司测序,序列在NCBI上和GenBank中的比对数据,在比对匹配度最高的结果中,菌种的所测得到的16S rDNA 序列部分与Acetobacter pasteurianus(巴氏醋酸杆菌)的16S rDNA 序列有99%的同源性,可确定菌属为Acetobacter pasteurianus(巴氏醋酸杆菌),将其命名为Z2巴氏醋酸杆菌。
3 结 论
从 AS 1.41、HNCC3.008、HNCC3.004、A1-5、S1-5、Z1-5中筛选醋酸菌,筛选出耐酒精性能优良、产酸速度快、遗传稳定的醋酸菌Z2。可由此菌株发酵获得高醋酸转化率、发酵周期短、产酸量高的醋。经过16SDNA测序鉴定,该菌株为巴士醋酸杆菌,并将其命名为Z2巴士醋酸杆菌。
[1] 苏文会.基于生长和养分积累规律的毛竹林施肥理论与实践研究[D].中国林业科学研究院,2012.
[2] 萧凤岐.食醋的历史与文化 [J].中国酿造,2000(04):31-32.
[3] 宋芝强.苹果醋市场状况分析及发展前景[J].中国酿造,2002,5(5):4-5.
[4] 魏长庆,王海庆,张 凌,等.葡萄果醋发酵用醋酸茵的分离及鉴定[J].中国酿造,20104.4(217):42-44.
[5] 余稳稳,吴 晖,郭亚鹏,等.伯良乳酸菌种混合发酵研制大米饮料的工艺研究[J] .现代食品科技,2012,28(01):69-71
[6] 孙文瑛,陈 雄,王 志,等.耐高温高醇醋酸茵的筛选及其发酵工艺的初步优化[J].中国酿造,2011,1(226):44-47
[7] 刘 剑,刘君昂,周国英,等,竹材木质素高效降解菌的分离筛选及鉴定[J].中南林业科技大学学报,2014.34(8)48-51.
[8] 赵 莹,周国英,高月庭,等.油茶叶枯病拮抗放线菌 GR54发酵条件的优化[J] .中南林业科技大学学报,2013.33(7)81-83.
[9] 麻成金,黄 群,欧阳玉祝.枇杷果醋及其饮料的研制[J].中国酿造,2006,(6):7l-74.
[10] 杨 颖,刘欠欠,陆胜民,等.青梅果醋醋酸发酵菌种的筛选与鉴定[J].中国食品学报,2010,6(10):64-67.
[11] 姜晓芝,李志西.产酸菌株的分离及初步鉴定[J].中国酿造,2008,(23):53-56.
[12] Peter H A,Nicholas S M,Elisabetll M S,et a1.Bergey’s manual of systematic bacteriology Vol.2[M].Baltirrlore,Maryland,America:Wiuiams Wilkins Co.,1986.
[13] 傅本重,王立华,李国元,等.板栗实腐病菌 rDNA-ITS 的RFLP 和测序分析[J].经济林研究,2014,32(2):9-13.
[14] 董 娇,周 军,辛培尧,等.巍山红雪梨PpPAL基因的克隆及生物信息学分析[J].经济林研究,2014.32(1):51-53.
Screening for Acetobacter spp.form spring shoot of Phyllostachys pubescens vinegar fermentation
TU Jia,AI Wen-sheng,YANG Ming,PU Xiang-yun,MENG Yong,LI Mei-qun
(Hunan Academy of Forestry,Changsha 410004,Hunan,China)
Commercial acetic acid bacteria,acetic acid bacteria isolated from red yeast rice vinegar,acetic acid bacteria isolated from Shanxi vinegar and acetic acid bacteria isolated from bamboo vinegar were used as the fermentation bacteria.By adopting puri fi cation culture method,producing acid qualitative test,four strains of acetic acid bacteria were preliminarily screened out.Through alcohol resistance test,acid production rate test and the genetic stability test,an acetic acid bacteria Z2 was selected.The results show that:the obtained Z2 had high acid production rate,high yield,high acidity and high hereditary stability.By 16SrDNA sequencing analysis,Z2 was identi fi ed as Acetobacter pasteurianus.
Phyllostachys pubescens; moso bamboo spring shoot; mao bamboo vinegar; acetic acid bacteria; screening
S795.9;TS201.3
A
1673-923X(2015)07-0131-05
10.14067/j.cnki.1673-923x.2015.07.024
2014-10-10
国家“十二五”科技支撑计划项目(2012BAD21B03);长沙市科技局富硒笋定向高效培育及低碳加工关键技术研究
涂 佳,助理研究员,博士;E-mail:65198218@qq.com
涂 佳,艾文胜,杨 明,等.毛竹笋醋醋酸菌的筛选[J].中南林业科技大学学报,2015,35(7):131-135.
[本文编校:吴 毅]

