基于杨木纤维发酵产丁醇工艺条件的研究
钟 洁,王义强,b,c,华涟滩,王启业,罗 浪
(中南林业科技大学 a.经济林培育与保护教育部重点实验室;b.生物技术实验室;c.国家林业局生物乙醇研究中心,,湖南 长沙 410004)
基于杨木纤维发酵产丁醇工艺条件的研究
钟 洁a,王义强a,b,c,华涟滩a,王启业a,罗 浪a
(中南林业科技大学 a.经济林培育与保护教育部重点实验室;b.生物技术实验室;c.国家林业局生物乙醇研究中心,,湖南 长沙 410004)
丁醇作为新一代生物燃料,已经成为世界研究的热点。利用本实验选育的丁醇高产突变株——拜氏梭菌Clostridium beijerinckii U-57,以杨木蒸汽爆破渣为原料发酵产丁醇。结果表明:杨木蒸汽爆破渣糖化液经分步糖化发酵和同步糖化发酵,丁醇产量分别为2.19、1.79g/L;进而对同步糖化发酵条件进行正交设计优化,优化后同步糖化发酵得到的丁醇和总溶剂产量分别为2.16、3.44g/L,比之前提高了20.7%、16.7%。该研究首次探讨了杨木纤维发酵产丁醇的工艺条件,为进一步提高产量提供了基础。
生物燃料;丁醇;杨木纤维;拜氏梭菌U-57;同步糖化发酵
能源的利用和再生已成为制约人类社会生存和发展一大限制因数。随着世界经济的迅猛发展,石油、天然气、煤炭与核能等化石能源被广泛发掘利用,但是,化石能源将在21世纪上半叶接近枯竭[1]。石化资源的耗竭以及温室效应的日趋严重,促使人们寻找环境友好型,经济可行性,能够替代化石能源的新能源。丁醇作为燃料,其热值和汽油相当,在能源方面显示出无与伦比的优越性[2-3]。
传统的丁醇发酵以淀粉、糖蜜为主要原料,国内生物丁醇生产主要以木薯、玉米等粮食为主。苏海锋、杨登峰[4]以木薯为原料,经过逐步驯化Clostridium beijerinckii NCIMB 8052的丁醇耐受性后,在180h得到的丁醇的产量为7.3g/L;裴建新、左文朴等[5]利用玉米为原料,在添加了5%的葡萄糖的培养基中获得的丁醇产量为10.05g/L。在粮食短缺与能源危机的双重威胁下,探索纤维质原料生产燃料丁醇成为生物质能源发展战略的重要组成部分。Ziyong Li[6]等利用麦麸进行72h发酵后,得到的丙酮、丁醇、乙醇的产量分别为:2.2h/L、8.8g/L、0.2g/L;Qureshi N[7]研究发现Clostridium beijerinckii P260利用86g/L小麦秸秆水解液(相当于62g/L葡萄糖)可产生25g/L的总溶剂(丙酮、丁醇和乙醇)。可见,木质纤维在代替以往的糖蜜、粮食发酵生产丁醇具有不可估量的潜力[8]。本文以杨木为原料,其不仅具有早期速生、适应性强、分布广、生物量高和存量巨大等特点,而且还是木料加工业的重要原料,也是潜在的重要能源作物之一[9-10]。通过蒸汽爆破方法对杨木进行预处理,将获得的杨木爆破渣经纤维素酶水解所得的糖化液,然后发酵产丁醇,分别从分步糖化发酵和同步糖化发酵两个工艺初步探讨丁醇及总溶剂的产量。
1 材料与方法
1.1 菌种与培养基
1.1.1 菌 种
拜氏梭菌Clostridium beijerinckii U-57,由美国菌种保藏中心拜氏梭菌 Clostridium beijerinckii ATCC 55025经本实验室紫外诱变选育获得,保藏于中国典型培养物保藏中心,注册号为CCICC M 2013208。
1.1.2 培养基
活化培养基:葡萄糖5.0g、酵母浸粉3.0g、胰蛋白胨10.0g、牛肉膏10.0g、三水合乙酸钠3.0g、氯化钠5.0g、可溶性淀粉1.0g、L-半胱氨酸盐酸盐0.5g、蒸馏水1.0L,pH值 6.8。
种子培养基:葡萄糖25.0g/L、酵母浸粉1.5g/L、硫酸铵3.0g/L、七水硫酸镁 0.37g/L、磷酸二氢钾1.0g/L、七水合硫酸亚铁0.015g/L、碳酸钙4.45g/L、L-半胱氨酸盐酸盐0.75g/L、蒸馏水1.0L,pH 值 6.8。
发酵培养基:杨木爆破渣糖化液1L,酵母浸粉1.5g/L、醋酸铵3.82g/L、七水硫酸镁0.2g/L、磷酸二氢钾0.75g/L、七水合硫酸亚铁0.02g/L、碳酸钙2.60g/L、硫酸锰0.01g/L、L-半胱氨酸盐酸盐0.5g/L,调pH值到6.8。
1.2 方 法
1.2.1 杨木爆破渣糖化液的制备
将杨木爆破渣于烘箱中烘干至恒重,准确称取烘干后的杨木爆破渣50.0g,加入蒸馏水1.0L,115℃高压蒸汽灭菌20min,纤维素酶载入量为20 FPIU/g,经0.45μm无菌滤膜过滤,静置45h后可得杨木爆破渣糖化液。
1.2.2 杨木蒸汽爆破渣酶解条件的确定
(1)酶解温度的确定:选取温度分别为30、35、40、45、50、55、60℃,pH值为溶液自然pH值,每组3个平行,酶解48h后测酶解液中还原糖含量。
(2)酶解pH值的确定:固定温度为最适酶解温度,选取初始pH值为3、4、4.5、5、5.5、6、6.5,每组3个平行,酶解48h后测酶解液中还原糖含量。
(3)酶解时间的确定:固定温度及pH值为最适值,酶解的过程中分别按9、18、27、36、45、54、63h取样,每组3个平行,测酶解液中还原糖含量。
1.2.3 分步糖化发酵
利用上述酶解条件,以杨木爆破渣酶解后的糖化液作为碳源发酵产丁醇。发酵培养基见1.1.2,发酵条件为温度37℃,发酵pH值为6.5,接种量6%,装液量为85%,厌氧发酵84h。5个平行,每隔12h取样测发酵液中溶剂含量和残糖含量。
1.2.4 同步糖化发酵
将纤维素的水解和菌株发酵产丁醇的过程在同一容器内连续进行,同步糖化发酵培养基见1.1.2,发酵条件与分步糖化发酵相同,以发酵液中溶剂含量和残糖含量为指标,探讨同步糖化发酵的结果。
1.2.5 同步糖化发酵实验条件优化
(1)单因素试验:温度上,分别选取37、38、39、40、41、42、43℃做单因素试验,其余条件为发酵pH值 6.5,接种量6%,装液量为85%,以溶剂产量为指标,每组3个平行。固定温度为最适发酵温度,选取发酵pH值分别为5.5、5.7、5.9、6.1、6.3、6.5,其余同上;固定温度及pH值为最适值,选取接种量分别为1%、2%、3%、4%、5%、6%、7%,装液量为85%,每组3个平行,测定厌氧发酵72h后的溶剂产量。
(2)同步糖化发酵条件的正交试验:在上述单因素实验的基础上,对温度、发酵pH值、接种量进行正交实验,从而确定较佳的发酵条件组合。
1.2.6 检测方法
(1)还原糖含量测定采用DNS法[11-15]
(2)丁醇气相检测方法:将发酵液于12 000r/min下离心10min,取上清液,重复上述操作一次,0.45μm孔径滤膜,过滤。气相色参数如下,色谱柱:安捷伦HP-INNOWAX,30m×0.25mm;检测器:FID;以氮气为载气,流速为35mL/min,氢气流速为35mL/min,空气流速为350mL/min;初始柱温45℃,保留1min,然后以5℃/min升至150℃,保留2min;进样口温度为180℃;检测器温度为200℃;进样量为1μL,分流比为1∶60,外标法定量。
2 结果与讨论
2.1 杨木蒸汽爆破渣酶解条件的确定
杨木爆破渣酶解后所得还原糖含量的多少,直接影响发酵产物的产量。通过温度、pH值和时间3个单因素试验,确定杨木蒸汽爆破渣最适酶解条件,试验结果如图1、2、3所示。
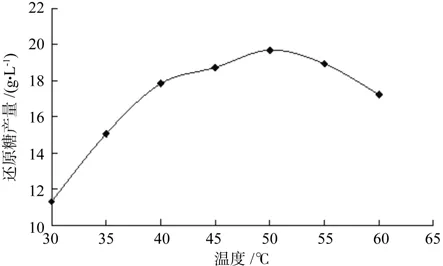
图1 酶解温度对还原糖产量的影响Fig.1 Effect of different temperature on production of reducing sugar
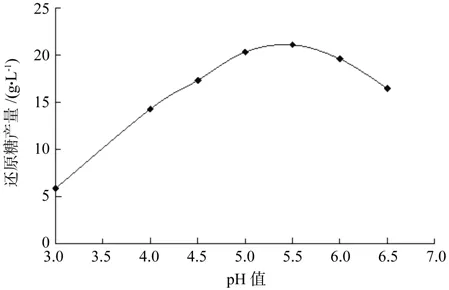
图2 初始pH值对还原糖产量的影响Fig.2 Effect of initial pH on production of reducing sugar
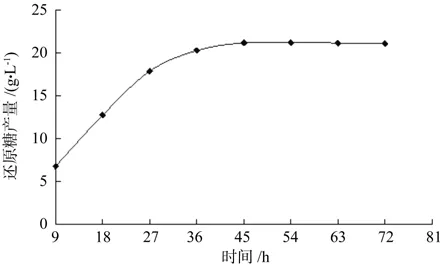
图3 酶解时间对还原糖产量的影响Fig.3 Effect of enzymolysis time on production of reducing sugar
以还原糖产量为考察指标,不同酶解温度对酶解效果的影响见图1。从图1可知,当酶解温度较低时,还原糖产量并不高,这可能是由于温度过低,酶的活性不高从而影响纤维素酶的酶解效果;当酶解温度从30℃升至50℃时,随着酶解温度的升高,还原糖的产量也逐渐增加,在50℃时达到最高值,可见50℃有可能是此纤维素酶的最适温度。当温度继续上升时,还原糖的产量反而降低,这可能是高温引起此酶的活性中心改变而导致酶失活,因此选择的酶解温度为50℃。
pH值能改变蛋白质分子的电荷,从而影响酶的活性。不同初始pH值对酶解效果的影响见图2:当 初始pH值较低时,还原产量很低,当pH值=3时,还原糖产量不足6g/L,较低的pH值严重抑制酶的活性;当初始pH值为5.5时,还原糖产量达到最大。进一步升高pH值时,还原糖产量呈现不增反减的趋势,因此选择的酶解初始pH值为5.5。
酶解时间的充分与否直接影响还原糖的产量。在一定范围内,酶解时间越长,酶与底物的反应越充分,还原糖产量越高;但长时间的酶解又会使已还原产物发生部分的氧化,从而且造成时间与物质的浪费。不同酶解时间对还原糖产量的影响见图3:由图可知,随着时间的增加,还原糖产量也随之增加;在54h时达到最大,54h后还原糖含量有轻微的降低,同时由于还原糖在45h时跟54h时的产量相差不大,综合考虑,选择的酶解时间为45h。
综合以上实验确定了杨木蒸汽爆破渣适宜酶解条件为:温度为50℃,初始pH值为5.5,时间为45h。该条件下,50g杨木蒸汽爆破渣酶解后还原糖平均产量为21.14g。
2.2 分步糖化发酵结果
分步糖化发酵结果见图4。由图可知,24h之前,丁醇和总溶剂(丁醇、丙酮和乙醇)产量增长缓慢,还原糖的消耗曲线与溶剂增长曲线相比较陡;24~60h丁醇和总溶剂产量极具增加,同时伴随着还原糖的迅速消耗;60h后,丁醇和总溶剂及还原糖含量曲线均接近直线。根据微生物典型生长曲线[12]可知:发酵初期,菌体生长处于延滞期,对发酵培养基的适应需要一定时间,从而对还原糖的需求不是太大,因而溶剂产量低;24h后,菌体生长进入指数生长期,导致还原糖迅速消耗,发酵产物开始累积;60h后,菌体生长进入稳定期,溶剂产量增加非常缓慢。发酵72h的丁醇和总溶剂产量分别2.19、3.57g/L,低于相同质量葡萄糖的发酵产量(丁醇3.07g/L、总溶剂5.25g/L),究其原因,可能是由于杨木蒸汽爆破渣酶解糖化液中存在某些对菌体正常代谢有抑制作用的物质,这还需要做进一步的实验进行考察。
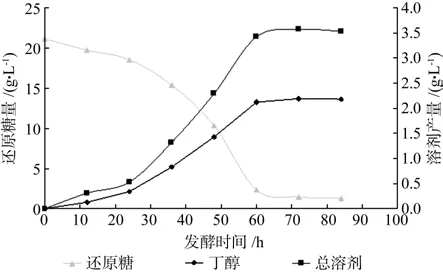
图4 分步糖化发酵结果Fig.4 Result of step by step hydrolysis and fermentation(SHF)
2.3 同步糖化发酵结果
从图5可知,24h前,丁醇和总溶剂产量低,24~60h丁醇和总溶剂产量增加迅速,60h后丁醇和总溶剂产量的增加非常缓慢。在整个发酵过程中,还原糖浓度维持在1.28~2.30g/L之间。发酵初期,菌体生长繁殖缓慢,溶剂产量低,可能是菌体在对新环境的适应;24h至60h,菌体数量对数增涨,生长代谢旺盛,溶剂产量增加较迅速;60h后,由于还原糖的消耗,缺乏发酵底物,菌体生长代谢受到抑制,因此溶剂产量曲线处于持平状态。发酵84h测得最大丁醇和总溶剂产量分别为1.79、2.88g/L,低于分步糖化发酵。可能是因为菌体生长代谢所需要的适宜条件与酶解的适宜条件存在着矛盾,因此进一步对同步糖化发酵条件进行优化。
2.4 同步糖化发酵的优化
2.4.1 单因素试验结果
发酵温度对同步糖化发酵影响结果见图6。从图中可知,适当的提高发酵温度,能提高丁醇和总溶剂的产量,但是温度高于40时,溶剂产量却迅速降低。由此可见,之前确定的最适酶解温度(50℃)并不适宜菌体的生长代谢。高温可能导致菌体内一些组成酶发生变性失活,甚至能使菌体死亡。因此选择的最适发酵温度为40℃。
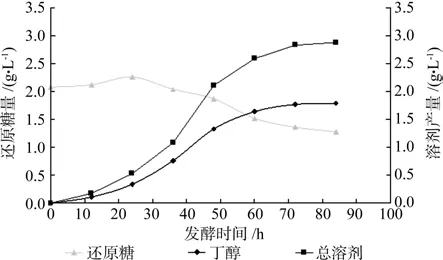
图5 同步糖化发酵结果Fig.5 Result of simultaneous sacchari fi cation and fermentation(SSF)
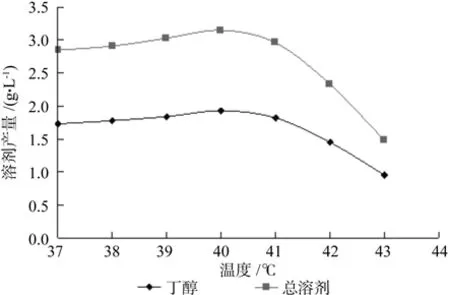
图6 发酵温度对同步糖化发酵的影响Fig.6 Effect of temperature on simultaneous SSF
发酵pH值对同步糖化发酵影响结果见图7。从图中可知,当初始pH值为5.9时,丁醇和总溶剂产量达到最大,高于或低于这个值,丁醇和总溶剂产量都呈下降的趋势。但纤维素酶的最适酶解pH值为5.5,菌体适宜生长发酵pH值为6.5,因而在低pH值有利于酶解而不利发酵,高pH值有利发酵而不利酶解的矛盾中,选择的初始pH值为5.9。
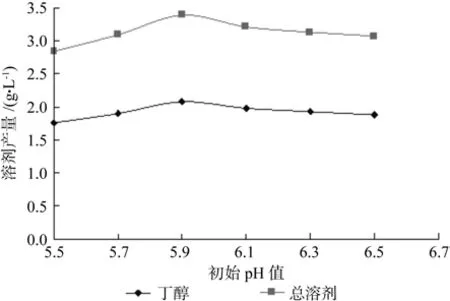
图7 发酵pH值对同步糖化发酵的影响Fig.7 Effect of initial pH on simultaneous SSF
接种量对同步糖化发酵影响结果见图8。从图中可知,接种量在4%之前,随着接种量的增加,丁醇和总溶剂产量也相应增大,在4%时达到最大;接种量超过4%,继续增大接种量,丁醇和总溶剂产量反而降低。接种量较低时,菌体需要消耗更多的营养进行生长繁殖来增加菌体数目,从而导致代谢产物较少;当接种量过大时,菌体对发酵液的营养迅速吸收,造成酶解的还原糖供不应求,不利于代谢产物的累积,从而导致溶剂产量降低。因此选择的接种量为4%。
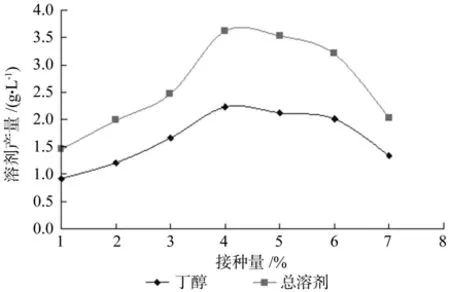
图8 接种量对同步糖化发酵的影响Fig.8 Effect of inoculums volume on simultaneous SSF
2.3.2 同步糖化发酵条件的正交实验
在同步糖化发酵条件单因素实验的基础上,对发酵所需的温度、pH值、接种量做进一步做正交实验,采用L9(34)正交表设计实验,因素水平表见表1。
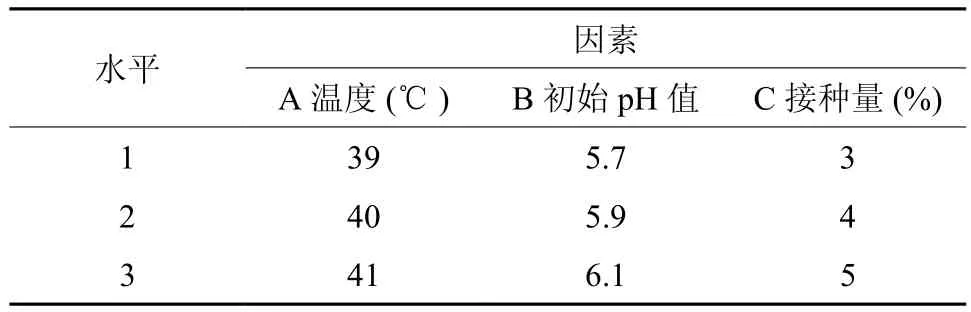
表1 正交实验因素水平Table 1 Factors and levels of orthogonal experiments
通过L9(34)正交表设计的方案,进行发酵实验,每组3个平行,正交实验方案及结果见表2。
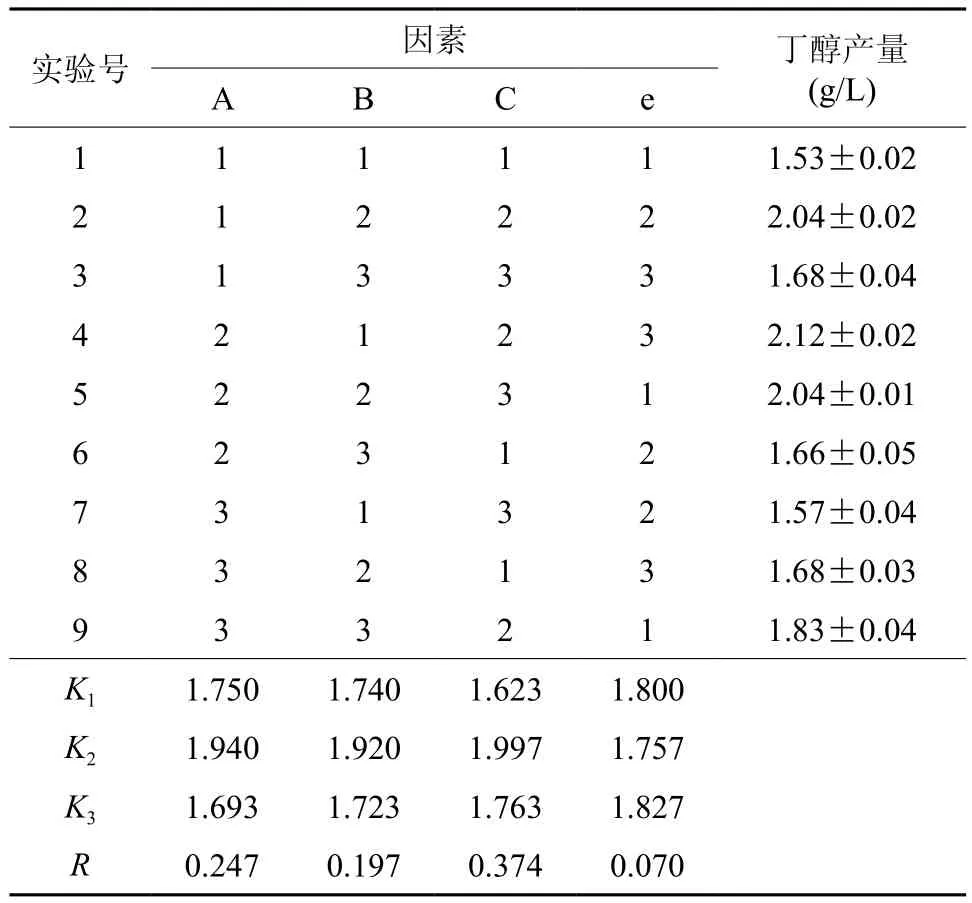
表2 正交实验结果Table 2 Results of orthogonal experiments
对正交实验结果进行方差分析,分析结果见表3。
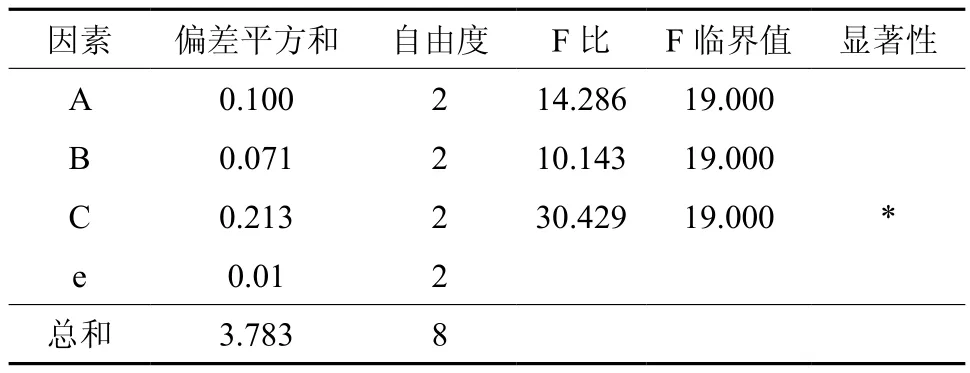
表3 正交实验方差分析和显著性检验†Table 3 Variance analysis and significant test of orthogonal experiments
从表3可知,C对丁醇的产量的影响显著,A和B有影响但不显著。A、B和C 3因素对丁醇产量的影响主次顺序为C>A>B,即接种量>温度>初始pH值。从表4.3可知,发酵的最佳条件为A2B1C2,与正交试验结果直观分析得到的最优发酵条件A2B2C2不一致,因此需要对两组条件进行验证实验。验证实验结果见表4。
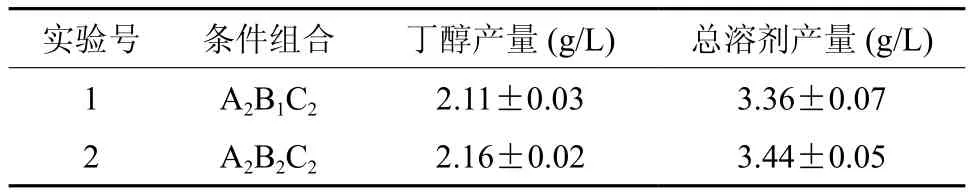
表4 发酵条件优化验证试验结果Table 4 Verified experiment results of optimization of fermentation conditions
从表4可知,A2B2C2条件组合丁醇产量和总溶剂产量大于A2B1C2条件组合。因此,通过正交实验优化适宜的发酵条件组合为:温度40℃、初始pH值 5.9、接种量为4%,此时发酵得到的丁醇和总溶剂产量分别为2.16g/L、3.44g/L,比之前提高了20.7%、16.7%。
3 结 论
对杨木蒸汽爆破渣酶解糖化条件进行了探讨,确定了酶解糖化适宜的条件组合:温度50℃、时间45h、初始pH值 5.5。在此条件下,50g杨木蒸汽爆破渣酶解糖化后含还原糖21.14g,还原糖得率达42.28%。在此基础上,对杨木蒸汽爆破渣糖化液进行了分步糖化发酵实验,丁醇和总溶剂产量分别为2.19、3.57g/L。同时对杨木蒸汽爆破渣进行了同步糖化发酵,得到丁醇和总溶剂产量分别为1.79、2.88g/L;进而通过正交试验对同步糖化发酵条件进行优化,优化后丁醇和总溶剂产量分别提高了20.7%、16.7%。该研究首次探讨了杨木纤维发酵产丁醇的工艺条件,为进一步提高产量提供了基础。
[1] 顾 阳,蒋 宇,吴 辉,等.生物丁醇制造技术现状和展望[J].生物工程学报,2010,26(7):914-923.
[2] LEE S Y,PARK J H,JANG S H,et al.Fermentative butanol production by Clostridia[J].Biotechnology and Bioengineering,2008,101(2):209-228.
[3] 靳孝庆,王桂兰,何冰芳.丙酮丁醇发酵的研究进展及其高产策略[J].化工进展,2007,26(12):1727-1732.
[4] 苏海锋,杨登峰.拜氏梭菌Clostridium beijerinckii NCIMB 8052在木薯发酵中耐高浓度丁醇的菌株筛选[J].酿酒科技,2010,(9):36-39.
[5] 裴建新,左文朴,庞 浩,等.高产生物丁醇新菌株的筛选、鉴定及发酵研究[J].可再生能源,2011,29(5),99-102.
[6] Ziyong Liu,Yu Ying,Fuli Li,et al.Butanol production by Clostridium beijerinckii ATCC 55025 from wheat bran[J].Joural of Industrial Microbiology and Biotechnology,2010,37(5):495-501.
[7] Nasib Qureshi,Badal C.Saha,Michael A.Cotta.Butanol production from wheat straw hydrolysate using Clostridium beijerinckii[J].Bioprocess Biosyst.Eng.,2007,30:419-427.
[8] 孙彦平,靳艳玲,李新波,等.木质纤维素生产燃料丁醇工艺的研究进展[J].中国酿造,2010,11:17-22.
[9] Davis JM.Genetic improvement of poplar(Populus spp.)as a bioenergy crop[J].Genetic Improvement of Bioenergy Crops,2008,doi:10.1007/978-0-387-70805- _14.
[10] Yemshanov D,McKenney D.Fast-growing poplar plantations as a bioenergy supply source for Canada[J].Biomass & Bioenergy,2008,32(3):185-197.
[11] 查岭生,胡 鹏,吴晓敏,等.DNS法测定植物组织中还原糖及总糖含量实验的改进[J].安徽农学通报2013,19(11):16,26.
[12] 王风芹,谢 慧,楚乐然,等.产丁醇芽孢杆菌的分离、筛选与鉴定[J].微生物学通报,2010,37(1):7-11.
[13] 杨海清,李忠海,张 慧,等.以左旋芳樟醇为主要原料配制复方精油的研究[J].中南林业科技大学学报,2013,33(3):112-114,128.
[14] 李桂珍,梁忠云,陈海燕,等.芳樟叶油中芳樟醇的单离工艺条件[J].经济林研究,2013,31(4):195-198.
[15] 周德庆.微生物学教程[M].2版.北京:高等教育出版社,2002,5:153-157
Study on fermentation condition for producing butanol from poplar fi bers
ZHONG Jiea,WANG Yi-qianga,b,c,HUA Lian-tana,WANG Qi-yea,LUO Langa
(a.Biotechnology Lab.of Central South University of Forestry and Technology; b.Key Lab.of Non-wood Forest Nurturing and Protection of China Education Ministry; c.Bio-ethanol Research Center of State Forestry Administration,Central South University of Forestry and Technology,Changsha 410004,Hunan,China)
Butanol,as a new generation of biofuel,has become one of the research hotspots in the world.The high-yield mutant strains(Clostridium beijerinckii U-57),was bred by author in the early days of the study,and by taking the aspen steam explosion residues as the raw materials,the butanol was produced with fermentation process.The results show that the aspen steam explosion residue sacchari fi cation liquid were treated through separate hydrolysis fermentation and simultaneous sacchari fi cation fermentation(SSF),and butanol was obtained,the yield of butanol were 2.19g/L and 1.79g/L,respectively; By optimizing the conditions of SSF,the production of butanol and total solvent were 2.16g/L and 3.44g/L,which were 20.7% and 16.7% higher than before.This study fi rstly discussed the fermentation condition of poplar fi ber to produce butanol,which provides some foundations to enhance the yield of butanol.
biofuel; butanol; poplar fi ber; Clostridium beijerinckii U-57; simultaneous sacchari fi cation and fermentation
S792.11
A
1673-923X(2015)07-0125-06
10.14067/j.cnki.1673-923x.2015.07.023
2014-10-10
国家林业局“948”项目(2011-4-13)
钟 洁,硕士研究生
王义强,教授,博士生导师,E-mail:wangyiqiang12@163.com
钟 洁,王义强,华涟滩,等.基于杨木纤维发酵产丁醇工艺条件的研究[J].中南林业科技大学学报,2015,35(7):125-130.
[本文编校:吴 毅]

