不同海拔川滇高山栎丙二醛和脯氨酸含量及其影响因子
赵 广,朱万泽,谢 静,王尧尧
(1.中国科学院 水利部成都山地灾害与环境研究所,四川 成都 610041;2.中国科学院大学,北京 100049)
不同海拔川滇高山栎丙二醛和脯氨酸含量及其影响因子
赵 广1,2,朱万泽1,谢 静1,2,王尧尧1,2
(1.中国科学院 水利部成都山地灾害与环境研究所,四川 成都 610041;2.中国科学院大学,北京 100049)
川滇高山栎(Quercus aquifolioides)是云南西北部、四川西部和西藏东南部的特有树种。以川西折多山川滇高山栎灌丛为研究对象,测定了不同海拔川滇高山栎叶片、嫩枝、树皮以及细根的丙二醛和脯氨酸含量。结果表明,叶片丙二醛和脯氨酸含量显著高于其他组织;随着海拔升高,灌丛地上组织丙二醛和脯氨酸含量呈增加趋势,不同海拔细根含量差异不显著;除细根丙二醛含量外,其余组织丙二醛含量和所有组织脯氨酸含量均与温度和降水呈负相关关系。生长在高海拔的川滇高山栎灌丛遭受低温和干旱胁迫,组织丙二醛和脯氨酸与川滇高山栎受胁迫程度相关。
川滇高山栎;丙二醛;脯氨酸;影响因子;四川西部
川滇高山栎(Quercus aquifolioides)是云南西北部、四川西部和西藏东南部的特有树种,形成的硬叶常绿阔叶林主要分布在海拔2 400~3 900m的山地阳坡和半阳坡[1]。由于特有的抗寒、耐旱等抗逆形态特征,川滇高山栎广泛分布于土壤瘠薄、干旱、低温、紫外辐射强等环境恶劣、其他树种难适应的地段,常形成这些区域的顶级群落,且多分布于江河上游陡坡地带,对金沙江、岷江、澜沧江和雅鲁藏布江等江河源头,具有较好的水土保持和水源涵养功能[2]。
低温和干旱等胁迫环境下,植物体内会产生大量自由基,氧化细胞膜中不饱和脂肪酸,对膜结构和功能产生极大破坏[3]。丙二醛(MDA)是逆境条件下植物器官产生的过氧化产物,具有很强的细胞毒性,对膜和细胞中许多生物功能因子有很强的破坏作用[4]。脯氨酸(Pro)是植物逆境胁迫下产生的一种渗透调节物质,可以游离状态广泛存在于植物体内[5],并作为渗透调节物质在植物遭受胁迫时使蛋白质胶体亲水面积增大、可溶性蛋白质沉淀[6]。受到胁迫的植物体内游离氨基酸含量会迅速升高,从而增加细胞液的浓度,对细胞产生保护作用。
目前有关川滇高山栎种群特征、空间格局、水文、生物量、遗传多样性和生理特性等方面的报道比较多[7],但针对川滇高山栎以及硬叶栎类对逆境胁迫环境适应性机理的研究仍然十分缺乏[1]。本文以川西折多山川滇高山栎灌丛为研究对象,比较组织间丙二醛和脯氨酸含量差异,分析不同海拔下川滇高山栎丙二醛和脯氨酸含量与主要气象因子的关系,以期理解胁迫环境下植物的生理适应机制。
1 研究区概况及研究方法
1.1 研究区概况
研究区位于四川省甘孜州康定县折多山东坡(29°50′~30°16′N,101°41′~102°6′E),属青藏高原亚湿润气候区,日照充足,冬季寒冷,夏季凉爽。康定县城附近(海拔2 616m),年平均气温7.1℃,1月平均气温-2.5℃,7月平均气温15.8℃,≥10℃积温1 546℃,年日照1 712h;多年平均降水量804.5mm,降水年内分配不均,5~9月降水量占全年降水量的77.2%。研究区土壤是由花岗岩和砂岩发育而来的山地棕壤,pH为6.54±0.50。折多山海拔2 600~4 900m,垂直差异明显,立体气候特征显著,植被垂直带类型和生境随海拔及坡向而分异。研究地状况见表1。
1.2 样品和气象数据采集
取样时间为2009年4月,于海拔3 000m、3 500m和3 950m分别建立20m×20m高山栎灌丛样带,每个样带中随机选择6丛灌丛。为使所取样品具有代表性以及分析不同部位丙二醛和脯氨酸含量差异,按叶片、嫩枝、树皮和细根(<2.5mm)进行取样,每次取样共6个重复。样品储存在液氮罐中,带回实验室测定。各样带的温度和降水量数据由设置的微型气象站观测而得。

表1 样地及折多山东坡川滇高山栎灌丛概况Table 1 General situations of Q.aquifolioides shrubs growing on eastern slope of Mt.Zheduo
1.3 测定方法
丙二醛含量测定采用硫代巴比妥酸法(TBA);脯氨酸含量测定采用茚三酮比色法[18]。
1.4 数据分析
采用SPSS 20对数据进行单因素方差分析(One-way ANOVA),分析不同海拔、不同组织间丙二醛和脯氨酸含量差异;当测验存在显著差异时,各水平间的多重比较采用最小显著极差法(Duncan’s new multiple range test)。
2 结果与分析
2.1 川滇高山栎组织丙二醛和脯氨酸含量
川滇高山栎不同组织丙二醛和脯氨酸含量差异显著(P<0.05)(图 1)。叶片丙二醛和脯氨酸含量最高,且显著高于其他组织(P<0.05),分别为29.98 mmol/g和164.22 μg/g。不同组织丙二醛和脯氨酸含量均表现为叶片>细根>嫩枝>树皮。

图1 川滇高山栎组织丙二醛和脯氨酸含量Fig.1 MDA and Pro contents in organ tissues of Q.aquifolioides
2.2 不同海拔川滇高山栎组织丙二醛和脯氨酸含量
不同海拔间川滇高山栎组织丙二醛含量差异显著(P<0.05)(图2)。随着海拔升高,地上组织(叶片、嫩枝和树皮)丙二醛含量呈增加趋势;细根丙二醛含量逐渐较少,以海拔3 950m最低。

图2 不同海拔川滇高山栎组织丙二醛含量Fig.2 MDA contents changes in organ tissues of Q.aquifolioides at different altitudes
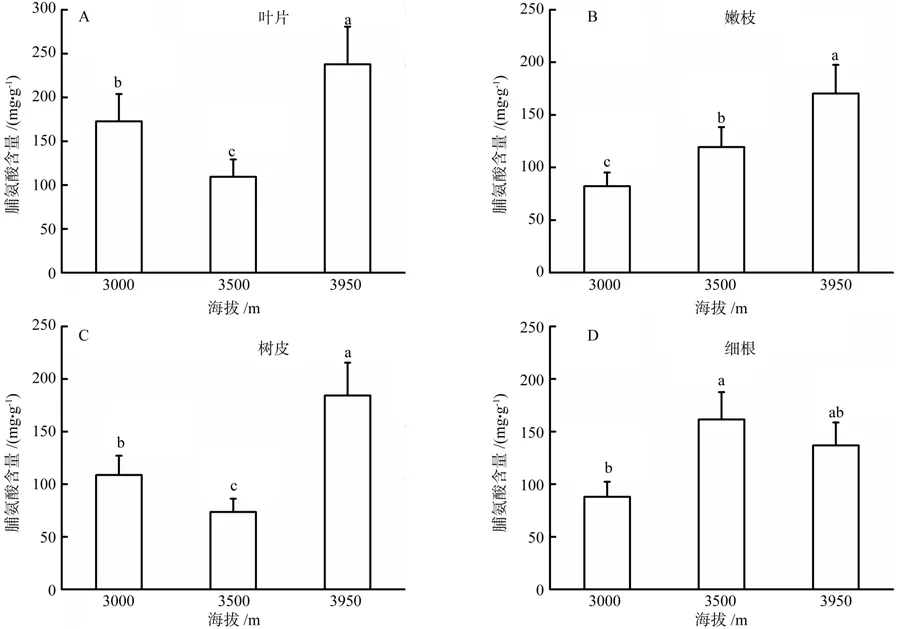
图3 不同海拔川滇高山栎组织脯氨酸含量Fig.3 Pro contents changes in organ tissue of Q.aquifolioides at different altitudes
不同海拔间川滇高山栎组织脯氨酸含量差异显著(P<0.05)(图 3)。随海拔升高,嫩枝脯氨酸含量增多(图 3B)。海拔3 950m取样的叶片和树皮脯氨酸含量最高,整体表现为3 950m>3 000m>3 500m(图 3A;图3C)。细根脯氨酸含量在海拔3 500m最高,3 950m次之(图 3D)。
2.3 川滇高山栎组织丙二醛含量与主要气象因子的关系
川滇高山栎组织丙二醛和脯氨酸含量与气温和降水相关,但与不同组织的相关程度不同(表 2;表 3)。结果显示,各组织丙二醛含量与气温和降水均呈负相关(除细根),其中嫩枝丙二醛含量和气温极显著负相关(P<0.01);细根丙二醛含量与气温和降水呈正相关。各组织脯氨酸含量与气温和降水均呈负相关关系,叶片丙二醛含量和降水极显著负相关(P<0.01)。

表2 川滇高山栎各组织丙二醛含量与气象因子的相关系数†Table 2 Correlation coefficients between MDA contents in Quercus aquifolioides and meteorological factors

表3 川滇高山栎各组织脯氨酸含量与气象因子的相关系数†Table 3 Correlation coefficients between Pro contents in Quercus aquifolioides and meteorological factors
3 讨 论
3.1 川滇高山栎不同组织丙二醛和脯氨酸含量差异
丙二醛含量能反应脂质过氧化水平和植物对逆境条件耐受的强弱,含量越高表明植物受损害程度越高[8]。川滇高山栎叶片丙二醛含量最高,细根次之,嫩枝和树皮最低,表明叶片和细根遭受的生理胁迫较严重。叶片脯氨酸含量在各组织中也最高,即叶片抗性大于嫩枝、树皮和细根。叶片是与环境接触面积最大、对环境变化最敏感的植物器官[9],其形态结构和生理功能变化被认为是对特定环境的适应性表现[10]。川滇高山栎叶片革质、坚硬、多刺,叶背密被黄色绒毛,即叶片兼有非肉质旱生植物和高山植物的性状[11],是川滇高山栎对环境广泛适应的形态基础。
脯氨酸是植物胁迫环境下的产物,许多研究通过测定脯氨酸含量来鉴定植物抗性强弱[18]。本研究中存在叶片脯氨酸大量积累的现象,从生理上表明叶片虽然易受环境胁迫,但具有较完善的抗逆机制。川滇高山栎灌丛地下细根发达[12],代谢速率快、生理活性强,对环境变化极为敏感,任何影响地上部分的环境因子都会对地下细根产生显著影响[13]。高寒环境下的细根丙二醛含量显著高于树皮和嫩枝,表明细根在遭受胁迫时更易发生过氧化反应。
3.2 川滇高山栎丙二醛和脯氨酸含量与主要气象因子的关系
植物随海拔变化会表现出生理生态适应性[14]。生长于高海拔极端环境的川滇高山栎,在忍受和适应低温、干旱及强紫外辐照等多种高山环境生态因子的过程中,形成了自身的保护和适应机制,并随环境因子改变发生积极、复杂的变化。Li等[15-16]研究川滇高山栎叶片形态和生理特征随海拔梯度变化时发现,叶片面积和气孔长度在2 800m最大,并认为2 800m附近为川滇高山栎生长最适宜海拔范围。本试验海拔均在2 800m以上,最高样地(3 950m)接近于折多山川滇高山栎分布上限高度(3 970m)[17]。从3 000m升至3 950m,研究区年平均温度从4.7℃骤降至-1.3℃,灌丛生长季时间、平均高度、密度和盖度都显著减少或下降,表明高海拔干寒气候严格限制了川滇高山栎的生长发育(表 1)。丙二醛和脯氨酸是反映植物受胁迫程度和抗性强弱的物质,与海拔高度相关[18]。但本研究中各组织丙二醛含量随海拔升高的上升趋势并不明显;各组织脯氨酸含量在海拔最高处最多,整体上随海拔升高变化不明显。不同海拔川滇高山栎丙二醛和脯氨酸含量表现出动态变化,这可能是气温和降水等多种环境因子综合作用的结果,反映出高山环境下植物体内过氧化产物和渗透调节物质含量变化的复杂性和适应性。
低温是植物生长发育的限制因子,也是高海拔植物生存首要忍受的环境胁迫[19]。本研究中,川滇高山栎组织(除根系外)丙二醛和脯氨酸含量随气温下降大致呈上升趋势。这表明低温会加重灌丛遭受的生理胁迫,同时高寒环境促进脯氨酸在川滇高山栎体内大量积累,并作为抗寒保护物质为高寒植物防寒或脱冻、再生或萌发提供营养和能量[20]。一些相关研究也印证了此结论,如青海云杉和祁连圆柏的叶片丙二醛含量与海拔梯度呈极显著正相关[21],长白山岳桦叶片丙二醛含量在高海拔明显高于低海拔[17],即高海拔低温环境下植物受胁迫加重,丙二醛含量增多。喜树在低温条件下会增加叶片的脯氨酸含量[22],以抵抗外界极端环境胁迫造成的伤害。
干旱是限制植物分布和生长发育的另一重要因子[23]。山区降雨量受水汽来源、坡向、坡度、开放度和经纬度等多种因子影响,随海拔升高变化较温度复杂。折多山降雨量随海拔升高大致呈先增多后减少的趋势,海拔3950m处降水量最少。研究中,川滇高山栎各组织(除根系外)丙二醛和脯氨酸在降水最少处含量最高,表明干旱影响两种物质在灌丛体内的积累。丙二醛含量增多是灌丛受胁迫程度加重的表现,而脯氨酸不断积累有助于细胞或组织持水,使该处川滇高山栎表现出高于其他海拔的抗旱性。王红梅等[24]对干旱胁迫下白刺花的研究发现,幼苗叶片内丙二醛和脯氨酸含量随着干旱胁迫加重而增多。而对水分胁迫下的结缕草[25]和冬小麦[26]丙二醛或脯氨酸含量测定表明,二者累积量随胁迫时间和强度增加而递增,和本研究结果相近。但也存在不同结果,如丙二醛和脯氨酸含量在水分胁迫加重过程中保持不变或降低[27],这还有待进一步探讨。
3.3 川滇高山栎受胁迫程度与组织丙二醛和脯氨酸的关系
逆境下植物体内丙二醛和脯氨酸积累已被证实为普遍现象[4,26,28],积累量被广泛应用于抗性鉴定。本研究中,川滇高山栎全株丙二醛和脯氨酸含量与温度和降水显著相关,表明组织丙二醛和脯氨酸含量与川滇高山栎受胁迫程度相关。但目前关于低温、干旱对脯氨酸代谢的调节机理了解不多,许多研究发现植物的抗性发展与游离脯氨酸增加相关,相反的结果也存在。今后研究可考虑采用多种抗性指标,如可溶性糖、超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等,综合评价植物受胁迫状况。
此外,随海拔升高,平均气温下降、大气压及CO2分压降低、辐射增加,这些环境变化会对植株形态和生理产生重要影响。因此,植物体内丙二醛和脯氨酸含量的变化应该是多种环境因子变化和植物自身机理调节综合作用的结果。本文分析了温度和降水对丙二醛与脯氨酸含量的影响,而实际环境中影响因子众多且复杂多变。今后需进一步开展相关试验,探讨其他环境因子对两种物质含量的影响,以揭示高寒植物的抗逆机制。
[1] 杨钦周.中国-喜马拉雅地区硬叶栎林的特点与分类[J].植物生态学与地植物学学报,1990,14(3):43-48.
[2] 陈俊华,刘兴良,何 飞,等.卧龙巴朗山川滇高山栎灌丛主要木本植物种群生态位特征[J].林业科学,2010,46(3):23-28.
[3] 王永红,李纪元,田 敏,等.低温胁迫对山茶物种2个抗寒性生理指标的影响[J].林业科学研究,2006,19(1):121-124.
[4] 李 明,王根轩.干旱胁迫对甘草幼苗保护酶活性及脂质过氧化作用的影响[J].生态学报,2002,22(4):503-507.
[5] Metha S K,Gaur J P.Heavy metal induced proline accumulation and its role in a meliorating metal toxicity in Chlorella vulgaris[J].New Phytologist,1999,143:253-259.
[6] Delauney A J,Verma D P S.Proline biosynthesis and osmoregulation in plants[J].The Plant Journal,1993,4(2):215-223.
[7] 胡宗达,刘世荣,史作民,等.不同海拔梯度川滇高山栎林土壤颗粒组成及养分含量[J].林业科学,2012,48(3):1-6.
[8] 赵天宏,孙加伟,付宇.逆境胁迫下植物活性氧代谢及外源调控机理的研究进展[J].作物杂志,2008,6:10-13.
[9] 张慧文,马剑英,孙 伟,等.不同海拔天山云杉叶功能性状及其与土壤因子的关系[J].生态学报,2010,30(21):5747-5758.
[10] 祁 建,马克明,张育新.辽东栎(Quercus liaotungensis)叶特性沿海拔梯度的变化及其环境解释[J].生态学报,2007,27(3):930-937.
[11] 贺金生,陈伟烈,王勋陵.高山栎叶的形态结构及其与生态环境的关系[J].植物生态学报,1994,18(3):219-227.
[12] 朱万泽,王三根,郝云庆.川滇高山栎灌丛萌生过程中营养元素供应动态[J].植物生态学报,2010,34(10):1185-1195.
[13] 王瑞丽,程瑞梅,肖文发,等.森林细根生产和周转的影响因素[J].世界林业研究,2012,25(1):19-24.
[14] 潘红丽,李迈和,蔡小虎,等.海拔梯度上的植物生长与生理生态特性[J].生态环境学报,2009,18(2):722-730.
[15] Li C Y,Zhang X J,Liu XL,et al.Leaf morphological and physiological responses of Quercus aquifolioides along an altitudinal gradient[J].Silva Fennica,2006,40(1):5-13.
[16] Li C Y,Wu C C,Duan BL.Age-related nutrient content and carbon isotope composition in the leaves and branches of Quercus aquifolioides along an altitudinal gradient[J].Trees,2009,23:1109-1101.
[17] Zhu W Z,Cao M,Wang S G,et al.Seasonal dynamics of mobile carbon supply in Quercus aquifolioides at the upper elevational limit[J].Plosone,2012,7(3):1-11.
[18] 吴栋栋,周永斌,于大炮,等.不同海拔长白山岳桦的生理变化 [J].生态学报,2009,29(5):2279-2285.
[19] Almeida A S,CavieresL A,BravoL A.Freezing resistance varies within the growing season and with elevation in high-Andean species of central Chile[J].New Phytologist,2009,182:461-469.
[20] 韩 发,岳向国,师生波.青藏高原几种高寒植物的抗寒生理特性[J].西北植物学报,2005,25(12):2502-2509.
[21] 陈晓莉.不同海拔青海云杉和祁连圆柏生理生态适应性研究[D].兰州:甘肃农业大学,2008.
[22] 冯建灿,张玉洁,杨天柱.低温胁迫对喜树幼苗SOD活性、MDA和脯氨酸含量的影响[J].林业科学研究,2002,15(2):197-202.
[23] 李 艳,薛 立,吴 敏.树木抗旱机理研究进展[J].生态学杂志,2007,26(11):1857-1866.
[24] 王红梅,包维楷,李芳兰.不同干旱胁迫强度下白刺花幼苗叶片的生理生化反应[J].应用与环境生物学报,2008,14(6):757-762.
[25] 王 齐,孙吉雄,安 渊.水分胁迫对结缕草种群特征和生理特性的影响[J].草业学报,2009,18(2):33-38.
[26] 王邦锡,黄久常,王 辉,等.不同植物在水分胁迫条件下脯氨酸的累积与抗旱性的关系[J].植物生理学报,1989,15(1):46-51.[27] 李洪山,张晓岚,侯新霞,等.梭梭适应干旱环境的多样性研究 [J].干旱区研究,1995,12(2):15-17.
[28] 任耀忠,张文辉,周建云.栓皮栎不同变异类型的优良性分析[J].中南林业科技大学学报,2013,33(6):60-63.
Malondialdehyde and proline contents in Quercus aquifolioides at different altitude gradients and their impact factors
ZHAO Guang1,2,ZHU Wan-ze1,XIE Jing1,2,WANG Yao-yao1,2
(1.Institute of Mountain Hazards and Environments,CAS,Chengdu 610041,Sichuan,China; 2.University of Chinese Academy of Sciences,Beijing 100049,China)
Quercus aquifolioides,an evergreen alpine and subalpine species,is endemic to northwestern Yunnan,western Sichuan and eastern Tibet in China.The malondialdehyde(MDA)and proline(Pro)contents in leaves,shoots,bark and fi ne roots of Q.aquifolioides shrubs were measured along an altitude gradient ranging from 3,000 to 3,950 meters on the eastern slope of Zheduo Mountain in western Sichuan.The results show that the contents of MDA and Pro in leaves were signi fi cant higher than those in other organ tissues; The MDA and Pro contents in above-ground tissues increased with increasing altitude,but the contents in fi ne roots had no signi fi cant difference among different elevations; except for MDA contents in fi ne roots,MDA content in other tissues and Pro contents in all tissues of Q.aquifolioides shrubs had positive correlations with atmospheric temperature and precipitation.The results suggest that in subalpine and alpine environments,Q.aquifolioides’ growth was limited by cold and drought stress.The contents of MDA and Pro in Q.aquifolioides were correlated with stress degrees.
Quercus aquifolioides; malondialdehyde; proline; impact factors; western Sichuan
S792.189;Q948
A
1673-923X(2015)07-0069-05
10.14067/j.cnki.1673-923x.2015.07.013
2014-10-10
国家“十二五”科技支撑计划专题(2011BAC09B04-02-04);国家自然科学基金项目(30872017);中国科学院知识创新工程重要方向项目(KZCX2-EW-309)
赵 广,硕士研究生
朱万泽,研究员;E-mail:wzzhu@imde.ac.cn
赵 广,朱万泽,谢 静,等.基于杨木纤维发酵产丁醇工艺条件的研究[J].中南林业科技大学学报,2015,35(7):69-73,104.
[本文编校:吴 毅]

