白桦BpGT14基因表达载体及RNA干扰载体的构建
李蕾蕾,孙丰坤,李晓一,詹亚光,b,曾凡锁,b
(东北林业大学 a.生命科学学院;b.林木遗传育种与生物技术国家重点实验室,黑龙江 哈尔滨 150040)
白桦BpGT14基因表达载体及RNA干扰载体的构建
李蕾蕾a,孙丰坤a,李晓一a,詹亚光a,b,曾凡锁a,b
(东北林业大学 a.生命科学学院;b.林木遗传育种与生物技术国家重点实验室,黑龙江 哈尔滨 150040)
糖基转移酶基因是生物分子糖基化中的关键基因,已有研究表明少数糖基转移酶14(Glycosyltransferase 14,GT14)家族基因在植物细胞壁合成及对逆境的响应中发挥重要的生物学功能,然而GT14基因对逆境的响应机制目前仍不清楚。为了研究糖基转移酶基因的生物学功能,本实验室在克隆了白桦BpGT14基因(JQ409354)编码区序列全长的基础上,利用BamHⅠ单酶切的方法构建了白桦BpGT14基因的pBI121植物表达载体,并利用一步PCR之后在同一体系中同时酶切-连接的方法,构建了BpGT14基因RNA干扰载体,相比于传统的RNA干扰载体构建方法更为高效快捷。测序结果表明,植物表达载体及RNA干扰载体均构建成功。本研究的完成,为BpGT14基因进一步的遗传转化及转基因植株的获得奠定了基础,同时为今后植物表达载体的构建提供了高效便捷的参考方法。
白桦;糖基转移酶;BpGT14基因;细胞壁;载体构建
近年来,有关植物细胞壁各组分的生物合成、细胞壁的构建模式、细胞壁与植物的生长发育等问题,特别是植物细胞壁的形成及其调控机理的研究成为人们关注的焦点[1]。糖基转移酶基因GT14是多糖合成中的关键基因,拟南芥和水稻突变体的相关研究已经表明少数糖基转移酶家族基因在植物细胞壁合成和对逆境的响应中发挥重要的生物学功能[2-5]。然而,由于表型明显的相关突变体有限,因此大部分糖基转移酶在细胞壁的生物合成和组装中的功能仍不清楚。
在双链RNA被发现之后[6],RNAi成为了一种十分有效的研究基因功能的方法[7-9]。通过RNA干扰机制,我们可以利用发卡RNA来诱导特定基因的降解,从而使基因沉默[10]。而在植物中,研究者们发现在发卡RNA中插入一段序列作为目的片段的内含子表现出了更高的基因沉默效率[11]。目前,RNA干扰技术被越来越广泛的应用于各种生物中。
酶切-连接方法是构建植物转基因载体的最普遍方法,被广泛应用于各种转基因植物表达载体的构建[12-15]。本研究利用pRNAi-GG(JQ085427)载体构建了RNA干扰载体[16](图1)。这种干扰载体构建方法只需一步酶切-连接反应,快捷简便,且成功率较高。pRNAi-GG载体在CaMV 35S启动子和Nos终止子之间,具有两个ccdB 致死基因和Pdk内含子(含氯霉素抗性基因)的盒式结构,因此具有双重选择的优点。为了构建RNAi载体,目的基因在扩增时需要加入BsaⅠ酶切位点及接头。在ccdB基因的两侧,均含有BsaⅠ酶切位点,在酶切-连接反应后,两个ccdB基因均会被目的基因所取代。只有内含子两端均连接目的片段的重组体才会在含有氯霉素抗性的培养基上生长。本实验采用的方法只需要一步PCR,而后将酶切-连接反应在同一体系内同时进行,便可完成RNAi载体的构建。
本研究成功构建了BpGT14基因上游322bp片段的RNAi载体,同时利用传统的单酶切、去磷酸化、连接的方法构建了BpGT14基因的植物表达载体。本研究载体的成功构建为进一步的遗传转化及BpGT14基因在细胞壁发育及逆境中功能的研究奠定了基础。

图1 pRNAi-GG干扰载体构建原理[16]Fig.1 Schematic diagram of interference vector construction with pRNAi-GG
1 材料与方法
1.1 研究材料
本研究采用的是野生型白桦(Betula platyphylla Suk)无菌培养植株。植物表达载体pBI121及干扰载体pRNAi-GG均由东北林业大学森林生物工程实验室保存。限制性内切酶、DNA聚合酶及T4DNA连接酶均购自TaKaRa公司。反转录酶试剂盒购自Thermo公司。DNA琼脂糖凝胶电泳回收试剂盒及质粒提取试剂盒均购自北京全式金生物技术公司。
1.2 实验方法
1.2.1 白桦总RNA的提取与cDNA的合成
取实验室无菌培养的野生型白桦植株,利用改良的CTAB法提取总RNA。按照Thermo公司反转录酶合成cDNA第一链。
1.2.2 白桦BpGT14基因pMD18-T载体的构建
利用本实验室已经克隆的白桦BpGT14基因的序列(JQ409354),通过Primer Premier 5软件设计特异性引物BpGT14-F及BpGT14-R(表1),PCR扩增白桦BpGT14基因,PCR程序设定为,94℃预变性3min;94℃变性45s,58℃退火45s,72℃延伸2min,共进行30个循环;最后72℃延伸7min。PCR产物经1.0%琼脂糖凝胶电泳检测,并进行回收,与pMD18-T载体进行连接,连接产物转化DH5α感受态细胞,进行蓝白斑筛选。挑取白色菌落,进行PCR鉴定,选择阳性克隆进行测序工作。将重组质粒载体命名为pMD18-GT。

表1 对应引物序列Table 1 The corresponding primer sequences
1.2.3 白桦BpGT14基因植物表达载体的构建
利用Primer Premier 5进行引物设计工作,同时将BamHⅠ酶切位点引入目的片段中,在引物两端加上酶切位点及保护碱基,命名为P171F及P171R(表1)。利用提取的pMD18-GT质粒为模版,扩增目的基因,PCR程序同上,并利用DNA纯化回收试剂盒进行纯化回收。利用限制性内切酶BamHⅠ将纯化后的目的片段与pBI121载体同时进行单酶切(pBI121载体在单酶切后进行去磷酸化反应,以防止载体自连),纯化回收后利用T4连接酶16℃过夜连接,产物转化至DH5α感受态细胞,在含有卡那抗生素的LB培养基上生长过夜。挑取白色菌斑进行PCR验证,验证成功的菌液送往北京华大基因进行测序工作,将测序结果与BpGT14基因序列及pBI121载体序列进行比对,选取正向插入片段载体作为阳性克隆。
1.2.4 白桦BpGT14基因干扰载体的构建
选取目的基因BpGT14上游一段长度为322 bp的片段构建干扰载体,根据选取的目的基因设计引物,加入保护碱基、接头以及酶切位点,引物命名为RNAi-F及RNAi-R(表1)。PCR扩增产物纯化后与载体进行酶切-连接反应,反应体系为,pRNAi-GG质粒5μL,目的片段3μL,T4连接酶缓冲液 1μL,T4DNA 连接酶 0.5μL,Bsa Ⅰ(NEB,10 U/μL)0.5μL,无菌去离子水补齐至10μL。反应条件为温育37℃,2h;之后失活反应80℃,5min。将连接产物转化至DH5α感受态细胞中,培养于含有卡那霉素和氯霉素的培养基上过夜。挑取阳性克隆,菌液PCR验证。验证时分别以P22、P23(表1)和RNAi-R两对引物同时进行PCR验证,其中,P22是以启动子一端序列设计的引物,P23是以终止子一端序列设计的引物(图2)。选取阳性克隆送往华大基因进行测序。

图2 干扰载体验证引物位置[16]Fig.2 The position of the primers on pRNAi-GG used for identi fi cation
2 结果与分析
2.1 白桦BpGT14基因pMD18-T载体的构建
利用琼脂糖凝胶电泳检测野生型白桦无菌培养植株总RNA,28S和18S条带清晰可见(图3)。以反转录获得的cDNA为模版,PCR扩增目的基因BpGT14,产物条带经电泳检测处于2 000 bp与1 000 bp之间(图4),与预期效果一致,初步认定扩增产物即为BpGT14目的基因。将菌液PCR验证的阳性克隆进行正反向测序,测序结果表明载体构建成功,插入片段编码区长度为1 302 bp。
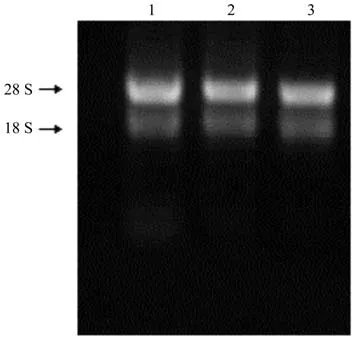
图3 白桦总RNA提取检测Fig.3 The detection of RNA extraction

图4 PCR扩增结果Fig.4 Result of PCR ampli fi cation
2.2 白桦BpGT14基因植物表达载体的构建
利用BamHⅠ对pBI121植物表达载体进行单酶切,反应体系经1%琼脂糖凝胶电泳检测(图5),结果表明载体已酶切完全。挑取过夜培养的白色单菌落,在含有抗生素的液体培养基中培养过夜,进行菌液PCR验证,结果表明存在阳性克隆(图6),但目的片段插入方向不确定。将待检测的阳性克隆进行正反向测序验证,将测序结果分别与BpGT14基因编码区序列及载体两端序列进行比对,发现存在阳性克隆为正向插入片段。由于植物表达载体的构建需要编码区序列定向插入表达载体中,因此我们明确正向插入片段为阳性克隆,结果表明BpGT14基因植物表达载体构建成功。

图5 BamHⅠ 酶切pBI121质粒电泳图像Fig.5 Identi fi cation result of BamHⅠsingle enzyme digestion of pBI121 vector

图6 BpGT14基因表达载体PCR鉴定结果Fig.6 PCR identi fi cation result of BpGT14 gene expression vector
2.3 白桦BpGT14基因干扰载体的构建
选取BpGT14基因上游一段长度为322 bp的片段进行PCR扩增及回收纯化,电泳条带约为300 bp(图7)。利用P22、P23及反向引物验证RNAi载体构建结果,理论条带差异约为200 bp,电泳结果与设计引物时预期结果一致(图8),初步认定RNAi载体构建成功。将样品利用P22及P23进行正反向测序验证,测序结果与载体上启动子、内含子和终止子序列进行分段比对,一致性较高,且插入片段为322 bp,无突变。综上所述,干扰载体构建成功。

图7 目的基因BpGT14上游片段PCR产物纯化回收检测Fig.7 Detection of DNA puri fi cation of BpGT14 gene upstream fragment

图8 PCR 鉴定结果Fig.8 PCR identi fi cation result
3 结论与讨论
目前,载体构建的策略逐步完善,力求以简单高效的方法完成目的基因与载体的重组。尽管传统载体构建中利用的酶切、连接方法步骤冗长,效率偏低[17],但因为其操作简便,成本低廉的特点依然被广泛使用[18-19]。本研究成功构建了白桦BpGT14基因的植物表达载体及干扰载体,基本策略均是利用酶切连接的方法。
植物表达载体的构建因需要编码区序列定向插入载体中,因此多采用双酶切的方法实现。但由于双酶切实验中,判断是否酶切完全需要至少设立两组对照,且对于两种酶的酶切温度及缓冲液均有要求,因此降低了实验的效率,且步骤较为繁琐。本研究采用了单酶切的方法,可有效避免双酶切反应中存在的问题。为了解决单酶切中载体自连的问题,在pBI121表达载体质粒酶切反应后,添加了一步去磷酸化反应,可以有效的解决载体自连的问题。对于阳性克隆的筛选,笔者采用了初步筛选后测序复选的策略,以筛选正向插入的目的片段。部分研究者利用单酶切的方法进行阳性克隆的筛选[20],选取插入片段及载体上均含有的酶切位点,利用单酶切的方法,获得两段长度不同的片段,同样可以达到筛选特定方向插入片段载体的目的。
通过RNA干扰技术研究基因功能的手段因为其高效、简便和特异性强的特点已被广泛使用。传统的“酶切-连接”方法仍然是构建RNA干扰载体最常见的方法,被广泛应用与各种生物之中,这种方法是通过PCR扩增含有酶切位点的目的片段,形成顺反结构,之后在顺反结构之间插入一段内含子以增强沉默效率[21-22]。原始的酶切连接方法无一例外的需要多轮酶切连接反应,所以实验周期较长,步骤冗杂,耗费时间,因此降低了实验的成功率。目前使用较多的是基于GATEWAY克隆体系的RNAi载体构建方法。GATEWAY技术是Invitrogen公司开发的一项基因克隆新技术,只需要BP和LR两个反应就可以完成RNA干扰表达载体的构建,并且不需要使用限制性内切酶和连接酶[23]。这种方法与传统的酶切-连接方法相比,具有简便、快捷、成功率高、对原始载体和目的片段的限制少等优势[24],克隆效率可达到95%[11]。但相比于众多RNAi载体构建的方法,Gateway技术的价格相对而言比较昂贵,并且同样需要BP和LR两步反应。本研究采用的RNAi载体构建方法耗时短,操作简便,只需一步PCR反应及一步酶切连接反应便可实现目的基因与质粒的重组,同时,ccdB致死基因和氯霉素抗性基因的双重筛选,可以大大降低假阳性的概率,提高成功率。本研究成功构建了白桦BpGT14基因植物表达载体及RNA干扰载体,经过测序分析证明载体构建成功,目前,正在进行遗传转化的研究,已获得转基因愈伤组织。本研究的载体构建策略,可广泛应用于植物表达载体及干扰载体的构建当中,对于植物表达载体及干扰载体的构建具有较高的参考价值,且通用性强。目前,该类方法以其步骤简便,效率可观等特点可被广泛运用于转基因植株的研究当中。本研究载体构建的成功,为白桦BpGT14转基因的功能研究奠定了基础。
[1] Doblin M S,Pettolino F,Bacic A.Evans Review:Plant cell walls:the skeleton of the plant world[J].Functional Plant Biology,2010,37(5):357-381.
[2] Lee C,Teng Q,Huang W,et al.The Arabidopsis family GT43 glycosyltransferases form two functionally nonredundant groups essential for the elongation of glucuronoxylan backbone[J].Plant physiology,2010,153(2):526-541.
[3] Zhong R,Peña M J,Zhou G K,et al.Arabidopsis fragile fi ber8,which encodes a putative glucuronyltransferase,is essential for normal secondary wall synthesis[J].The Plant Cell Online,2005,17(12):3390-3408.
[4] Vanzin G F,Madson M,Carpita N C,et al.The mur2 mutant of Arabidopsis thaliana lacks fucosylated xyloglucan because of a lesion in fucosyltransferase AtFUT1[J].Proceedings of the National Academy of Sciences,2002,99(5):3340-3345.
[5] Zhou Y,Li S,Qian Q,et al.BC10,a DUF266-containing and Golgi-located type II membrane protein,is required for cellwall biosynthesis in rice(Oryza sativaL.)[J].The Plant Journal,2009,57(3):446-462.
[6] Fire A,Xu S Q,Montgomery M K,et al.Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J].nature,1998,391(6669):806-811.
[7] Gunsalus K C,Piano F.RNAi as a tool to study cell biology:building the genome-phenome bridge[J].Current opinion in cell biology,2005,17(1):3-8.
[8] Kusaba M.RNA interference in crop plants[J].Current Opinion in Biotechnology,2004,15(2):139-143.
[9] Perrimon N,Ni J Q,PerkinsL.In vivo RNAi:today and tomorrow[J].Cold Spring Harbor perspectives in biology,2010,2(8):36-40.
[10] Waterhouse P M,Helliwell C A.Exploring plant genomes by RNA-induced gene silencing[J].Nature Reviews Genetics,2003,4(1):29-38.
[11] Wesley S V,Helliwell C A,Smith N A,et al.Construct design for efficient,effective and high-throughput gene silencing in plants[J].The Plant Journal,2001,27(6):581-590.
[12] 柴晓杰,王丕武,关淑艳,等.玉米淀粉分支酶基因反义表达载体的构建和功能分析[J].作物学报,2006,31(12):1654-1656.
[13] 邢珍娟,王振营,何康来,等.转 Bt 基因玉米幼苗残体中Cry1Ab 杀虫蛋白田间降解动态[J].中国农业科学,2008,41(2):412-416.
[14] 王 镭,才 华,柏 锡,等 .转 OsCDPK7 基因水稻的培育与耐盐性分析 [J].遗传,2008,30(8):1051-1055.
[15] 吕 品,柴晓杰,王丕武,等.大豆胰蛋白酶抑制剂 KSTI3 基因的克隆及其植物表达载体的构建[J].吉林农业大学学报,2007,29(3):275-278.
[16] Yan P,Shen W,Gao X Z,et al.High-throughput construction of intron-containing hairpin RNA vectors for RNAi in plants[J].PloS one,2012,7(5):e38186.
[17] 马 建,魏益凡,厉 志,等.植物 RNA 干扰表达载体构建方法的研究[J].安徽农业科学,2009,(18):8364-8366.
[18] 张 莉,苏曼琳.植物抗旱基因 HDCS1 的克隆和表达载体的构建[J].中南林业科技大学学报,2012,32(6):115-117.
[19] 黄 婷,徐刚标.毛果杨WND1B 基因启动子的克隆与缺失初步分析[J].中南林业科技大学学报,2012,32(4):164-169.
[20] 马 腾,刘学政,刘丽波,等.人血管生成素 1 的克隆,序列分析和单酶切法构建毕氏酵母表达载体[J].中国组织工程研究与临床康复,2007,11(6):1041-1044.
[21] Kong Z,Li M,Yang W,et al.A novel nuclear-localized CCCH-type zinc finger protein,OsDOS,is involved in delaying leaf senescence in rice[J].Plant physiology,2006,141(4):1376-1388.
[22] Miki D,Itoh R,Shimamoto K.RNA silencing of single and multiple members in a gene family of rice[J].Plant Physiology,2005,138(4):1903-1913.
[23] 粟 挺,刘爱玲,陈信波.RNA 干扰载体构建方法的研究进展 [J].湖南农业科学,2011,(10):1-4.
[24] 马 建,魏益凡,厉 志,等 .植物 RNA 干扰表达载体构建方法的研究[J].安徽农业科学,2009,(18):8364-8366.
Construction of BpGT14 gene expression vector and RNA interference vector in Betula platyphylla
LI Lei-leia,SUN Feng-kuna,LI Xiao-yia,ZHAN Ya-guanga,b,ZENG Fan-suoa,b
(a.College of Life Sciences; b.Key Laboratory of Forest Tree Genetic Improvement and Biotechnology of Nation,Northeast Forestry University,Harbin 150040,Heilongjiang,China)
Glycosyltransferase gene is the key gene in the biomolecules glycosylation.Some studies have shown that a minority glycosyltransferase 14(GT14)gene family play an important biological function in the synthesis of plant cell wall and response to adversity,but the stress response mechanism of GT14 gene remains unclear.In order to study the biological function of glycosyltransferase gene,based on full-length of cloned BpGT14 gene(JQ409354)by our laboratory,we have constructed the plant expression vector pBI121 through single digestion and connection and RNA interference vector through a newly one-step PCR method instead of the original one.Sequencing results showed the success of plant expression vector and RNAi vector.The success of this experiment laid a foundation further for the step of genetic transformation and transgenosis and provides an ef fi cient and convenient method of the plant expression vectors constructed for future reference.
Betula platypylla,Glycosyltransferase,BpGT14 gene,cell wall,expression vector construction
S792.153
A
1673-923X(2015)07-0017-05
10.14067/j.cnki.1673-923x.2015.07.004
2014-10-10
国家自然科学基金项目(J1210053;31200463);黑龙江省博士后启动基金项目(LBH-Q12166)
李蕾蕾,硕士研究生
曾凡锁,副教授,博士;E-mail:zengfansuo@126.com
李蕾蕾,孙丰坤,李晓一,等.白桦BpGT14基因表达载体及RNA干扰载体的构建[J].中南林业科技大学学报,2015,35(7):17-21.
[本文编校:吴 毅]

