肠道小肽吸收利用机制及其营养功能
贺光祖 谭碧娥 肖 昊 印遇龙 方 俊
(1.湖南农业大学生物科学技术学院,长沙 410128;2.中国科学院亚热带农业生态研究所,中国科学院亚热带农业生态过程重点实验室,湖南省畜禽健康养殖工程技术中心,农业部中南动物营养与饲料科学观测实验站,长沙 410125)
随着蛋白质和氨基酸营养研究的深入,人们已逐渐认识到肽营养的重要性。蛋白质在动物肠道内必须被降解为游离氨基酸(free amino aicds,FAA)或小肽才能被肠道所吸收,小肽的吸收在总饲粮蛋白质的吸收中有重要作用[1],其吸收利用不仅在氨基酸消化、吸收和代谢中起到至关重要的作用,在维持动物的肠道健康、机体免疫功能方面都具有重要意义。本文旨在概述小肽吸收利用机制及其生物学功能,为其在动物营养中的更广泛应用提供参考。
1 肠道小肽吸收利用机制
1.1 肽转运载体小肽转运蛋白1(peptide transporter 1,Pep T1)特性和调控
肠道PepT1属于溶质载体家族(solute carrier family 15,SLC15),不同种类动物小肠中PepT1的mRNA长度和所编码蛋白质的氨基酸组成数目不同,其中猪的2条PepT1 mRNA长度分别为2.9和3.5 kb,所编码的蛋白质由708个氨基酸组成,预测有12个跨膜区域。PepT1所需的最佳pH在6.0 ~6.5[2]。
PepT1主要在消化道中表达,在不同种属动物肠道中PepT1的分布并不一致,但基本上在小肠各部位都能检测到PepT1的表达,而在结肠中正常情况都没有表达[3]。这表明猪肠道对小肽的吸收转运主要发生于十二指肠、空肠和回肠。不同品种猪肠道表达也存在差异[2,4-6]。Chen 等[4]用核酸免疫印迹(Northern blot)的方法,发现杂交猪中仅在小肠中检测到PepT1 mRNA,其中空肠表达丰度最高,其次为十二指肠,回肠最低,结肠不表达。邹仕庚等[5]发现,长白猪十二指肠 PepT1 mRNA的表达丰度显著高于空肠和回肠,结肠无PepT1 mRNA的表达。Wang等[6]发现,藏猪空肠后段PepT1 mRNA表达丰度最高,显著高于十二指肠、空肠前段和回肠。不同猪种肠道PepT1 mRNA的表达在断奶前具有不同的发育模式,而在断奶后则具有相似的发育性变化;同一猪种不同肠段PepT1 mRNA的表达模式不同,但空肠和回肠在断奶后具有相似的发育性变化,都表现为在生长期(60~90 d)有表达的峰值[5]。肠道PepT1的表达量随着肠上皮细胞的成熟而增加,沿着小肠隐窝-绒毛轴,PepT1在小肠高度分化的细胞(绒毛顶端)中表达的最丰富,但在未分化细胞(隐窝)中表达量减少。不过,PepT1在刷状缘膜的限制表达可受发育调控,18日龄和刚出生胎儿十二指肠中PepT1蛋白表达发展到近顶端细胞质、基底细胞质和基底膜以及顶膜,在断奶和成年时,PepT1蛋白只表达在刷状缘膜[7]。
PepT1有一个广泛的底物谱[3],能转运大约400种二肽和8 000种三肽以及很多肽类化合物。像其他营养载体一样,PepT1能被其底物上调[8],其调节作用是通过增加细胞膜上肽转运蛋白的丰度来实现的[1]。饲粮蛋白质水平是调控PepT1活性的重要因素,其调控机制为直接依赖底物[1]。一般来说,PepT1的表达和活性与饲粮蛋白质以及小肽的水平成正比。高质量的蛋白质饲粮进入消化道被迅速地降解,肠腔中二肽、三肽和FAA浓度增加,成为激活PepT1基因转录的信号,刷状缘膜上的PepT1表达增加,小肽的转运效率提高[9]。PepT1还受激素、昼夜节律和生物体的发育阶段等的调控[10-12],已证实许多内生和外生因子(激素、生长因子、5-氟尿嘧啶、环孢霉素)能调控PepT1表达。研究发现,重组人生长激素(recombinant human growth hormone,rhGH)在基因水平上对PepT1有调控作用,rhGH不但促进了正常细胞二肽载体的转运功能,对缺氧复氧损伤后细胞的二肽载体的转运和摄取功能同样具有明显的上调作用[13]。夜间小鼠体内PepT1的活性会显著提高,但当小鼠处于空腹或打乱白天按时饲喂的模式后,其体内的PepT1迅速改变,以适应肠道对营养的需求[14]。在 PepT1的结构中存在蛋白激酶 C(protein kinase C,PKC)和蛋白激酶A(protein kinase A,PKA)的结合位点,因此,PKA和PKC的抑制剂或激动剂均能调控PepT1的转运活性。Chen等[11]发现植物乳杆菌能提高PepT1表达,从而提高其介导的氨基酸的吸收,可能就是通过改变PKC的活性实现。PepT1在小肠中的特异性表达受肠上皮细胞增殖、分化和成熟相关的转录因子尾型同源盒转录因子2(caudal-type homeobox transcription factor 2,CDX2)的调节[15],而这种调节在PepT1与转录因子特异性蛋白1(specificity protein 1,Sp1)的相互作用时发生,Sp1具有PepT1启动子的识别位点,可以控制PepT1的活性[12]。此外,有研究证明肠上皮细胞PepT1在转录后水平的表达是通过微小RNA(miRNAs)调节[7]。
1.2 小肽转运途径
蛋白质在体内主要是以小肽形式被吸收,小肽与FAA的转运是2个完全相互独立的系统[16]。小肽的转运发生在细胞膜上[10],在PepT1被克隆和鉴定之前,就确认在肠上皮细胞刷状缘膜存在载体介导的肽转运机制。通过PepT1与氢离子(H+)协同转运是二肽和三肽吸收的主要途径。小肽分子和H+经PepT1协同转运到细胞内,H+再经细胞顶膜侧的钠离子(Na+)/H+转运至细胞外,将Na+置换到细胞内,维持细胞膜的质子驱动力;而基底膜的Na+/钾离子(K+)-ATP酶(ATPase)通过Na+/K+交换,把细胞内的Na+泵出,以维持细胞内外 Na+浓度梯度(图1)[1]。PepT1在肠上皮细胞顶膜上表达,绒毛顶部存在酸性微环境,可以强化H+的内流作用。除了通过PepT1转运,细胞穿透肽(cell-penetrating peptides,CPP)可以携带小肽进入细胞(图1)[1],CPP能穿过细胞膜发生转位,同时携带寡肽、肽核酸、质粒、蛋白质和脂质体等进入细胞内。CPP如何在质膜上转位的机制还不清楚,这可能通过直接穿透或不同类型的内吞作用并释放内涵体,转位可由CPP的阳离子基团与质膜上的负电荷结合而启动。CPP可以作为一种新型的转运载体,运输不能透过细胞质膜的基团。细胞间紧密连接通透性的增加也可使小肽通过细胞旁路进入细胞(图1)[1]。肽或肽类似物经细胞旁路的吸收可能受饲粮中生物活性成分的影响。Komori等[17]发现,辣椒素抑制了大鼠空肠和回肠头孢氨苄的吸收,主要是因为降低了PepT1介导的跨膜转运;但是,辣椒素促进了头孢氨苄经细胞旁路的通透。这说明肽的跨膜转运与细胞旁路通透可以独立受到调控。
1.3 小肽的代谢
蛋白质消化产物主要以二肽和三肽的形式通过肠细胞顶膜上的PepT1被吸收进入肠上皮细胞[18],将完全或部分被肠细胞中的二肽酶和三肽酶水解,以小肽或FAA的形式进入血液循环。但是,在消化过程中二肽和三肽被释放到什么程度以及以何种数量和比例吸收进入循环目前尚不完全清楚。正常生理情况下,绝大多数进入小肠的小肽离开浆膜前,已被迅速水解为FAA。肠黏膜上皮细胞胞质内和胞膜上均有二肽酶,胞质内二肽酶活性高于胞膜上。尽管在刷状缘膜二肽酶的活性有限,二肽和三肽正常的细胞腔水解发生的非常迅速。在体外培养的肠上皮细胞也会迅速将胞浆内的肽酶释放到培养液中[7],从而迅速降解培养液中的小肽。而在某些生理和药理试验发现某些完整的小肽能进行血液循环。进入血液循环的小肽量因肽的氨基酸组成、构型及肽腱抗肽酶水解能力不同而异[19]。在水解过程中释放的某些自由氨基酸可能作为二肽酶的抑制剂,因此大量的二肽和三肽可能绕开酶解到达肽转运载体[18]。代建国等[20]研究发现,甘氨酰亮氨酸(Gly-Leu)和组氨酰亮氨酸(His-Leu)在断奶仔猪小肠刷状缘膜囊(brush border membrane vesicles,BBMV)体系中不水解,推断可能因为Gly-Leu和His-Leu具有抗水解性或者此体系中不含有水解这2种二肽的肽酶。

图1 肠上皮细胞肽吸收的途径Fig.1 Potential routes of peptide uptake in enterocytes[1]
2 肠道小肽感应与胃肠激素分泌和摄食调控
近年来,胃肠道作为味觉感应器官的研究越来越多,胃肠道识别到营养物质或非营养物质后,启动调控消化、吸收、采食和代谢的级联过程。与其他营养物质感应机制类似,肠道消化产生的肽类经PepT1跨膜运输引起细胞体积和细胞膜电势的变化,从而启动信号传导;PepT1可直接充当肽类的感应器或激活细胞膜或与细胞内受体结合,引起细胞信号传导系统的级联反应,最终导致大量蛋白质表达和活性的改变[21]。通过肽酶的抑制、雷帕霉素靶标(target of rapamycin,TOR)组件的RNA干扰(RNAi)沉默证实了细胞内肽类水解是感应系统的一部分,PepT1可协调短肽的吸收、细胞内氨基酸库和TOR信号,PepT1功能可能直接影响 TOR 通路[10]。
胃肠道小肽感应途径主要是:肽转运载体作为生电转运感受体,诱导膜去极化和激素分泌;表达和激活G蛋白偶联受体(guanosine-binding protein coupled receptor,GPCR)促进胃肠激素的释放[8,22-24]。H+驱动的 PepT1 和 PepT2(SLC15A1和SLC15A2)是产生电的,电化学梯度下降使膜去极化,引起钙离子(Ca2+)通过电压门控Ca2+通道(voltage-gated calcium channel,Ca2+V)流入[24]。已发现很多 GPCR能感应小肽[23],如鲜味受体T1R1/R3(T1R1/R3 umami taste receptor)。肠上皮细胞顶膜同时表达有PepT1和鲜味受体T1R1/R3,因此,可以整合信号,刺激相邻的肠内分泌细胞内的可能靶点[23]。Grigorov 等[25]报道了 10 种二肽,可通过α-味导素(α-gustducin,Gg)激活磷脂酶 Cβ2(phospholipase C beta 2,PLCβ2),胞内储存的Ca2+被释放出来,进而激活瞬时受体电位M亚型5(transient receptor potential cation channel subfamily M member,TRPM5)通道,Na+流入细胞内,最终导致膜去极化和神经递质释放[24]。肠上皮细胞顶膜GPCR93被证实能被蛋白质水解物激活,而Fourchaud[23]发现PepT1的一种底物头孢克洛并不能激活GPCR93。
肠上皮细胞中PepT1的感应途径传导信号到肠内分泌细胞,能诱导多种激素分泌[26]。尤其胰高血糖素样肽 -1(glucagon-likepeptide1,GLP-1)是提高葡萄糖依赖的胰岛素分泌、维持β细胞功能的关键。Matsumura等[26]研究发现二肽甘氨酰甘氨酸(Gly-Gly)能引起转染PepT1的肠内分泌细胞STC-1细胞膜去极化,细胞内Ca2+浓度显著升高,刺激生长激素呈pH依赖性分泌,而阻断Ca2+通道后,激素分泌也被抑制,说明PepT1通过L型电压依赖性Ca2+离子通道(L-type voltage-dependent Ca2+channel,L-VDCCs),导致胞外 Ca2+内流,从而介导寡肽诱导的激素分泌。Fourchaud[23]利用野生型和 PepT1缺失型小鼠研究发现,PepT1选择性地介导二肽和三肽混合物刺激GLP-1的分泌,在野生型小鼠中PepT1的底物Gly-Gly、甘氨酰肌氨酸(Gly-Sar)和头孢菌素等都能诱导GLP-1的分泌,而且同样也依赖于Ca2+的内流。此外,鲜味受体T1R1/R3也介导GLP-1分泌的信号通路。鲜味肽谷氨酰谷氨酸(Glu-Glu)和赖氨酰甘氨酸(Lys-Gly)分别在pH为6.0和7.4时,能诱导GLP-1的分泌,这种鲜味肽诱导GLP-1分泌的pH依赖性与底物装载和PepT1构型的pH依赖性变化一致。因此,选择性鲜味肽诱导GLP-1分泌存在2条信号通路,分别是PepT1介导肽转运和鲜味受体T1R1/R3对肽或氨基酸的感应。同时,在野生型和PepT1缺失型小鼠中发现,PepT1并不参与胆囊收缩素(cholecystokinin,CCK)的分泌[23]。但很多研究已证实PepT1的底物能刺激内分泌细胞 STC-1中 CCK的分泌[8],STC-1细胞中并不表达PepT1,因此还可能存在其他感应系统引起CCK的释放。
通过饲粮营养物质促进胃肠激素分泌被认为是一种体重控制中诱导饱感和摄食代谢控制的有效方法,小肽刺激分泌的胃肠激素可以激活迷走神经和相应的靶细胞(如激活胰腺的β细胞释放胰岛素)或随血液循环作用于大脑中枢,从而调控摄食。PepT1选择性的调节二肽和三肽进入肠细胞的吸收,被认为在营养感知过程和饱感调控中发挥作用[23]。在营养不良、短期绝食或者长期饥饿的情况下,PepT1 被诱导表达[27]。Darcel等[28]在小鼠的研究中表明,PepT1可能介导蛋白吸收刺激迷走神经传入、引起饱腹感信号。Nässl等[29]发现PepT1缺失小鼠采食高蛋白质水平饲粮与野生型小鼠相比,采食量显著降低。
3 小肽吸收利用与肠道健康
大量研究表明,小肽对肠道健康和功能发挥具有保护作用,主要表现在改善蛋白质代谢,促进蛋白质合成和肠上皮细胞增殖,促进有益菌群繁殖,提高肠黏膜免疫功能和抗氧化能力,从而促进肠道发育、维持肠道结构和功能[30-33]。在手术后或烧伤烫伤中常用谷氨酰胺二肽强化的肠外营养来改善负氮平衡,促进机体蛋白质的合成[32]。在早期断奶仔猪饲粮中添加甘氨酰谷氨酰胺(Gly-Gln),可减轻由脂多糖激发的生长和免疫功能的抑制[31],丙氨酰谷氨酰胺(Ala-Gln)可以改善应激状态下肠道免疫功能,减少细菌易位[33]。小肽可有效降低自由基氧化速率和减少脂质过氧化物含量,从而发挥其抗氧化作用[30]。Ala-Gln改善小肠绒毛形态结构和维护肠黏膜屏障功能的机制还可能是提供了小肠吸收利用的谷氨酰胺,提供了氧化利用的燃料和氮源,合成嘧啶和嘌呤等,促进肠上皮细胞的分裂复制[34]。
PepT1已被证实介导肠道炎症[35],肠道人小肽转运蛋白1(human peptide transporter 1,hPepT1)在正常结肠上皮细胞不表达,只在炎症时表达[27],通过转运细菌促炎多肽进入肠上皮细胞直接诱导肠道炎症。PepT1有转运细菌多肽的能力,如甲酰甲硫氨酰-亮氨酰-苯丙氨酸(N-formyl-methionylleucyl-phenylalanine,fMLP)和胞壁酰二肽(muramyl dipeptide,MDP)。研究表明PepT1是肠道细菌产生的一种趋化性肽fMLP的主要转运者,能影响炎症的诱导[35]。细菌产物fMLP通常出现在肠腔中,肠道hPepT1介导fMLP转运进入细胞溶质;这些小细菌肽类进入细胞溶质后通过核因子活化B细胞κ轻链增强子(nuclear factor kappa-light-chain-enhancer of activated B cells,NFκB)的激活,引起主要组织相容性复合体(major histocompatibility complex,MHC)的激活和细胞因子的分泌[35]。此外,fMLP通过基底外侧膜流出已被证实,f MLP和其他小甲酰肽可能被固有膜上的巨噬细胞吸收,这些小甲酰肽可能通过巨噬细胞内受体参与免疫反应的激活,如核苷酸结合位点区-亮氨酸重复序列(nucleotide binding siteleucine-rich repeats,NBS-LRR)蛋白就参与细胞内细菌及其产物的识别(图 2)[35]。研究表明miR-92b能有效地抑制促炎细菌多肽引起的肠道炎症,这主要是通过作为hPepT1表达的重要阻遏物,因此,用miR-92b来调节hPepT1表达对治疗肠道炎症有很好的疗效[7]。PepT1既是营养载体也是药物载体[11],能够快速有效地进行肠道药物吸收,甚至是在黏膜功能损伤的状态下[18]。Dalmasso等[36]研究表明,PepT1介导三肽赖氨酰脯氨酰缬氨酸(Lys-Pro-Val,KPV)转运,抑制 NFκB 的激活,减弱Caco2-BBE细胞系和白血病细胞中促炎细胞因子的产生。
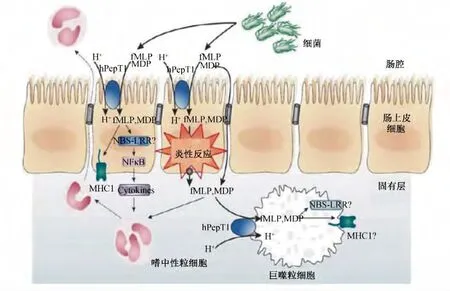
图2 Pep T1在肠道炎症中可能的作用机制Fig.2 Possible mechanisms of the involvement of PepT1 in intestinal inflammation[35]
4 小肽在动物营养中的应用
为了改善肠道吸收功能,小肽已被考虑作为氨基酸来源,目前小肽在动物营养应用研究中最多且有好的效应的是含谷氨酰胺的二肽Ala-Gln和Gly-Gln以及三肽精氨酰甘氨酰谷氨酰胺(Arg-Gly-Gln)。谷氨酰胺是哺乳动物血浆和母猪乳汁中一种含量非常丰富的FAA,是快速分裂增殖细胞如肠上皮细胞和淋巴细胞的主要能量来源,在促进肠道损伤修复以及维持正常功能中发挥重要的作用。但是,谷氨酰胺溶解度低,仅为35 g/L,而且遇热不稳定,对酸性环境敏感,易降解成有害的焦谷氨酸和氨,在饲粮中直接添加会影响其吸收利用,导致谷氨酰胺在动物实际生产中应用非常困难。而含谷氨酰胺的小肽被吸收到动物机体后迅速释放出谷氨酰胺,提高血浆谷氨酰胺浓度,从而发挥谷氨酰胺作用。含谷氨酰胺的小肽不仅吸收转运速度快、稳定性好,已在仔猪、肉鸡和鱼类等动物中证实对促进肠道健康、缓解应激、提高生长性能等方面发挥重要作用,其中在仔猪中应用最广泛[33-34,37-38]。
断奶仔猪饲粮中添加Ala-Gln能促进体内蛋白质合成,提高血清抗氧化能力,促进仔猪生长[31]。邓宸玺[34]研究发现,Ala-Gln 可显著降低仔猪断奶应激造成的腹泻,提高仔猪小肠 Na+/K+-ATP酶、二糖酶活性,促进空肠黏膜钠-葡萄糖共转运载体(sodium/glucose cotransporter 1,SGLT1)mRNA的表达,从而增强断奶仔猪对碳水化合物的消化吸收功能。饲粮中添加0.3%的Gly-Gln可显著提高断奶仔猪体重,降低腹泻率,尤其对14日龄的仔猪效果最为明显[37]。Gly-Gln二肽通过提高机体免疫功能和抗氧化能力,抑制蛋白质分解,促进肠道黏膜修复,降低血液皮质醇浓度,从而降低机体的应激反应,有利于仔猪生长发育[31]。Arg-Gly-Gln能够提高空肠组织谷氨酰胺酶活性,从而增强断奶仔猪肠上皮细胞对谷氨酰胺的利用,促进空肠细胞增殖,抑制Caspase-3介导的细胞凋亡,提高二胺氧化酶(diamine oxidas,DAO)的活性,缓解黏膜细胞损伤并降低细胞膜通透性,从而提高肠道黏膜的屏障功能。
5 小结
小肽的吸收利用机制及营养功能的研究取得了很大进展。小肽主要在肠道经PepT1吸收,经PepT1跨膜运输,可引起细胞信号传导系统作用,诱导多种激素分泌,调控摄食;同时,小肽对维持肠道健康和功能具有重要作用。由于小肽比FAA在吸收利用上的优势,在动物营养中的应用已有大量研究。但是,由于缺乏大多数小分子肽检测与定量方法,消化过程中小肽释放程度以及吸收的小肽数量和比例尚不完全清楚,肠道对小肽吸收利用机制有待进一步深入研究。
[1] GILBERT E R,WONG E A,WEBB K E,Jr.Boardinvited review:peptide absorption and utilization:implications for animal nutrition and health[J].Journal of Animal Science,2008,86(9):2135-2155.
[2] KLANG J E,BURNWORTH L A,PAN Y X,et al.Functional characterization of a cloned pig intestinal peptide transporter(pPepT1)[J].Journal of Animal Science,2005,83(1):172-181.
[3] DANIEL H,KOTTRA G.The proton oligopeptide cotransporter family SLC15 in physiology and pharmacology[J].Pflügers Archiv,2004,447(5):610-618.
[4] CHEN H,WONG E A,WEBB K E.Tissue distribution of a peptide transporter mRNA in sheep,dairy cows,pigs,and chickens[J].Journal of Animal Science,1999,77(5):1277-1283.
[5] 邹仕庚,冯定远,黄志毅,等.猪肠道寡肽转运载体1(PepT1)mRNA表达的肠段特异性和发育性变化[J].农业生物技术学报,2009,17(2):229-236.
[6] WANG W,SHIC Y,ZHANG JS,et al.Molecular cloning,distribution and ontogenetic expression of the oligopeptide transporter PepT1 mRNA in Tibetan suckling piglets[J].Amino Acids,2009,37(4):593-601.
[7] DALMASSO G,NGUYEN H T T,YAN Y T,et al.MicroRNA-92b regulates expression of the oligopeptide transporter PepT1 in intestinal epithelial cells[J].A-merican Journal of Physiology:Gastrointestinal and Liver Physiology,2011,300(1):G52-G59.
[8] RAYBOULD H E.Nutrient sensing in the gastrointestinal tract:possible role for nutrient transporters[J].Journal of Physiology and Biochemistry,2008,64(4):349-356.
[9] BAKKE S,JORDAL A E O,GÓMEZ-REQUENI P,et al.Dietary protein hydrolysates and free amino acids affect the spatial expression of peptide transporter PepT1 in the digestive tract of Atlantic cod(Gadus morhua)[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2010,156(1):48-55.
[10] BENNER J,DANIEL H,SPANIER B.A glutathione peroxidase,intracellular peptidases and the TOR complexes regulate peptide transporter PEPT-1 in C.elegans[J].PLoSOne,2011,6(9):e25624.
[11] CHEN H Q,SHEN T Y,ZHOU Y K,et al.Lactobacillus plantarum consumption increases PepT1-mediated amino acid absorption by enhancing protein kinase C activity in spontaneously colitic mice[J].The Journal of Nutrition,2010,140(12):2201-2206.
[12] SHIMAKURA J,TERADA T,KATSURA T,et al.Characterization of the human peptide transporter PEPT1 promoter:sp1 functions as a basal transcriptional regulator of human PEPT1[J].American Journal of Physiology:Gastrointestinal and Liver Physiology,2005,289(3):G471-G477.
[13] 孙炳伟,赵小辰,王广基,等.缺氧复氧损伤后小肠上皮细胞刷状缘二肽转运载体生物学功能的改变及生长激素的调控作用[J].解放军医学杂志,2003,28(11):1025-1027.
[14] PAN X Y,TERADA T,OKUDA M,et al.The diurnal rhythm of the intestinal transporters SGLT1 and PEPT1 is regulated by the feeding conditions in rats[J].The Journal of Nutrition,2004,134(9):2211-2215.
[15] SHIMAKURA J,TERADA T,SHIMADA Y,et al.The transcription factor Cdx2 regulates the intestine-specific expression of human peptide transporter 1 through functional interaction with Sp1[J].Biochemical Pharmacology,2006,71(11):1581-1588.
[16] 代建国,李德发,朴香淑,等.二肽在仔猪小肠刷状缘膜囊中跨膜转运的动力学特点研究[J].畜牧兽医学报,2007,38(5):471-475.
[17] KOMORI Y,AIBA T,SUGIYAMA R,et al.Effects of capsaicin on intestinal cephalexin absorption in rats[J].Biological and Pharmaceutical Bulletin,2007,30(3):547-551.
[18] DANIEL H.Molecular and integrative physiology of intestinal peptide transport[J].Annual Review of Physiology,2004,66:361-384.
[19] VERMEIRSSEN V,DEPLANCKE B,TAPPENDEN K A,et al.Intestinal transport of the lactokinin Ala-Leu-Pro-Met-His-Ile-Arg through a Caco-2 Bbe monolayer[J].Journal of Peptide Science,2002,8(3):95-100.
[20] 代建国,李德发,朴香淑,等.二肽在断奶仔猪小肠刷状缘膜囊中水解状况的研究[J].畜牧兽医学报,2005,36(2):133-136.
[21] RUSSELL H,PETER M T,HARINDER S H.Amino acid transporters:roles in amino acid sensing and signalling in animal cells[J].Biochemical Journal,2003,373:1-18.
[22] CHOI S,LEE M,SHIU A L,et al.Identification of a protein hydrolysate responsive G protein-coupled receptor in enterocytes[J].American Journal of Physiology-Gastrointestinal and Liver Physiology,2006,292(1):G98-G112.
[23] FOURCHAUD L.Characterization of protein and peptide sensing processes in the gut coupled to gastrointestinal hormone secretion using ex-vivo models[D].Ph.D.Thesis.Technische Universität MÜnchen,2011.
[24] TOLHURST G,REIMANN F,GRIBBLE F M.Intestinal sensing of nutrients[M]//JOOST H G.Appetite control,handbook of experimental pharmacology.Berlin:Springer,2012,209:309-335.
[25] GRIGOROV M G,SCHLICHTHERLE-CERNY H,AFFOLTER M,et al.Design of virtual libraries of umamitasting molecules[J].Journal of Chemical Information and Modeling,2003,43(4):1248-1258.
[26] MATSUMURA K,MIKI T,JHOMORI T,et al.Possible role of PEPT1 in gastrointestinal hormone secretion[J].Biochemical and Biophysical Research Communications,2005,336(4):1028-1032.
[27] INGERSOLL S A,AYYADURAI S,CHARANIA M A,et al.The role and pathophysiological relevance of membrane transporter PepT1 in intestinal inflammation and inflammatory bowel disease[J].American Journal of Physiology:Gastrointestinal and Liver Physiology,2012,302(5):G484-G492.
[28] DARCEL N P,LIOU A P,TOMÉ D,et al.Activation of vagal afferents in the rat duodenum by protein digests requires PepT1[J].The Journal of Nutrition,2005,135(6):1491-1495.
[29] NÄSSL A M,RUBIO-ALIAGA I,SAILER M,et al.The intestinal peptide transporter PEPT1 is involved in food intake regulation in mice fed a high-protein diet[J].PLoS ONE,2011,6(10):e26407.
[30] ESTÍVARIZ C F,GRIFFITH D P,LUO M H,et al.Efficacy of parenteral nutrition supplemented with glutamine dipeptide to decrease hospital infections in critically ill surgical patients[J].Journal of Parenteral &Enteral Nutrition,2008,32(4):389-402.
[31] JIANG Z Y,SUN L H,LIN Y C,et al.Effects of dietary glycyl-glutamine on growth performance,small intestinal integrity,and immune responses of weaning piglets challenged with lipopolysaccharide[J].Journal of Animal Science,2009,87(12):4050-4056.
[32] ZHENG Y M,LI F,ZHANG M M,et al.Glutamine dipeptide for parenteral nutrition in abdominal surgery:a meta-analysis of randomized controlled trials[J].World Journal of Gastroenterology,2006,12(46):7537-7541.
[33] 周荣艳.谷氨酰胺及丙氨酰谷氨酰胺对早期断奶仔猪肠上皮细胞增殖和肠道免疫的影响[D].硕士学位论文.武汉:华中农业大学,2004.
[34] 邓宸玺.Ala-Gln对断奶仔猪小肠黏膜屏障功能和吸收功能的调控作用[D].硕士学位论文.南昌:江西农业大学,2013.
[35] CHARRIER L,DRISSA,YAN Y T,et al.hPepT1 mediates bacterial tripeptide fMLPuptake in human monocytes[J].Laboratory Investigation,2006,86(5):490-503.
[36] DALMASSO G, CHARRIER-HISAMUDDIN L,NGUYEN H T,et al.PepT1-mediated tripeptide KPV uptake reduces intestinal inflammation[J].Gastroenter-ology,2008,134(1):166-178.
[37] 杨彩梅,徐卫丹,陈安国.甘氨酰-L-谷氨酰胺对断奶仔猪生长性能及肠道吸收功能的影响[J].中国畜牧杂志,2005,41(8):6-8.
[38] SHU G,GAO P,ZHU X T,et al.Effects of glycyl-glutamine on the growth performance and lipid deposition in Yue-Huang broilers[J].Journal of Animal and Feed Sciences,2007,16:232-240.

