饲粮添加精氨酸对娩后Wistar大鼠乳腺组织发育及酪蛋白合成的影响
胡良宇 吴佳诚 王梦芝 李鹏飞 冯 丹 张 军
(扬州大学动物科学与技术学院,扬州 225009)
乳腺是具有合成和泌乳功能的特殊器官,它通过各种机制从血液中吸收营养物质为其发育以及泌乳提供支持[1]。激素、营养、遗传、饲养管理等因素都不同程度地影响乳腺组织的发育[2]。乳腺对氨基酸的摄取、利用对乳蛋白的合成和乳产量的保证极为重要[3]。哺乳动物母乳中90%以上的乳蛋白是乳腺上皮细胞以血液中的氨基酸为原料合成的,其中酪蛋白的含量最高,占了总蛋白含量的近80%。氨基酸作为主要营养物质之一,与乳腺的生长发育及泌乳密切相关,就精氨酸(Arg)来说,作为一种新生哺乳动物的必需氨基酸,成年哺乳动物的条件性必需氨基酸,不仅是乳蛋白合成的底物,还是调控乳蛋白合成的信号分子,调节乳蛋白合成的转录、翻译[1],在动物体内具有重要的生理、代谢调控和营养作用。
Arg是目前发现的功能最多的一种氨基酸[4]。前人对乳腺限制性氨基酸摄取、利用的研究发现,饲粮添加适宜水平的Arg能够有效提高平均日增重,改善动物的生长性能[5-6];而且乳腺摄入的Arg显著超过其分泌量,同时Arg代谢水平随着细胞外 Arg 浓度的升高而升高[7-10];Doepel等[11]试验发现奶牛乳腺灌注Arg的试验组与对照组相比,乳蛋白的产量显著提高。以上研究结果提示过量保留于乳腺中的Arg除了用于乳蛋白的合成外,还有其他的代谢途径或代谢调节功能;本课题组Chen等[12]对体外培养乳腺上皮细胞的研究表明,体外培养添加Arg对奶牛乳腺上皮细胞酪蛋白的合成有一定的调节作用;Wang等[13]研究发现Arg通过哺乳动物类帕霉素(mTOR)途经调控酪蛋白的表达;徐柏林[1]在Arg影响乳腺上皮细胞内酪蛋白合成的试验中发现,将Arg含量比对照组提高1倍时乳腺上皮细胞αs-酪蛋白和β-酪蛋白的含量达到最大,且促乳腺上皮细胞增殖效果最佳。以上研究都表明了Arg对体外培养奶牛乳腺上皮细胞增殖和其酪蛋白表达有一定的促进作用,但对于Arg是否影响体内乳腺组织的发育和其酪蛋白的表达尚不得而知。为此,本研究在前期研究的基础上,通过向模式动物——Wistar大鼠的基础饲粮中添加Arg,研究Arg对其乳腺组织发育以及对乳腺酪蛋白合成的影响,以期为进一步研究Arg影响奶牛乳腺泌乳及其代谢机制提供一些试验依据。
1 材料与方法
1.1 试验动物与试验设计
采用同窝对照的方法,选择同窝、健康、雌性受孕Wistar大鼠12只(扬州大学比较医学研究中心提供),体重(260±10)g,各大鼠的生理状况基本一致,随机分成2组。试验大鼠单笼饲养,常规一致饲养管理和免疫程序,自然采光、通风,自由采食、饮水。
试验大鼠基础饲粮中粗蛋白质、消化能等营养物质需要量参照 Reeves等[14]文献,采用 AIN-93G大鼠纯化饲粮标准,交由南通特罗菲公司配制。Arg组在基础饲粮中添加与其等量的Arg(饲粮Arg含量1.280%,均以L-Arg计),对照组饲粮用谷氨酸替代精氨酸组中的精氨酸以平衡饲粮氮水平。试验饲粮组成及营养水平见表1。
试验分预试期4 d(分娩前4天),正试期为17 d(分娩后17天)。试验中有1只大鼠部分数据不全。
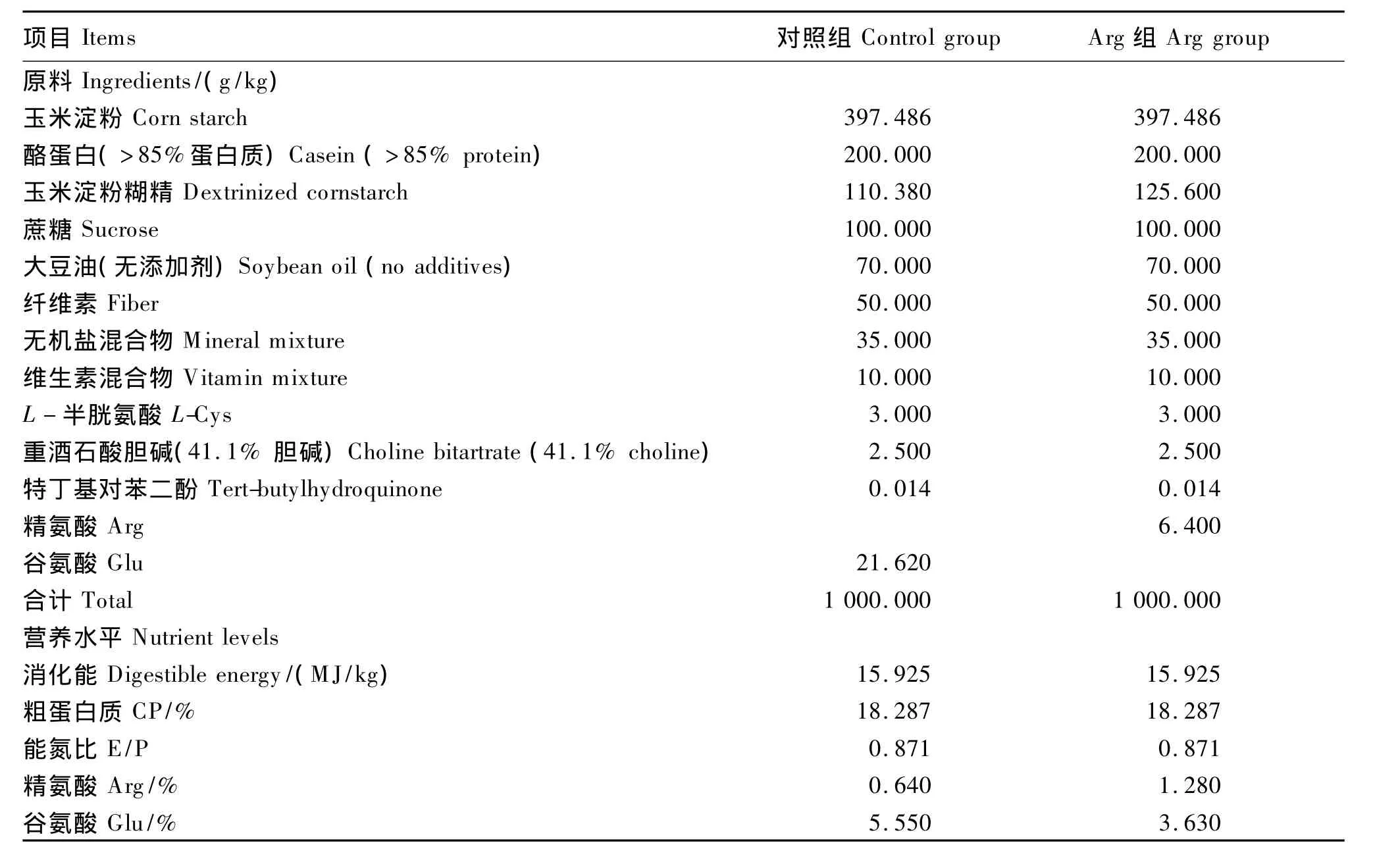
表1 试验饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of experimental diets(DM basis)[14]
1.2 大鼠乳腺组织的采集及保存
正试期结束,采集12只大鼠的乳腺组织,后用生理盐水冲洗,30 s内投入液氮保存。
1.3 指标测定
1.3.1 大鼠体重、仔鼠窝重的测定
待大鼠产仔泌乳后,每日固定时间(16:00)用电子称依次称取大鼠体重、仔鼠窝重,记录数据。称重结束后将大鼠、仔鼠放置原处。连续称重17 d。
1.3.2 乳腺腺泡面积的测定
通过明美数码成像系统软件(MC30)进行测量。
1.3.3 乳腺总蛋白含量的测定
将乳腺组织样本切割、裂解、离心提取,收集上清液。
乳腺总蛋白含量通过二喹啉甲酸(BCA)蛋白质浓度测定试剂盒(增强型)(P0010S,碧云天生物技术研究所)自行测定,具体测定步骤参见试剂盒说明书。
1.3.4 乳腺α-酪蛋白、β-酪蛋白、κ-酪蛋白含量的测定
将乳腺组织样本切割、裂解、离心提取,收集上清液。
通过大鼠酪蛋白酶联免疫分析(ELISA)试剂盒(上海联硕生物科技有限公司)自行测定大鼠乳腺α-酪蛋白、β-酪蛋白、κ-酪蛋白含量。具体测定步骤参见试剂盒说明书。试验所得的各种蛋白标准曲线的相关系数都高于0.99,可用于乳腺总蛋白以及各类酪蛋白含量的测定。
1.4 统计分析
用Excel对试验数据进行整理,采用 SPSS 16.0软件中 compare mean模块的 independentsamples t-test过程进行2个独立样本t检验。P<0.05表示差异显著,P<0.01表示差异极其显著。
2 结果与分析
2.1 大鼠体重、仔鼠窝重
由表2可知,试验期末的大鼠体重和仔鼠窝重在组间虽然都没有显著性的差异(P>0.05),但Arg组的大鼠体重和新生仔鼠窝重在数值上都高于对照组。
由图1可见,对照组和Arg组仔鼠窝重的增长S曲线变化趋势基本一致。1~8 d对照组与Arg组的仔鼠窝重增长曲线接近重合,几乎没有差异;9~17 d Arg组的仔鼠窝重增长速度略高于对照组,但没有明显的差异。
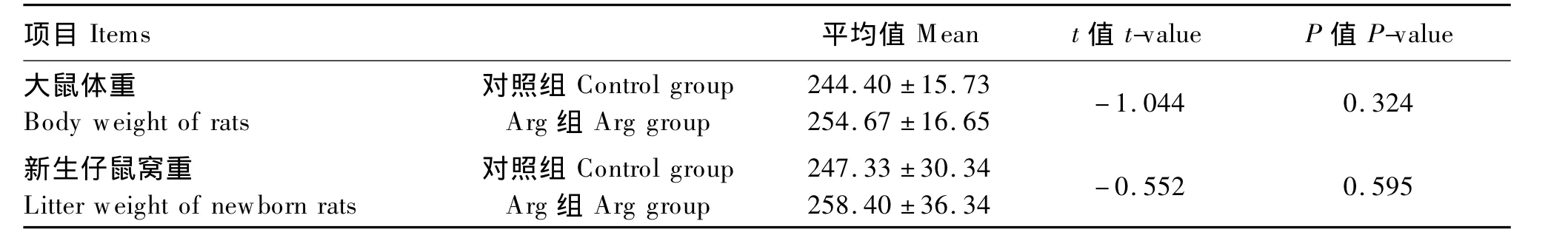
表2 试验结束时大鼠体重和新生仔鼠窝重Table 2 Body weight rats and litter weight of newborn rats at the end of the experiment g
图1 新生仔鼠窝重增长曲线Fig.1 The growth curve of litter weight of newborn rats
2.2 乳腺组织发育
图2 为分娩后大鼠的乳腺组织切片。由图可见,相对于对照组,Arg组乳腺腺泡较为规则、一致,而且腺泡切面面积相对更大;对照组乳腺的腺泡则大小不一,部分发育不完全,腺泡切面面积也相对较小。
并且通过测量和计算2组腺泡切面面积可知(表3),Arg组腺泡切面面积极显著大于对照组(P<0.01),腺泡面积的增大为乳腺蛋白质含量的提高提供了必要条件,进一步说明了Arg对大鼠乳腺蛋白质合成的促进作用。
2.3 乳腺蛋白质含量
由表3可知,Arg组和试验组乳腺总蛋白含量差异不显著(P>0.05)。整体看来酪蛋白的合成水平都有增加的趋势。其中Arg组β-酪蛋白含量显著高于对照组(P<0.05),而α-酪蛋白、κ-酪蛋白含量则未见显著增加(P>0.05)。
3 讨论
为了达到试验饲粮为酪蛋白模式的设计,本试验采用了半纯合技术进行饲粮配制,基础饲粮中采用酪蛋白为蛋白质源,因此,其Arg和谷氨酸含量比例即是酪蛋白模式中的比例,也是泌乳动物的理想模式。试验组增加其模式下的Arg含量,以突出在酪蛋白模式基础上2倍量的Arg(徐柏林[1]前期乳腺上皮细胞体外试验所获得的结果)是否在大鼠上有同样的促进作用;对照组则在酪蛋白的模式下,选择添加了在体内大量存在,可由其他氨基酸转变而来的非限制性氨基酸谷氨酸以配制等氮饲粮。本试验中粗蛋白质水平和能氮比在组间都基本一致,试验结果的差异应主要来自于处理的差异。另有研究认为,谷氨酸和Arg在体内有一定的代谢相关,但基本与改变含量和比例有关。如陈明洪等[15]在饲粮中添加Arg或谷氨酸,改变2者含量和比例未能有效提高育肥猪生长性能;黄新球等[16]对于Arg及N-氨甲酰谷氨酸(NCG)对断奶小鼠生长性能的研究表明,NCG引起机体内Arg合成量的变化并不与NCG的添加量成正比:饲粮中添加0.05%NCG的比添加0.1%的血清游离Arg含量更高。以上试验表明了超过一定量或含有充足量的Arg和谷氨酸时并不能体现其代谢相关或促进效应。本试验饲粮中谷氨酸的含量分别为3.630%、5.550%,Arg的含量分别为1.280%、0.640%,远超过前人研究中体现促进效应的水平。综上表明,在本试验供给基础饲粮为泌乳动物理想模式的条件下,谷氨酸主要作用是对照组的氮配平氨基酸。

图2 大鼠乳腺腺泡组织切片Fig.2 The histological section of rat mammary gland

表3 精氨酸对大鼠乳腺蛋白质含量及腺泡切面面积的影响Table 3 Effects of Arg on protein contents and acinar area of mammary gland in rats
Arg是组织蛋白质最多的氮携带者[4]。饲粮中添加Arg后,可促进氮沉积,母鼠可通过胎盘传递给胎儿更多营养物质(氨基酸、氧气等),促进胎盘和胎儿生长发育[17-18];在应激、疾病和感染的情况下,Arg能促进多种内分泌激素(如生长激素、胰岛素、胰高血糖素等)的释放,促进蛋白质的合成和抑制蛋白质的分解,从而间接促进动物生长[19-20]。Yao 等[21]在 7 日 龄 仔 猪 饲 粮 中 添 加0.6%的Arg,显著提高了平均日增重,促进了肌肉蛋白质的合成;Corzo等[22]研究雄性肉鸡Arg的需要时发现,饲粮中添加Arg能够显著提高42~56日龄雄性肉仔鸡的平均日采食量和平均日增重。本试验中,饲粮添加Arg大鼠体重虽然与对照组的差异不显著但在数值上有所增加,仔鼠窝重也有增加的趋势。这与上述研究结果有一定的一致性。
乳蛋白的合成量受乳腺组织发育状况和基因调控及外在条件的影响。首先,乳腺组织需要发育完全,才可为合成、泌乳提供充分的生理基础。乳腺组织在动物体内的增殖和分化受许多因素的影响,如激素、维生素、氨基酸、微量元素、生长因子等[23]。Arg作为一种氨基酸营养素,对乳腺细胞发育也有一定程度的促进作用。何晋等[24]研究发现,随着培养液中Arg浓度的增加,Arg对内皮祖细胞的增殖起到了促进作用;Bie等[25]研究结果表明,上皮细胞培养液中Arg浓度为0.3 mmol/L较适宜上皮细胞的增殖及蛋白质转化。说明Arg对不同细胞都有不同程度的促进作用,以此类推,可以猜想Arg对乳腺细胞同样具有促进作用。同时,Arg的代谢产物一氧化氮(NO)具有扩张血管的作用,因此Arg-NO途径具有促进乳腺及乳腺内血管的生长、提高营养物质的摄取量、改善大鼠的乳腺组织发育进而提高泌乳性能的作用[26]。
另外,添加Arg对外在因素的调控及酪蛋白基因的表达都会产生影响。近年来对影响乳腺上皮细胞中蛋白质合成因素的研究主要集中在对细胞中酪蛋白和乳清蛋白含量的检测上[27-28]。氨基酸作为乳蛋白合成的前体物对促进乳蛋白的合成应有适当的比例与浓度,氨基酸的平衡性对于提高乳蛋白含量和合成效率具有现实意义[29-30]。激素就是一种典型的外在因素能对乳蛋白的合成产生重要影响。Arg则可通过促进多种内分泌激素(包括胰岛素、生长激素、催乳素、抗利尿激素和儿茶酚胺等)的释放[4],从而可以调节乳腺上皮细胞的增殖、凋亡和免疫,促进泌乳和乳蛋白的合成[31-32]。同时基因水平的研究表明,Arg可通过调控乳腺上皮细胞内酪氨酸酶2-信号转导和转录激活子5(Jak2-Stat5)、mTOR信号转导通路影响酪蛋白基因的表达。其主要机制为激酶Jak2催化结合在受体上的Stat5蛋白发生磷酸化修饰,活化的Stat5蛋白以二聚体的形式进入细胞核内与靶基因结合,调控基因的转录[20]。徐柏林[1]以奶牛乳腺上皮细胞为模型研究发现,适宜浓度的Arg能促进奶牛乳腺上皮细胞中αS1-酪蛋白、αS2-酪蛋白、β-酪蛋白、κ-酪蛋白基因的表达,且当体外细胞培养液中Arg浓度为556.00 mg/L时,这4种基因的表达显著上调。本试验中Arg组分娩后大鼠的乳腺腺泡较为规则、一致,腺泡切面面积极显著大于对照组;添加Arg对大鼠乳腺β-酪蛋白的合成有显著的促进作用,对α-酪蛋白、κ-酪蛋白合成量也有所促进,与上述研究结果有着一致性。由此可见,Arg能够促进乳腺腺泡发育和酪蛋白基因的表达,进而表现为乳腺组织充分发育和酪蛋白的合成量的提高。
4 结论
饲粮添加Arg对大鼠乳腺组织发育及β-酪蛋白的合成有显著的促进作用。
[1] 徐柏林.精氨酸对乳腺上皮细胞中酪蛋白合成的影响及其调控机制[D].硕士学位论文.扬州:扬州大学,2012.
[2] 张伟.影响母猪乳腺组织发育的因素[J].养猪,2004,6:12 -15.
[3] 王强,敖长金,嘎尔迪,等.阴外动脉灌注氨基酸对奶山羊乳腺摄取乳成分前体物的影响[J].中国农业科学,2011,44(21):4481 -4487.
[4] 侯玉洁,徐俊,赵国琦,等.精氨酸的生理学功能及其在畜禽生产中的应用[J].中国饲料,2013,5:32 -36.
[5] KIM S W,MCPHERSON R L,WU G Y.Dietary arginine supplementation enhances the growth of milk fed young pigs[J].The Journal of Nutrition,2004,134(3):625-630.
[6] 周锡红,吴信,唐香山,等.不同水平精氨酸生素对断奶仔猪生长性能和血液指标的影响[J].农业现代化研究,2010,31(2):237 -240.
[7] MEPHAM T B,LINZELL J L.A quantitative assessment of the contribution of individual plasma amino acids to the synthesis of milk proteins by the goat mammary gland[J].Biochemical Journal,1966,101:76.
[8] GUINARD J,RULQUIN H,VERITE R.Effect of graded levels of duodenal infusion of casein on mammary uptake in lactation cows.2.Individual acids[J].Journal of Dairy Science,1994,77:2221 -2231.
[9] METCALF JA,WRAY-CAHEN D,CHETTLE E E,et al.The effect of increasing levels of dietary protein as protected soya on mammary metabolism in the lactating dairy cow[J].Journal of Animal Science,1996,69:603-611.
[10] BEQUETTE B J,BACKWELL R C.Amino acids supply and metabolism by the ruminant mammary gland[J].British Journal of Nutrition,1997,56:593 -605.
[11] DOEPEL L,LAPIERRE H.Deletion of arginine from an abomasal infusion of amino acid does not decrease milk protein yield in Holstein cows[J].Journal of Dairy Science,2011,94(2):864 -873.
[12] CHEN L M,LIZ T,WANG M Z,et al.Preliminary report of arginine on synthesis and gene expression of casein in bovine mammary epithelial cell[J].International Research Journal of Agricultural Science and Soil Science,2013,3:17 -23.
[13] WANG M Z,XU B L,WANG H R,et al.Effects of arginine concentration on the in vitro expression of casein and mTOR path way related genes in mammary epithelial cells from dairy cattle[J].PLoSOne,2014,9(5):1-8.
[14] REEVES PG,NIELSEN FH,FAHEY G C,Jr.AIN-93 purified diets for laboratory rodents:final report of the American Institute of Nutrition ad hoc writing committee on the reformulation of the AIN-76A rodent diet[J].The Journal of Nutrition,1993,123(11):1939 -1951.
[15] 陈明洪,段杰林,尹杰,等.谷氨酸和精氨酸对饲喂霉变饲粮育肥猪所受损伤的缓解作用[J].动物营养学报,2013,25(9):2101 -2110.
[16] 黄新球,王远兴,杨有仙,等.日粮中添加N-氨甲酰-L-谷氨酸及精氨酸对断奶小鼠生长性能的影响[J].食品科学,2011,32(19):253 -257.
[17] MATEORD R D,WU G,BAZERFW,et al.Dietary L-ariginine supplementation enhances the reproductive performance of gilts[J].The Journal of Nutrition,2007,137:652 -656.
[18] WU G,FULLER W,BAZER F W,et al.Important roles for arigine-family amino acids in swine nutrition and production[J].Livestock Science,2007,122:8 -22.
[19] FRANK J W,ESCOBAR J,NGUYEN H V,et al.Oral N-carbamyl glutamate supplementation increases protein synthesis in skeletal muscle of piglets[J].The Journal of Nutrition,2007,137:315 -319.
[20] WU G,MEININGER C J,KNABE D A,et al.Arginine nutrition in development health and disease[J].Current Opinion in Clinical Nutrition and Metabolic Care,2008,3:59 -66.
[21] YAO K,YIN Y L,CHU W Y,et al.Dietary arginine supplementation increases mTOR signaling activity in skeletal muscle of neonatal pigs[J].The Journal of Nutrition,2008,138(5):867 -872.
[22] CORZOA,MORANET,Jr,HOEHLE R D.Arginine need of heavy broiler males applying the ideal protein concept[J].Poultry Science,2003,82(3):402 -407.
[23] 徐柏林,王梦芝,张兴夫,等.精氨酸水平对奶牛乳腺上皮细胞体外生长及κ-酪蛋白基因表达的影响[J].动物营养学报,2012,24(5):852 -858.
[24] 何晋,谢秀梅,方叶青,等.L-Arg抑制非对称性二甲基Arg对内皮祖细胞的增殖作用[J].中国动脉硬化杂志,2007,15(10):751 -754.
[25] BIE T,YULONG Y,XIANGFENG K,et al.L-arginine stimulates proliferation and prevents endotoxin-induced death of intestinal cells[J].Amino Acids,2010,38(4):1227-1235.
[26] KIM S W,WU G.Regulatory role for amino acids in mammary gland growth and milks synthesis[J].Amino acids,2009,37(1):89 -95.
[27] SUN Y L,LIN C S,CHOU Y C.Gene transfection and expression in a mammary culture of mammary epithelial cells isolated from lactating sows[J].Cell biology International,2005,29(7):576 -582.
[28] MACKLE T R,DWYER D A,INGVARTSEN K L,et al.Bauman effects of insulin and postruminal supply of protein on use of amino acids by the mammary gland for milk protein synthesis[J].Journal of Dairy Science,2000,83:93 -105.
[29] 张兴夫,杜瑞平,敖长金,等.不同氨基酸模式对奶牛乳腺上皮细胞对酪蛋白合成的影响[J].动物营养学报,2013,25(8):1762 -1768.
[30] CHO J,OVETON T R,SCHWAB C G,et al.Determining the amount of rumen-protected merhionine supplement that corresponds to the optimal levels of methionine in metabolizable protein foe maximizing milk protein production and profit on dairy farms[J].Journal of Dairy Science,2007,90:4908 -4916.
[31] 方丽云,钟凯,王艳玲.乳腺免疫的研究进展[J].河南畜牧兽医,2007,5(28):12 -13.
[32] BRYONY S,WISEMAN Z W.Stromal Effects on mammary gland development and breast cancer[J].Science,2002,296:1046 -1049.

