体液添加EDTA-K2抗凝剂对细胞计数的影响
马 科,左路广,常晓彤,连晶晶,冯 博
体液添加EDTA-K2抗凝剂对细胞计数的影响
马 科,左路广,常晓彤,连晶晶,冯 博
目的:研究添加EDTA-K2抗凝剂对体液细胞计数的影响。方法:由临床送检的110份体液中取1、2、4、2 mL依次加入3支EDTA-K2抗凝剂及1支不含抗凝剂试管中,选用Sysmex XE-5000全自动血细胞分析仪测定白细胞(WBC)、红细胞(RBC)、单个核细胞(MN)、多个核细胞(PMN),分析添加EDTA-K2抗凝剂对体液细胞计数的影响;另收集体液,送检后及时测量并分装EDTA-K2抗凝剂及无抗凝剂试管中各2 mL,4℃冷藏2、4、6、12 h分别测量细胞含量,分析体液采集后不同时间细胞数量的变化趋势。结果:体液添加EDTA-K2抗凝剂各组相对于对照组细胞计数均无统计学差异;体液抽取后如无抗凝剂,随放置时间延长,白细胞计数出现下降趋势,EDTA-K2抗凝体液则无下降趋势。结论:体液中添加EDTA-K2抗凝剂可提高体液细胞计数的准确性,减小临床体液标本不能及时检测对细胞计数的影响。
体液;EDTA-K2抗凝剂;细胞计数
0 引言
体液(body fluid),细胞内液与外液的总称,主要包括脑脊液、胸腹水、关节液等。临床上产生胸腹水的病因主要有肝硬化、肝静脉闭塞、心脏衰竭、肾脏疾病、营养不良、厌食症、肿瘤、癌症等疾病[1-3]。计数胸腹水中的细胞含量可帮助临床研究疾病的发病机制,鉴别渗出液、漏出液,鉴别自发性细菌性腹膜炎等疾病[4-6]。检测关节液有助于区分关节肿胀为炎性或非炎性状态,计数脑脊液中的白细胞、红细胞含量可辅助诊断脑膜炎、脑炎、中枢神经系统疾病[7-10]。总之,精确计数体液对于疾病的鉴别诊断、病情预后评估具有十分重要的意义。随着临床检验医学技术的发展,传统手工计数体液细胞已不能满足临床需要,具有体液测定功能的仪器已逐渐应用于医疗领域[11-14]。临床工作中,体液标本受患者病情、采集时间、检测条件等多种因素影响,导致体液标本不能及时检测,同时体液标本易发生自凝、细胞溶解现象,影响细胞计数,使检测结果准确性降低,延误临床诊断与治疗。EDTA-K2具有良好抗凝作用,本文对是否可以在标本采集时加入EDTA-K2来保护体液中的细胞成分,提高细胞计数的准确性进行研究,现将结果报告如下。
1 材料和方法
1.1 材料
1.1.1 标本来源
110份体液标本均取自2013年11月至2014年6月河北北方学院附属第一医院住院、门诊患者的体液标本。其中,男58例,女52例;年龄15~81岁,平均(45.3±16.2)岁;胸水标本64例,腹水标本24例,脑脊液标本22例。标本由临床医师按标准操作规范采集后及时送检,所有患者均知情同意,符合本院医学伦理委员会标准。
1.1.2 仪器与试剂
日本Sysmex XE-5000血细胞分析仪及配套试剂、校准品、质控品;EDTA-K2抗凝管。
1.2 方法
1.2.1 添加EDTA-K2抗凝剂对体液细胞计数的影响
标本由临床医师按标准操作规范采集并及时送检,每份体液标本取1、2、4、2 mL,依次加入3支EDTA-K2抗凝剂及1支不含抗凝剂试管中,选用Sysmex XE-5000全自动血细胞分析仪测定白细胞(WBC)、红细胞(RBC)、单个核细胞(MN)、多个核细胞(PMN),分析添加EDTA-K2抗凝剂对体液细胞计数的影响。
1.2.2 体液标本采集后不同时间细胞数量变化
收集体液标本,送检后及时测量,结果为对照组数据。由于脑脊液标本临床每次采集量较少,所以测量后的体液标本分装于EDTA-K2抗凝剂及无抗凝剂试管中各2 mL,置于4℃冰箱冷藏,分装后2、4、6、12 h分别测量细胞含量,分析体液标本采集后在不同时间细胞数量的变化趋势。
1.2.3 统计学方法
采用Excel 2007、IBM SPSS Statistics 19统计软件对数据进行统计处理,计量资料采用均数±标准差表示,即±s,选用Wilcoxon符号秩和检验进行分析,P<0.05为有统计学差异。
2 结果
2.1 EDTA-K2抗凝体液细胞计数结果
实验中选用胸水12例、腹水10例。经处理的体液标本进行测量后记录结果,WBC范围(48~12 422)×106/L,RBC范围(0~128)×109/L。无抗凝剂体液为对照组,加入3支EDTA-K2抗凝管的体液依次记为实验组1、2、3。经正态性检验P<0.05,数据属于偏态分布,选用IBMSPSSStatistics19统计软件进行Wilcoxon符号秩和检验,结果见表1。

表1 EDTA-K2抗凝剂对体液细胞计数的影响
结合表1及统计结果,对照组WBC与实验1、2、3组经Wilcoxon符号秩和检验,Z值依次为-1.804、-1.098、-1.883,RBC的Z值依次为-2.060、-0.412、-1.134,MN的Z值依次为-0.550、-0.863、-1.255,PMN的Z值依次为-1.688、-1.138、-1.374,P均大于0.05,体液添加EDTA-K2抗凝剂各组相对于对照组细胞计数均无统计学差异。
2.2 体液标本采集后不同时间细胞数量变化
实验选用胸水52例、腹水14例、脑脊液22例,送检后立即进行检测,WBC范围(5~466 027)×106/L、RBC范围(0~794)×109/L,检测结果作对照组数据,分装后2、4、6、12 h检测的非抗凝、抗凝体液标本依次记为实验组2-N、2-E、4-N、4-E、6-N、6-E、12-N、12-E,选用Wilcoxon符号秩和检验分析,结果见表2。用各时段抗凝组、非抗凝组细胞计数均值占对照组百分比作图,如图1~4所示。由图表可知,放置时间为4 h时,无抗凝剂组WBC、MN为91.1%、92.4%,减少8.9%、7.6%,相对于对照组具有统计学差异(ZWBC=-2.108、ZMN=-2.250,P<0.05);6 h后,WBC减少13.7%、MN减少11.7%、PMN减少22.8%(ZWBC= -3.515、ZMN=-2.830、ZPMN=-2.537,P<0.05);12 h后WBC减少22.3%、MN减少15.9%、PMN减少32.3%
(ZWBC=-3.975、ZMN=-4.673、ZPMN=-3.512,P<0.05)。抗凝组各时段WBC数量变化与对照组无统计学差异(P>0.05),抗凝组、非抗凝组标本中各时段RBC数量与对照组均无统计学差异(P>0.05)。
3 讨论
随着现代医学的发展,体液常规检测日益受到临床工作人员重视,其对疾病的诊断及病情的评估及预后意义重大。手工计数体液红白细胞工作耗时费力,而体液细胞计数自动化可规避手工法的缺点[15],使临床检验工作便捷、快速、精确。
由实验可知,临床采集体液标本时添加EDTAK2抗凝剂不会影响体液细胞数量测定的准确性。未添加抗凝剂标本送检后不及时测定,标本中的WBC数量会随放置时间延长出现下降趋势。在标本送检2 h后,WBC、MN、PMN检测数量为原始对照的95.5%、95.2%、95.6%,检测数值减少4.5%、4.8%、4.4%(P>0.05);4 h后减少8.9%、7.6%、11.1%,其中,WBC、MN数量减少具有统计学差异(P<0.05);6h后减少13.7%、11.7%、22.8%(P<0.05);12 h后减少22.3%、15.9%、32.3%(P<0.05)。RBC数量变化无统计学差异(P>0.05)。由于EDTA-K2可有效保护体液细胞成分,实验中添加EDTA-K2抗凝剂后,WBC计数随着放置时间的延长下降趋势较小,标本采集后4℃保存12 h后WBC数量仅下降1.8%,RBC数量无明显变化。

表2 各时间段抗凝、非抗凝组细胞计数统计

图1 不同放置时间WBC数量变化趋势
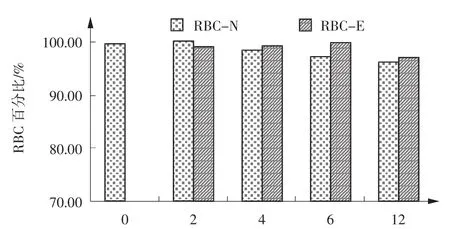
图2 不同放置时间RBC数量变化趋势
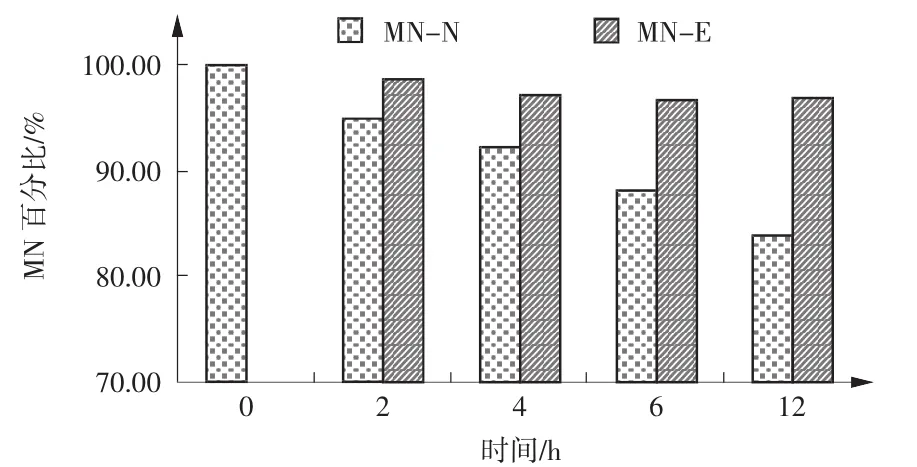
图3 不同放置时间MN数量变化趋势
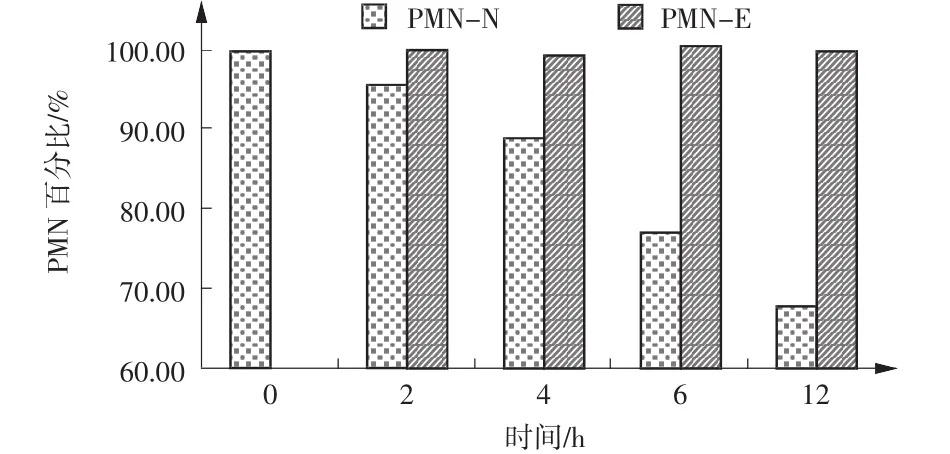
图4 不同放置时间PMN数量变化趋势
胸腹水计数的准确性对于渗出液、漏出液的鉴别以及结核性胸、腹膜炎,化脓性细菌感染,恶性肿瘤等疾病的诊断具有十分重要的意义。对于脑脊液标本,由于其细胞含量相对较低,参考值范围较窄(正常范围(0~10)×106/L),脑脊液细胞计数准确对于鉴别中枢神经系统疾病具有重要意义,检测结果不准确则严重影响临床诊断和治疗。因此,建议临床采集体液标本计数时,应抽取2~4 mL加入EDTAK2抗凝管中送检,以减缓体液标本中细胞数量因不能及时检测所造成的下降趋势,夜间急诊或不能及时检测的标本,可放置4℃冰箱冷藏,12 h内测定不影响计数结果的准确性。如未添加抗凝剂,则应在标本采集后2 h之内完成细胞计数,若检测时间延长,则会导致白细胞计数减少、准确性降低,延误病情的诊断和治疗。
[1] de Jonge R,Brouwer R,de Graaf M T,et al.Evaluation of the new body fluid mode on the Sysmex XE-5000 for counting leukocytes and erythrocytes in cerebrospinal fluid and other body fluids[J].Clin Chem Lab Med,2010,48(5):665-675.
[2] Smolle E,Taucher V,Haybaeck J.Malignant ascites in ovarian cancer and the role of targeted therapeutics[J].Anticancer Res,2014,34(4):1 553-1 561.
[3] Sotirakopoulos N G,Kalogiannidou I M,Tersi M E,et al.Peritoneal dialysis for patients suffering from severe heart failure[J].Clin Nephrol,2011,76(2):124-129.
[4] Dabiri H,Azimi Rad M,Tavafzadeh R,et al.Bacteriologic study of cirrhotic patients with non-neutrocytic ascites[J].Gastroenterol Hepatol Bed Bench,2014,7(4):224-229.
[5] Kopcinovic L M,Culej J.Pleural,peritoneal and pericardial effusions -a biochemical approach[J].Biochem Med(Zagreb),2014,24(1):123-137.
[6]Sundaram V,Manne V,Al-Osaimi A M.Ascites and spontaneous bacterial peritonitis:recommendationsfromtwoUnitedStatescenters[J]. Saudi J Gastroenterol,2014,20(5):279-287.
[7] Paris A,Nhan T,Cornet E,et al.Performance evaluation of the body fluid mode on the platform Sysmex XE-5000 series automated hematology analyzer[J].Int J Lab Hematol,2010,32(5):539-547.
[8] Zimmermann M,Otto C,Gonzalez J B,et al.Cellular origin and diagnostic significance of high-fluorescent cells in cerebrospinal fluid detected by the XE-5000 hematology analyzer[J].Int J Lab Hematol,2013,35(6):580-588.
[9] Weston C L,Glantz M J,Connor J R.Detection of cancer cells in the cerebrospinal fluid:current methods and future directions[J].Fluids Barriers CNS,2011,8(1):14.
[10]McCaffrey L M,Petelin A,Cunha B A.Systemic lupus erythematosus(SLE)cerebritis versus Listeria monocytogenes meningoencephalitis in a patient with systemic lupus erythematosus on chronic corticosteroid therapy:the diagnostic importance of cerebrospinal fluid(CSF)of lactic acid levels[J].Heart Lung,2012,41(4):394-397.
[11]Lippi G,Cattabiani C,Benegiamo A,et al.Evaluation of white blood cell count in peritoneal fluid with five different hemocytometers[J]. Clin Biochem,2013,46(1/2):173-176.
[12]Froom P,Diab A,Barak M.Automated evaluation of synovial and ascitic fluids with the Advia 2120 hematology analyzer[J].Am J Clin Pathol,2013,140(6):828-830.
[13]Fleming C,Brouwer R,Lindemans J,et al.Validation of the body fluid module on the new Sysmex XN-1000 for counting blood cells in cerebrospinal fluid and other body fluids[J].Clin Chem Lab Med,2012,50(10):1 791-1 798.
[14]陆进,金燕,吴元健.Sysmex XE-5000血液分析仪检测非血体液细胞的性能评价[J].临床检验杂志,2012,30(4):318-319.
[15]马科,张娅娟,冯博,等.Sysmex XE-5000全自动血细胞分析仪检测体液标本性能评价研究[J].医疗卫生装备,2014,35(9):90-93.
(收稿:2014-09-12 修回:2014-12-25)
Study on impact of EDTA-K2anticoagulant added into body fluid on cell count
MA Ke1,2,ZUO Lu-guang1,CHANG Xiao-tong2,LIAN Jing-jing1,FENG Bo1
(1.The First Affiliated Hospital of Hebei North University,Zhangjiakou 075000,Hebei Province,China; 2.Hebei North University,Zhangjiakou 075000,Hebei Province,China)
ObjectiveTo evaluate the impact of adding EDTA-K2anticoagulant to body fluid on humoral cell count. MethodsThere were 1,2,4 and 2 mL of body fluid were respectively extracted from each of 110 clinical specimens and then dropped into three tubes with EDTA-K2anticoagulant and one empty tube respectively.Sysmex XE-5000 automatic blood cell analyzer was used to detect WBC,RBC,MN and PMN so as to analyze the impact of EDTA-K2anticoagulant on humoral cell count.Some other specimens were tested,and then two 2 mL of body fluid were drawn from them and dropped into one tube with EDTA-K2anticoagulant and one empty tube respectively,cell count was carried out after the tubes were in the condition of 4℃for 2,4,6 and 12 hours to determine the trend that cell count changed with the time going by.ResultsEDTA-K2anticoagulant had no significant impact on cell count,while WBC count decreased with the time going by when EDTA-K2anticoagulant was absent.ConclusionAdding EDTA-K2anticoagulant into the body fluid can enhance the accuracy of humoral cell count,and can relieve the influence of delayed detection on cell count.[Chinese Medical Equipment Journal,2015,36(4):91-93]
body fluid;EDTA-K2anticoagulant;cell count
R318.6;TH776
A
1003-8868(2015)04-0091-03
10.7687/J.ISSN1003-8868.2015.04.091
河北省高等学校科学技术研究青年基金项目(Q2012141)
马 科(1977—),男,主管检验师,主要从事临床检验方面的研究工作,E-mail:mkzyj@139.com。
075000河北张家口,河北北方学院附属第一医院(马 科,左路广,连晶晶,冯 博);075000河北张家口,河北北方学院(马 科,常晓彤)
常晓彤,E-mail:changxt1212@vip.sina.com

