神经干细胞移植减轻ICH模型大鼠的神经功能障碍
祁 景 刘小军 周明锴
郑州大学第二附属医院ICU 郑州 450014
脑出血(intracerebral hemorrhage,ICH)是一种严重威胁人类健康的重大疾病[1]。本实验从细胞替代、旁分泌脑源性生长因子和促进突触再生的角度,探讨神经干细胞(neural sfem celle,NSCS)移植改善脑出血大鼠神经功能的可能机制。
1 材料和方法
1.1 实验动物分组及模型制作 动物的饲养和后续所有相关实验程序均经郑州大学伦理委员会批准。SD大鼠由河南省动物中心提供。随机选取雄性SD大鼠30只,分为3组:sham组(采用立体定位仪定位穿刺但不打入胶原酶)10只,ICH模型组(模型组,采用立体定位仪定位穿刺并打入胶原酶并鉴定合格)10只,NSCS细胞干预组(NSCS组,采用立体定位仪定位穿刺并鉴定合格后注射NSCS 1×106)10只,参照文献[2]及George Paxinos大鼠脑立体定位图谱,将大鼠取俯卧位,采用固定器,固定在大鼠脑立体定位仪上,以左侧纹状体为穿刺点(前囟后0.2mm,左侧旁3mm,垂直6 mm)。采用10μL微量进样器,在该穿刺点缓慢注入0.5μLⅦ型胶原酶溶液(sigma公司),留针约10min后缓慢退出穿刺针。术后清洁创面,缝合头皮。术后24h内进行mNSS评分[3],选取8~12分为符合标准纳入分组内。
1.2 NSCS的培养 复苏NSCS(本实验室保存),给复苏的NSCS每天更换细胞培养基(DMEM/F12,20%KSR,1mM L-谷氨酰胺,0.1mMβ巯基乙醇,0.1mM NEAA,10ng/mL bFGF),长至可以传代。
1.3 神经功能评分 采用mNSS评分(包括运动、感觉、平衡、反射)评价大鼠神经功能缺损和恢复情况,各组均在术后1、3、7、14、28d评分。
1.4 脑组织取材 造模后28d提取各组大鼠脑组织标本,3~5只多聚甲醛灌注固定法固定脑组织,梯度蔗糖脱水后冰冻冠状切片(厚12μm)。
1.5 免疫组织化学染色 各组切片做brdu(抗体均购自santa,一抗为鼠抗人,二抗为兔抗鼠)的免疫荧光染色,和BDNF和GAP-43(抗体均购自santa,一抗为兔抗鼠,二抗为山羊抗兔)的免疫组织化学染色。免疫组化采用imageJ进行阳性信号灰度值的测定分析。
1.6 统计学分析 采用SPSS 13.0统计软件对数据进行分析,计量资料以均数±标准差(±s)表示,其中mNSS数据行重复测量分析,其余资料行单因素方差分析并行组间两两比较,P<0.05为差异有统计学意义。
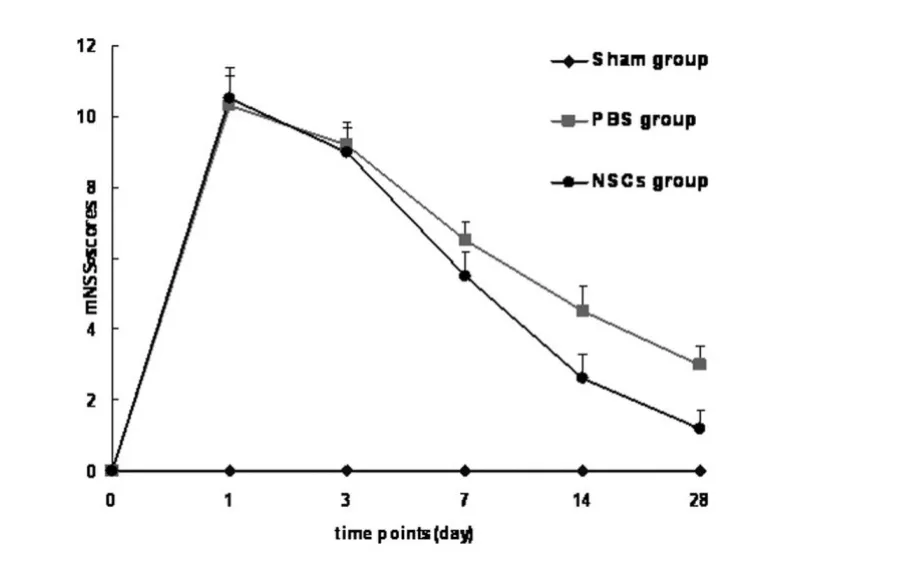
图1 各组各时间点mNSS评分结果,第14天起,各时间点NSCS组的评分明显优于模型组、假手术组(P<0.05)
2 结果
2.1 各组大鼠神经功能评分比较 立体定向注射胶原酶诱导大鼠脑出血后,大鼠迅速出现出血、对侧偏瘫等神经功能缺损的表现,症状体征于术后1~3d达高峰,随后逐渐恢复。NSCS组较模型组后14d及28d的mNSS评分且差异有统计学意义(P<0.05)。见图1。
2.2 Brdu免疫荧光染色 荧光显微镜下可见Brdu免疫荧光染色阳性的细胞明显聚集分布于血肿周围,血肿对侧仅可见少量阳性细胞散在分布。见图2。
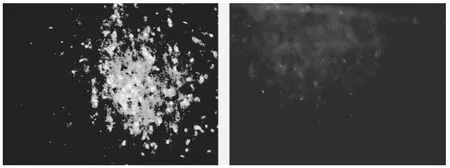
图2 绿色免疫染色为阳性,A为血肿周围,B为血肿对侧脑区(200×)
2.3 BDNF表达上升 BDNF在3组中均有表达,且在血肿周围的表达量较高。免疫组化阳性细胞胞浆被染为棕褐色或棕黄色颗粒状,阴性者除细胞核染成蓝色外,无棕黄色反应物。BDNF在假手术组,模型组仅可见少量阳性细胞,NSCS组较两者增多。结果显示,NSCS组高于组模型组,差异有统计学意义(P<0.05)。见图5。
2.4 GAP-43表达上升 GAP-43在各组中也均有表达,GAP-43在NSCS组较假手术组与模型组表达增多见图4。结果显示NSCS组与假手术组的阳性细胞数差异有统计学意义(P<0.05)。见图5。
3 讨论
脑出血引起的神经功能障碍,严重威胁人类健康和影响生活质量。随着干细胞技术的发展,干细胞其衍生物成为人类神经系统难治性疾病——脑出血富有应用前景的治疗选择之一[4]。
本实验NSCS干预组第14天及第28天其神经功能评分显著优于模型组。从行为学上表明NSCS移植在脑出血模型中具有确实的治疗作用。
BDNF是一类多功能的多肽生长因子,具有调节神经元的存活、分化,以及轴突导向和突触的功能[5]。BDNF激活高亲和力受体TrkB后有助于神经存活,还具有调节突触的结构和数量、促进新形成突触的发育和成熟、促进树突棘和轴突的生长等作用。我们通过免疫组织化学染色的方法检测到BDNF分泌增多,证实了NSCS分化的细胞具有促进旁分泌的功能。本实验通过立体定位向ICH大鼠移植NSCS,NSCS可促进BDNF的表达增多。
GAP-43是一种广泛分布在神经系统中的胞膜磷酸蛋白质[6]。GAP-43是可以促进神经元发育和再生的一个重要的内在决定因子,它是由神经元包体合成,与神经轴突的生长密切相关,在神经元发育和再生过程中,作为神经元的损伤、修复及再生的重要分子标志物,随着神经轴突的生长大量合成[7]。BDNF能够促进轴突生长锥表面GAP-43和轴突骨架蛋白β-tublin表达的上调从而促进轴突的延伸[8]。
本实验进一步证实,NSCS的移植能够改善局部的微环境、上调BDNF并启动再生相关GAP-43的表达增多,进而促进脑出血后神经功能的恢复。总之,我们以脑出血模型大鼠为研究对象,采用ICH患者来源的NSCS进行移植治疗。结果表明NSCS移植能有效改善ICH模型大鼠的神经功能障碍,其机制为细胞替代、旁分泌神经营养因子和促进轴突再生等多个方面。

图3 BDNF免疫组化染色,A假手术组,B模型组,NSCS组(400×)
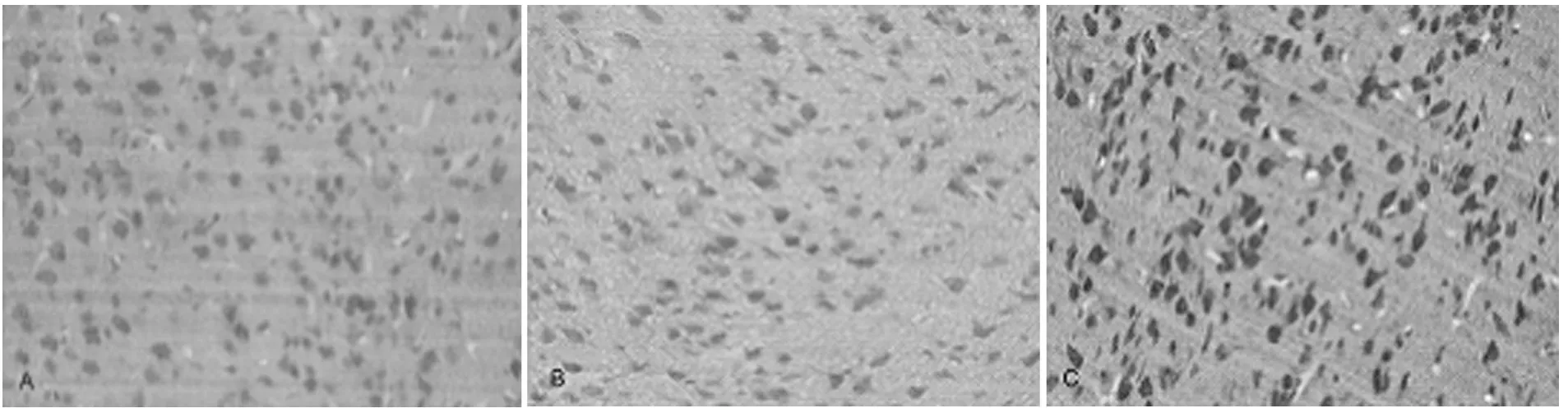
图4 GAP-43免疫组化染色,A假手术组,B模型组,NSCS组(400×)
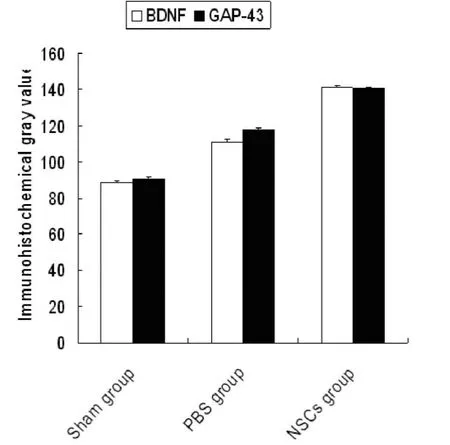
图5 BDNF及GAP-43免疫组化的灰度值,各组均为阳性,但NSCS组较假手术组、模型组灰度值均增多(P<0.05)
[1]Lindvall O,Kokaia Z.Stem cells for the treatment of neurological disorders[J].Nature,2006,441(5):1 094-1 096.
[2]Dénes A,Ferenczi S,kovács kJ.Systemic inflammatory challen ges compromise survival after experimental stroke via augmenting brain inflammation,blood-brai barrier damage and brain oedema independently of infarct size[J].J Neuroinflamm,2011,8(3):164.
[3]Chen J,Li Y,Wang L,et al.Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats[J].Stroke,2001,32(4):1 005-1 011.
[4]Lindvall O,Kokaia Z.Stem cell research in stroke:How far from the clinic[J]Stroke,2011,42(8):2 369-2 375.
[5]Cowansage KK,LeDoux JE,Monfils MH,et al.Brain-derived neurotrophic factor:a dynamic gatekeeper of neural plasticity[J].Curr Mol Pharmacol,2010,3(1):12-29.
[6]Paul DS,John DH.betall-tubulin and GAP 243mRNA expression in chro2nically injured neuronsof the red nucleusafter a second spinal cordinjury[J].ExperimentalNeurology,2003,182(2):537-547.
[7]Andrews EM,Tsai SY,Johnson SC,et al.Human adult bone marrow-derived somatic cell therapy results in functional recovery and axonal plasticity following stroke in the rat[J].Exp Neurol,2008,211(23):588-592.
[8]Husson I,Rangon CM,Lelievre V,et al.Gressens BDNF-induced white matter neuroprotection and stage-dependent neuronal survival following a neonatal excitotoxic challenge Cereb[J].Cortex,2005,15(12):250-261.

