中学解题研究之电化学
中学解题研究之电化学
陈静棠衷明华
(韩山师范学院化学系,广东 潮州 521041)
摘要:自2010年广东高考进行改革后,化学科归入理科综合的范畴内,而且近年来电化学的应用领域越来越广泛,所以电化学成为了高考命题热点。然而很多学生对电化学这类题型甚为苦恼,觉得太杂乱,不易把握。其实电化学所考察的要点侧重于基础知识,只要我们把基础知识学好,将我们学习的知识点进行归纳,再掌握一些解题技巧,就可以在高考中以不变应万变。
关键词:高考改革电化学解题技巧
一、近年高考试题分析

表 近年高考试题分析
从表中我们可以看出,2011—2014年广东高考卷对电化学知识的考查题量为1至3道题,分值比例在4%至12%之间,题型以填空题、综合题为主,在综合题中进行考查,对考生的电化学的掌握程度要求较高,考察要点侧重于基础知识,估计2015年电化学这部分知识点占广东高考理综分值为10%左右。
二、常见考点归纳
1、判断电极的极性、电子转移、电流方向、电解质溶液中的离子转移等问题。
2、能写出电极反应式并判断电极反应时电极现象、溶液浓度的变化或是酸碱性(pH)变化。
3、能根据原电池、电解池的电极变化判断金属活动性强弱。
4、理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。
5、了解原电池和电解池的主要运用。
三、基础知识及解题技巧
(一)判断电极的极性、电子转移、电流方向、电解质溶液中的离子转移等问题
1、原电池:把化学能转化为电能的装置,构成的条件是能自发发生氧化还原反应,有电解质溶液,两个活泼型不同的电极、形成闭合回路。
(1)如何判断原电池的极性——负极发生氧化反应正极还原反应。
(2)如何判断电子转移、电流方向、电解质溶液中的离子转移——电子从负极流向正极,而电流方向与电子定向移动的方向相反,电解质溶液中阴离子向负极迁移,阳离子向正极迁移。
2、电解池:把电能转化为化学能的装置,它构成的条件是有外加电源、与外电源相连的两个电极、有电解质溶液(或熔融)、形成闭合回路。
(1)如何判断电解池的极性——阳极是与电源正极相连的电极,失去电子发生氧化反应,阴极是与电源负极相连的电极,得到电子发生还原反应(阳极氧阴极还)。
(2)如何判断电子转移、电解质溶液中的离子转移——电子从电源负极经外导线流向电解池阴极、电解质溶液中阳离子向阴极移动,阴离子向阳极移动。
(二)书写电极反应方程式
1、原电池反应式的书写
(1)仅有一电极材料参与反应:参与反应的金属电极失电子为负极,另一电极往往为正极,正极是介质溶液中的微粒得电子(正极反应一般为析氢、吸氧、析Cu、Ag等)。
a、酸性较强介质:正极一般是析氢反应。
负极:Zn-2e-=Zn2+;正极:2H++2e-=H2↑
b、接近中性介质或碱性:正极一般是吸氧反应。
负极:2Fe-4e-=2Fe2+;正极:O2+4e-+2H2O=4OH-
c、含不活泼金属的盐溶液为介质:正极析出不活泼金属(Cu、Ag等)。
负极:Fe-2e-=Fe2+;正极:Cu2++2e-=Cu
(2)两电极材料均参与反应:当负极为金属,正极为某金属氧化物时(如:铅蓄电池),且负极金属失电子后形成的离子能继续与溶液形成沉淀时,此时负极为金属失电子,形成的离子再和溶液中的离子发生复分解反应。正极为某金属氧化物得电子,若形成的物质能继续跟电解质发生反应,则正极反应式为正极得电子,再发生复分解反应。下面我们以铅蓄电池为例。[铅蓄电池]负极:铅;正极:二氧化铅;电解质溶液:硫酸溶液。
负极反应式为:Pb-2e-+SO42-=PbSO4+2H2O
正极反应式为:PbO2+2e-+4H++SO42-=PbSO4+2H2O
(3)电极材料本身均不参与反应即都为惰性电极(常见于燃料电池)负极为该燃料失电子,正极一般为O2得电子。
例题:在碱性介质中以CH4为燃料的燃料电池的正极反应式为:2O2+4H2O+8e-=8OH-,请写出该燃料电池的负极反应方程式。
解析:该电池为燃料电池,故负极为燃料失电子,即CH4失电子。又电解质溶液呈碱性,故负极反应方程式为CH4+10OH--8e-=7H2O+CO32-
书写原电池总结:准确判断原电池的正负极,高度注意电解质的酸碱性,牢牢抓住总的反应方程式,不能忽视电子转移数相等。
2、电解池反应式的书写
(1)明白电解池原理:电解池是通过外接电流的作用,与电源负极相连的阴极得到电子,而阳极失去电子。
(2)列离子,判运动:分析溶液中存在哪些离子,判断离子的迁移。
如:氯化钠溶液,由于具有电解质氯化钠和水,所以溶液中会存在H+、Cl-、Na+、OH-。根据物理学知识,在电场的作用下,阳离子(H+、Na+)会向阴极移动,阴离子(Cl-、OH-)会向阳极移动。
定得失:依照经验判定两极得失电子的物质。
阴极放电顺序Ag+>Fe3+>Cu2+>H+酸>Pb2+>Sn2+>Fe2+>Zn2+>H+水>Al3+>Mg2+>Na+>Ca2+>K+;我们如果细看一下,就会发现这个放电顺序,即是我们所讲的氧化性强弱的顺序,因为:H+>Na+,所以阴极的电极反应式为:2H++2e-=H2↑
阳极放电顺序:M(活性电极、即除金、铂以外的金属)>X-(S2->I->Br->Cl-)>OH->含氧酸根;我们细看一下,会发现这里同样是氧化还原反应知识:先强后弱规律,还原性强的物质先失去电子。因为石墨电解为惰性电极,且Cl->OH-,所以阳极的电极反应式为:2Cl--2e-=Cl2↑
四大电解类型
1.电解电解质型(例:HCl、CuCl2)
2HCl=H2↑+Cl2↑
2.电解水型(例:NaOH、H2SO4、Na2SO4)
2H2O=2H2↑+O2↑
3.放H2生碱型(活泼金属无氧酸盐,例:NaCl)
阳极:2Cl-—2e-=Cl2↑(氧化反应)
阴极:2H+-2e-=H2↑(还原反应)
总:2NaCl+2H2O=2NaOH+H2↑+Cl2↑
4.放氧生酸型(不活泼金属含氧酸盐,例:CuSO4)
阳极:4OH-—4e-=2H2O+O2↑(氧化反应)
综上可知,若想让电解质复原,只需加入电解后从溶液中出来的物质(气体和沉淀)即可,如电解H2SO4溶液,从溶液中出来的是H2和O2,相当于电解水,故只需往溶液中加入适当的水(具体多少得算)。
(三)原电池和电解池的应用
1、原电池的应用
(1)比较不同金属的活动性强弱:根据原电池原理可知,在原电池反应过程中,一般活动性强的金属作负极,而活动性弱的金属(或碳棒)作正极。
(2)加快反应速率:原电池可以加快化学反应速率。如锌和稀硫酸反应制取氢气时,可向溶液中滴加少量硫酸铜,形成铜-锌原电池,加快反应进行。
2、电解池的应用
(1)电解饱和食盐水
阳极反应式:2Cl--2e-=Cl2↑
阴极反应式:2H++2e-=H2↑
总反应式:2NaCl+2H2O=Cl2↑+H2↑+2NaCl
应用:氯碱工业制Cl2、H2和NaCl。
(2)电镀或电解精炼铜
1待镀金属或精铜作阴极;镀层金属或粗铜作阳极。
2电极反应:阳极:Cu-2e-=Cu2+;阴极:Cu2++2e-=Cu
(3)冶炼金属(以冶炼Na为例)
1电极反应:阳极:2Cl-—2e-=Cl2↑;阴极:2Na++2e-=2Na
2总反应式:2NaCl(熔融)=2Na+Cl2↑
应用:冶炼钠、镁、铝等活泼金属。
(四)金属的防护
1、加防护层,如涂油漆、覆盖陶瓷、电镀、金属钝化等。
2、改变金属的内部结构,如将普通钢制成不锈钢。
3、电化学保护法。
①牺牲阳极的正极(阴极)保护法:原电池原理,正极被保护。如在被保护的钢铁设备上装上若干较活泼的金属如锌,让在被保护的金属作原电池的正极。
②外加电源的阴极保护法:利用电解池原理,阴极被保护。如用被保护的钢铁设备作阴极,惰性电极作阳极,外接直流电源。
四、典型习题
例1(双项)铜锌原电池(如图)工作时,下列叙述正确的是()。
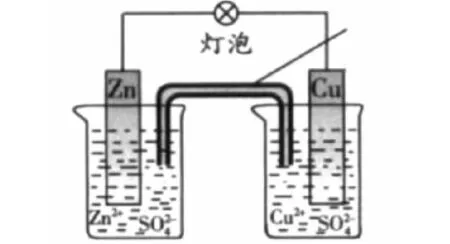
图 铜锌原电池
A.正极反应为:Zn—2e-=Zn2+
B.电池反应为:Zn+Cu2+=Zn2++Cu
C.在外电路中,电子从负极流向正极
D.盐桥中的K+移向ZnSO4溶液
解析:我们知道Zn的活泼性比Cu强,所以Zn是负极,故A错。电池总反应和没有形成原电池时的氧化还原反应相同,故B正确。根据闭合回路的电流方向,在外电路中,电子由负极流向正极,故C正确。在溶液中,阳离子往正极移动,阴离子往负极移动,故D错误。答案:BC。
例2(2011年广东高考32(5))钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是()。
答案:(5)阳极:Al-+3e-=Al3+;阴极:4Al2Cl7―+3e-=7AlCl4―+Al。
解析:铝在空气中易形成一层极薄的致密而坚固的氧化膜,它能阻止氧化深入内部,起到防腐保护作用。从上面几个高考电化学题来看,高考题其实并不难,只要掌握了上面的知识点,高考电化学就没什么可怕的。
例3(2013 年广东高考33)能量之间可以相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。①完成原电池的装置示意图(如图),并作相应标注。要求:在同一烧杯中,电极与溶液含相同的金属元素。
②铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极。(如图)
③根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在②的材料中应选()作阳极。
答案:①

图 原电池的装置示意图
②电极逐渐溶解
③Zn
解析:②由题给试剂,结合原电池的形成条件可知可以组合的原电池可以是:锌铜、锌铁、铁铜原电池。由图示所给电子移动方向可知左边为负极(活泼金属)、右边为正极(不活泼金属),则组装的原电池可以如下:

图 组装的原电池
由所给的电极材料可知,当铜片做电极时,铜片一定是正极,则负极是活泼的金属(失电子发生氧化反应)。反应的现象是电极逐渐溶解。以Zn和Cu做电极为例,如果不用盐桥则Zn与CuSO4反应,置换出的Cu附着在Zn表面,阻碍了Zn与CuSO4的接触,不能提供稳定电流。
③根据牺牲阳极的阴极保护法,可知被保护的金属作阴极,即Zn作为阳极。
五、命题趋势
电化学知识的考查可以在一定程度上体现出题人的情感价值观,因为许多学生一看到电化学的相关题型,就有点害怕了,考生在考试时,应该调整好心态,平时把基础知识学好,将电化学的知识点进行归纳,再掌握一些解题技巧,考试时应该沉着冷静分析题型。近年来,随着能源的日趋紧张合理开发,综合利用陆上资源与海水显得尤为重要,而金属矿物和海水资源的开发利用过程主要涉及金属的冶炼和防护,在高考中就可以结合氧化还原反应,电化学知识进行考查的题型就不会只局限在选择题上,而是越来越趋向于与化工流程题相结合的命题类型,考查金属精炼、电解海水、新型电池、电镀等知识点。因此,这是考生应重点复习的一个方向。
参考文献
[1]王秀杰,中学化学开放性试题教学的研究.
[2]韩家勋,素质教育与高考化学命题改革研究.

