利用复合酶制备低聚甘露糖*
史红玲,焦铸锦,唐存多,王瑞,姚伦广,阚云超,邬敏辰
1(南阳师范学院,昆虫生物反应器河南省工程实验室,河南 南阳,473061)
2(江南大学,无锡医学院,江苏无锡,214122)
在过去的20年里,许多类型的低聚糖因有益于人体健康且具有极好的生理活性已受到广泛的关注[1]。其中,低聚半乳糖、低聚果糖、低聚木糖和低聚异麦芽糖等都已被工业化生产[1],而低聚甘露糖受到的关注仍然较少。低聚甘露糖 (Mannooligosaccharide,MOS)是由 2~10个D-甘露糖通过 β-1,4糖苷键聚合而成的低聚糖,又称甘露寡糖[2]。作为食品或者饲料添加剂使用,可有效促进生物体内以双歧杆菌为代表的肠道益生菌群的特异性增殖[3],并具有抑制体内病原菌生长[4],减少有毒代谢产物的生成,防止便秘,保护肝脏,抗肿瘤及增强机体免疫力等多种生理功能,并且具有低热值、低甜度、不引发龋齿[5]、不增加血糖浓度等特点,是新一代的功能性食品[6]。魔芋的主要成分为魔芋葡甘露聚糖(konjak glucomannan,KGM)[7]。魔芋葡甘露聚糖主要由甘露糖和葡萄糖组成,其摩尔比为1.5∶1。已有研究表明,它可以被β-1,4-内切葡聚糖酶和β-甘露聚糖酶水解[8]。我国魔芋资源丰富,目前主要作为一种粗纤维粮食或食品添加剂使用,附加值比较低[9]。将魔芋粉水解得到高附加值的MOS,可获得较大的经济效益[10]。目前,低聚甘露糖的生产方法主要包括从天然原料中提取、化学降解及生物降解[11]。前两种方法的后期处理较为复杂,且借助酸碱水解的化学法成本高且对环境的污染大。生物降解的过程无毒且安全,反应条件温和,能耗低,节约资源且保护环境[12],是生产 MOS 最理想的方法[13]。陶兴无[14]、徐春梅[9]、Kurakake[15]、Albrecht[2]等人都有关于酶法生产低聚甘露糖的研究报道。而酶法生产低聚甘露糖主要受制于所用的关键酶的催化效率较低、酶的生产和使用成本较高,以及底物黏度过大难以实现高浓度的生产[16]。因此,若要实现酶法制备低聚甘露糖的工业化生产,必须在水解KGM的关键酶的研究方面取得突破性进展。
前期的研究中,已经明确了β-甘露聚糖酶和β-1,4-内切葡聚糖酶对魔芋精粉的水解具有显著的协同作用这一现象。此外,我们已获得了催化活性较高、热稳定性好的重组β-甘露聚糖酶reAuMan5AN3C3,同时在之前的研究中也克隆了宇佐美曲霉β-1,4-内切葡聚糖酶基因并在毕赤酵母中实现了异源表达,获得了重组 β-1,4-内切葡聚糖酶 reAuCel12A[17]。本论文在前期的研究基础上,主要研究β-甘露聚糖酶和β-1,4-内切葡聚糖酶协同水解魔芋精粉制备低聚甘露糖的工艺条件。
1 材料与方法
1.1 主要仪器与设备
50 mm×100 mm“海洋”牌硅胶板,青岛海洋化工分厂,用于薄层层析分析;恒温水浴摇床,江苏太仓市实验设备厂;可调微量移液器,Eppendorf公司;DELTA320 pH计,Mettler Toledo公司;AB1104-N电子分析天平,Mettler Toledo公司;722可见光分光光度计,上海菁华科技仪器有限公司;超净工作台,Thermo Forma公司;THZ恒温振荡器,江苏太仓市实验设备厂;TG16-WS台式高速离心机,湖南湘仪实验室仪器开发有限公司。
1.2 主要试剂
重组β-甘露聚糖酶 (reAuMan5AN3C3)和重组β-1,4-内切葡聚糖酶 (reAuCel12A)由本研究室制备;魔芋精粉购自武汉市清江魔芋制品有限公司;展开剂,用丁醇、冰醋酸和水按2∶1∶1的比例配制;显色剂,由0.4 mL苯胺、0.4 g二苯胺和2 mL 85%浓磷酸溶于20 mL丙酮配制而成;β-1,4-D-低聚甘露糖标准品购自上海西宝生物科技有限公司;其他试剂均为国产或进口分析纯。
1.3 魔芋精粉中糖含量的分析
采用改进的DNS法测定样品的β-甘露聚糖酶活性及β-1,4-内切葡聚糖酶活性。取2.4 mL 0.5%角豆胶溶液(pH 3.6)加入0.1 mL适当稀释的β-甘露聚糖酶液,60℃下反应10 min,加入2.5 mL DNS试剂,沸水浴中显色7 min,测定OD540。在上述反应条件下,每分钟产生1 μmol还原糖(以甘露糖计)所需的酶量定义为1个酶活性单位(U)。用类似的方法,以羧甲基纤维素钠(pH 5.0)为底物、葡萄糖为标准品测定β-1,4-内切葡聚糖酶的活性。
1.4 魔芋精粉中糖含量的分析
1.4.1 魔芋精粉中KGM总糖含量的测定
该总糖仅指KGM粗提液被酸完全水解后所有还原糖之和(本论文中所有还原糖均以甘露糖计)。准确称取0.2 g魔芋精粉缓慢加入80 mL去离子水,充分搅拌于35℃溶胀4 h,5 000 r/min离心20 min,上清液即为KGM粗提液,将上清液定容至100 mL。准确吸取4 mL粗提液于25 mL的具塞试管中,加入0.5 mL 6 mol/L的H2SO4,充分混匀,于沸水浴中密闭水解1.5 h后用NaOH中和并定容至10 mL,取上清液1 mL用DNS法测定还原糖的量并计算出魔芋精粉中KGM的总糖含量。魔芋精粉中KGM总糖质量分数的计算公式为:

1.4.2 魔芋精粉游离还原糖含量的测定
准确吸取上述KGM粗提液2.5 mL,用DNS法测定粗提液中还原糖的量并计算出魔芋精粉中游离还原糖的总量。计算公式为:

KGM质量分数的计算公式为:

其中0.9为换算系数。换算系数为KGM中葡萄糖和甘露糖残基分子量与KGM水解生成葡萄糖和甘露糖的分子量之比值。
1.5 水解率及平均聚合度的测定及计算
魔芋精粉水解率是指水解释放出的还原糖与魔芋精粉总糖量的比值。计算公式为:

水解率是反映聚合物水解程度的一个指标,水解率越高表明水解越彻底,当制备魔芋低聚甘露糖时,该数值一般应达到60%以上[16]。
平均聚合度(DP)是魔芋胶总糖量与酶解液还原糖量的比值,它越接近于1说明魔芋胶水解越彻底,工业化生产低聚甘露糖所需的平均聚合度一般应控制在1.8~1.9。
1.6 魔芋精粉复合酶法水解条件的研究
影响魔芋精粉复合酶法水解的因素主要有不同酶的配比、酶解pH、酶解时间、酶解温度和底物浓度[9]。在本研究中首先研究不同比例的β-甘露聚糖酶与β-1,4-内切葡聚糖酶对魔芋精粉水解率的影响,获得最佳的复合酶的配比,然后再对其他4个因素进行单因素实验,单因素实验中除了被研究的因素之外其他3个因素均保持不变,且均将上一研究获得的最佳条件固定用于下一研究。
1.7 魔芋精粉水解产物的定性分析
本研究以“海洋”牌硅胶板为层析载体,采用2∶1∶1的丁醇、冰醋酸和水的混合液作为展层剂,0.4 mL苯胺、0.4 g二苯胺和2 mL 85%浓磷酸溶于20 mL丙酮的混合液为显色剂对魔芋精粉水解产物进行薄层层析定性分析。由于样品中低聚糖的浓度较低,因此每个样品需点5次,展层5 h后,将硅胶板放置在通风橱中,通风30 min,待展层剂完全挥发掉后用喷壶喷洒显色剂,于室温晾20 min,再于105℃烘3~5 min,最后拍照观察。
1.8 复合酶的稳定性实验
将加有保护剂(4%蛋白胨、5%淀粉、0.4%山梨酸钾和10%木糖醇)的复合酶与没有添加保护剂的复合酶同时于室温保藏6个月,期间每1个月测定1次复合酶中各组分的残留酶活,计算酶活残留率:
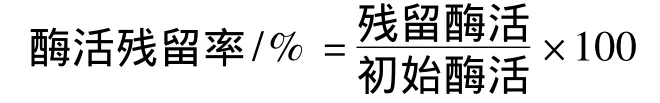
2 结果与讨论
2.1 魔芋精粉中糖含量的测定
按照1.4中所述的方法及公式测定并计算出魔芋精粉中总糖、游离还原糖及魔芋葡甘露聚糖(KGM)的质量分数,8次平行测定的结果如表1所示。
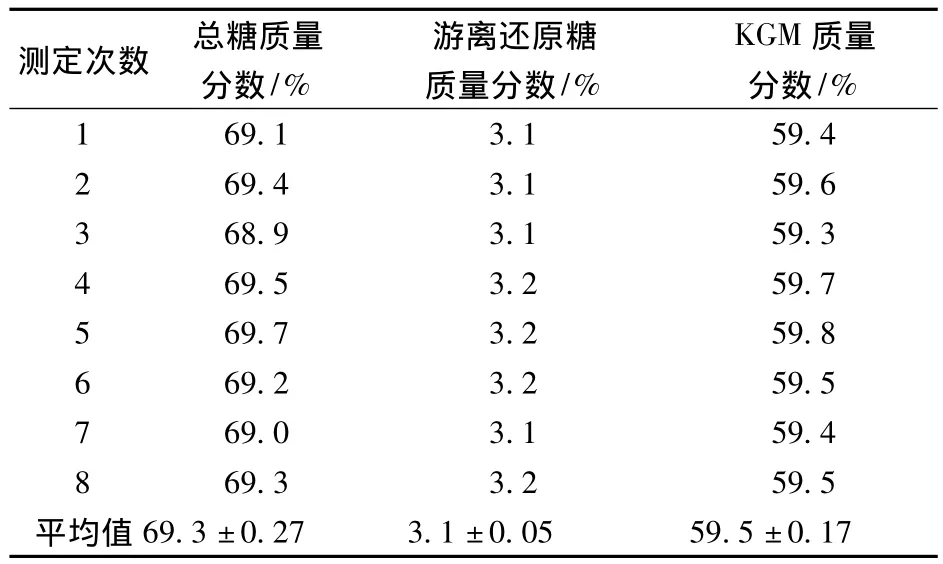
表1 魔芋精粉中总糖、游离还原糖及KGM的质量分数Table 1 The mass fractions of total sugar,free reducing sugar and KGM in konjac powder
由表1可知魔芋精粉中总糖的质量分数为69.3%,游离还原糖的质量分数为3.1%,KGM的质量分数为59.5%,测得的含量略低于徐春梅等人报道的含量[9],这可能与溶胀魔芋精粉所用的缓冲液有关。在本研究中为了减少酸碱的用量,直接使用去离子水溶胀魔芋精粉,而徐春梅等人使用甲酸-氢氧化钠缓冲液进行溶胀,她所使用的缓冲液可能更有利于魔芋精粉中KGM的释出。
2.2 魔芋精粉复合酶法水解的工艺研究
2.2.1 不同配比的复合酶对魔芋精粉水解率的影响
以用去离子水配制的20 g/L魔芋胶溶液为底物,60 U/g魔芋精粉的reAuMan5AN3C3并辅以不同单位酶活性的β-1,4-内切葡聚糖酶在50℃水解4 h,然后用DNS法测定水解产物中还原糖的含量并计算出魔芋精粉的水解率,研究复合酶酶活性的不同配比对魔芋精粉水解率的影响,结果如表2所示。由表2可以看出,β-1,4-内切葡聚糖酶可以明显地促进reAu-Man5AN3C3对魔芋精粉的水解,大大地提高了魔芋精粉的水解率,水解率最高可达52.8%;而且复合酶的水解率明显高于各个单一酶的水解率之和,这也说明两种酶对魔芋精粉的水解具有较好的协同作用。当reAuMan5AN3C3和reAuCel12A的比例达到1∶1.5时,若再增加reAuCel12A的比例,协同作用也已不会再有显著的提高,因此reAuMan5AN3C3和reAuCel12A的比例为1∶1.5为宜。
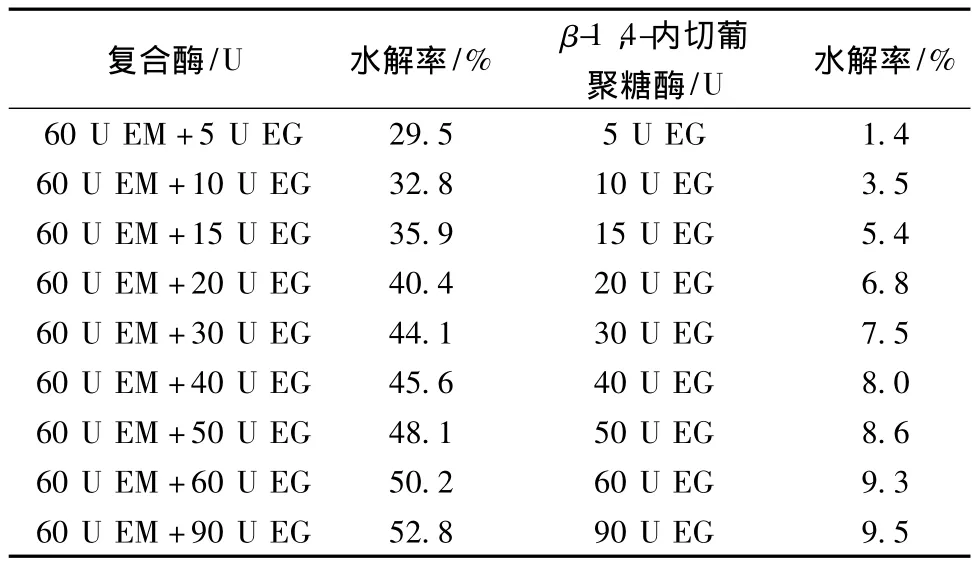
表2 β-1,4-内切葡聚糖酶对魔芋精粉水解率的影响Table 2 The effects of the β-endo-glucanase on the hydrolytic rate of konjak gum
2.2.2 酶解pH值对魔芋精粉水解率的影响
将reAuMan5AN3C3和 reAuCel12A 按1∶1.5的比例添加(前者为60 U/g魔芋精粉),50℃下将用去离子水及不同pH值(2.5~6)缓冲液配制的20 g/L魔芋胶溶液水解4 h,然后用DNS法测定水解产物中还原糖的含量并计算出魔芋精粉的水解率,研究不同pH值对魔芋精粉水解率的影响,结果如图1所示。
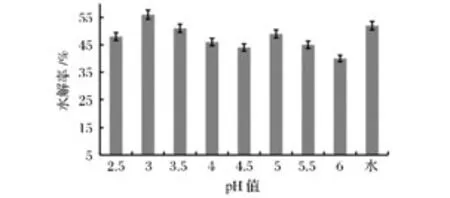
图1 酶解pH值对魔芋精粉水解率的影响Fig.1 Effects of pH values on the hydrolytic rate of konjak gum
结果显示,在测定范围内,酶解pH值对魔芋精粉的水解率影响不明显,在3.0和5.0时分别出现1个峰值,这可能归因于复合酶中1个酶的最适pH值为3.0,另1个的最适pH值为5.0。另外,以去离子水构建反应体系时,魔芋精粉的水解率也较高。考虑到缓冲液会向反应体系带入许多离子,不利于后续产品的精制,且会增加生产成本[9],因此在后续的研究中均采用去离子水溶解魔芋精粉进行低聚甘露糖的酶法制备研究。
2.2.3 酶解时间对魔芋精粉水解率的影响
以去离子水构建反应体系在50℃条件下,用reAuMan5AN3C3和reAuCel12A配比为1∶1.5的复合酶(前者为60 U/g魔芋精粉)将20 g/L的魔芋胶溶液水解不同的时间(1~10 h),然后用DNS法测定水解产物中还原糖的含量并计算出魔芋精粉的水解率,研究不同酶解时间对魔芋精粉水解率的影响,结果如图2所示。由图2所知,随着酶解时间的延长,魔芋精粉的水解率逐渐增加,当酶解时间达到6 h时,水解率的增加趋于平缓,且水解6 h与水解8 h的水解率差异不明显。考虑到较短的生产周期可以提高生产效率及设备的利用率,同时可以降低染菌的风险,故选择酶解6 h进行低聚甘露糖的酶法制备研究为宜。
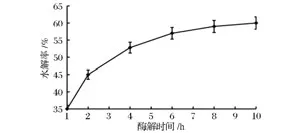
图2 酶解时间对魔芋精粉水解率的影响Fig.2 Effects of the hydrolysis time on the hydrolytic rate of konjak gum
2.2.4 酶解温度对魔芋精粉水解率的影响
以去离子水构建反应体系在不同温度下(20~70℃),用 reAuMan5AN3C3和 reAuCel12A配比为1∶1.5的复合酶(前者为60 U/g魔芋精粉)将20 g/L的魔芋胶溶液水解6 h,然后用DNS法测定水解产物中还原糖的含量并计算出魔芋精粉的水解率,研究不同酶解温度对魔芋精粉水解率的影响,结果如图3所示。结果显示,在常温下魔芋精粉的水解率较低;而当水解温度为60℃时,魔芋精粉的水解率最高可达66.5%;当温度为70℃时,魔芋精粉的水解率有所降低,这些结果与复合酶的热稳定性存在一定的关系。reAuMan5AN3C3所能耐受的温度为 70℃,但 reAu-Cel12A所能耐受的温度仅为50℃,所以水解温度超过60℃后水解率反而下降,故选择60℃的温度进行低聚甘露糖的酶法制备研究为宜。
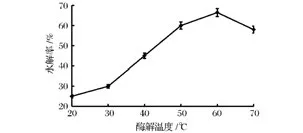
图3 酶解温度对魔芋精粉水解率的影响Fig.3 Effects of the hydrolysis temperature on the hydrolytic rate of konjak gum
2.2.5 底物浓度对魔芋精粉水解率的影响
一般来说,在酶促反应中酶能耐受的底物浓度越高,酶的催化效率就越高,同时所得的产物浓度也会越高,会更利于后续产物的精制。然而受限于魔芋胶本身高粘度的特性,很难获得高浓度的底物,而且过高浓度的底物黏度也过大,也不利于酶与底物的相互作用。本研究中选取用去离子水配制的不同浓度魔芋胶溶液(5~40 g/L)作为研究对象,分别用reAu-Man5AN3C3和reAuCel12A配比为1∶1.5的复合酶(前者为60 U/g魔芋精粉)在60℃下水解6 h,然后用DNS法测定水解产物中还原糖的含量并计算出魔芋精粉的水解率,研究不同底物浓度对魔芋精粉水解率的影响,结果如图4所示。
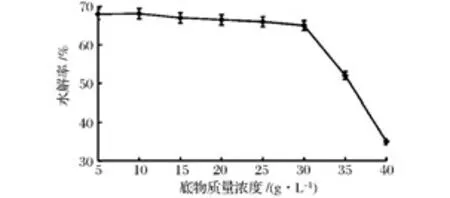
图4 底物浓度对魔芋精粉水解率的影响Fig.4 Effects of the substrate concentration on the hydrolytic rate of konjak gum
结果显示,在底物质量浓度为5~30 g/L时,魔芋精粉的水解率变化不大,基本能维持在66%左右;当底物浓度超过30 g/L时,魔芋精粉的水解率有明显的下降。这主要是在较低的底物浓度范围内时底物的黏度较低,对酶解反应的阻碍作用还不太明显;而随着底物浓度的增大,其黏度也在不断增大,这极大地阻碍了重组酶对底物的充分水解,不利于可溶性还原糖的释放,会明显降低魔芋精粉的水解率。因此,综上所述故选择30 g/L的魔芋胶溶液进行低聚甘露糖的酶法制备研究为宜。
2.2.6 水解产物的定性分析
为了研究魔芋精粉被复合酶水解后各种低聚糖的分布情况,采用1.6中的方法对其水解产物进行薄层层析分析,结果如图5所示。结果显示未被水解的魔芋胶溶液的迁移率较低,几乎都集中在点样处附近;而经复合酶酶水解后的产物主要为二糖以上的寡糖,且主要介于二糖与六糖之间,没有检测到单糖的产生,这与所用的酶均为内切酶有关[18];另外,随着β-1,4-内切葡聚糖酶的加入,水解产物在点样处附近的拖尾现象明显减弱,这也说明加入β-1,4-内切葡聚糖酶后魔芋精粉的水解更加充分,与其水解率的测定结果一致。
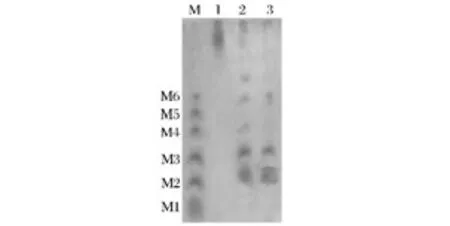
图5 水解产物的薄层层析分析Fig.5 The thin layer chromatography analysis of hydrolysis products from konjak gum
2.2.7 复合酶的稳定性研究
按照1.7中所述的保藏方法,测得添加保护剂的复合酶与没有添加保护剂的复合酶的酶活残留率结果如表3所示。由此可见,在各个时间段内,添加了保护剂的复合酶的酶活残留率均明显高于未添加保护剂的复合酶,且添加了保护剂的复合酶在2个月之内,复合酶的各个酶活性均保持在85%以上。我们可以根据此实验结果确定实际生产中复合酶的保存时间。
3 结论
复合酶酶解魔芋精粉制备低聚甘露糖的工艺条件为:用去离子水配制的30 g/L魔芋胶溶液,reAu-Man5AN3C3和reAuCel12A配比为1∶1.5(前者为60 U/g魔芋精粉),水解温度为60℃,水解时间为6 h,在此条件下魔芋精粉的水解率可达65%,已超过了60%的标准,达到了工业生产的要求。稳定性的研究结果也表明,保护剂对复合酶的稳定性有明显地促进作用。两种酶的协同使用可以显著地提高对方的催化效率,能够大大降低酶的使用成本,本研究为酶法制备低聚甘露的工业化生产奠定了坚实的基础。
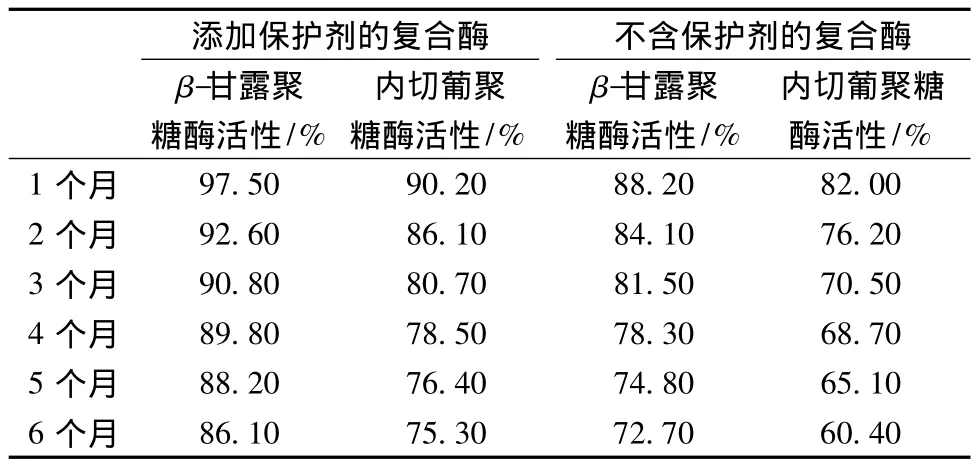
表3 添加保护剂与不添加保护剂复合酶的酶活残留率Table 3 Remained enzyme activity of complex enzyme with stabilizer or not
[1] Mussatto S I,Mancilha I M.Non-digestible oligosaccharides:A review [J].Carbohydrate Polymers,2007,68(3):587-597.
[2] Albrecht S,van Muiswinkel G C,Xu J et al.Enzymatic production and characterization of konjac glucomannan oligosaccharides[J].Journal of Agricultural and Food Chemistry,2011,59(23):12 658-12 666.
[3] Moreira L R,Filho E X.An overview of mannan structure and mannan-degrading enzyme systems[J].Applied Microbiology and Biotechnology,2008,79(2):165-178.
[4] 徐春梅.β-甘露聚糖酶的生产及其酶法制备魔芋葡甘露低聚糖的研究[D].无锡:江南大学,2008.
[5] 丁长河,马康,张洪宾,等.国内几种主要功能性低聚糖生产分析[J].农产品加工(学刊),2014(11):48-52.
[6] Otieno D O,Ahring B K.The potential for oligosaccharide production from the hemicellulose fraction of biomasses through pretreatment processes:xylooligosaccharides(XOS),arabinooligosaccharides(AOS),and mannooligosaccharides(MOS) [J].Carbohydrate Research,2012,360:84-92.
[7] 李剑芳.黑曲霉酸性β-甘露聚糖酶及制备魔芋低聚糖研究[D].无锡:江南大学,2007.
[8] Albrecht S,van Muiswinkel GC,Schols HA et al.Introdu-cing capillary electrophoresis with laser-induced fluorescence detection(CE-LIF)for the characterization of konjac glucomannan oligosaccharides and their in vitro fermentation behavior[J].Journal of Agricultural and Food Chemistry,2009,57(9):3 867-3 876.
[9] 徐春梅,邬敏辰,李剑芳,等.魔芋葡甘露聚糖的酶水解工艺条件[J].食品与生物技术学报,2008(3):120-124.
[10] 倪玉佳,周旻昱,欧阳嘉,等.黑曲霉嗜热β-甘露聚糖酶在毕赤酵母中的克隆表达及其魔芋降解产物分析[J].生物技术通报,2014(6):181-186.
[11] 杨立志,喻春皓,何志敏.功能性低聚糖功效及生产概况[J].天津化工,2001(1):13-15.
[12] 唐存多.β-甘露聚糖酶的基因克隆、分子改造及低聚甘露糖的酶法制备[D].无锡:江南大学,2013.
[13] 许牡丹,柯蕾,曾桥等.黑曲霉β-甘露聚糖酶水解魔芋粉制备甘露低聚糖的研究[J].西北农业学报,2005(6):115-118.
[14] 陶兴无.酸酶结合法水解魔芋葡甘露聚糖工艺研究[J].武汉工业学院学报,2005(3):1-4.
[15] Kurakake M,Sumida T,Masuda D et al.Production of galacto-manno-oligosaccharides from guar gum by β-mannanase from Penicillium oxalicum SO[J].Journal of Agricultural and Food Chemistry,2006,54(20):7 885-7 889.
[16] 李剑芳,邬敏辰,程科等.β-甘露聚糖酶制备魔芋葡甘露低聚糖的研究[J].食品与发酵工业,2007,33(1):21-24.
[17] SHI H,YIN X,WU M et al.Cloning and bioinformatics analysis of an endoglucanase gene(Aucel12A)from Aspergillus usamii and its functional expression in Pichia pastoris[J].Journal of Industrial Microbiology and Biotechnology,2012,39(2):347-357.
[18] Do BC,Dang TT,Berrin JG et al.Cloning,expression in Pichia pastoris,and characterization of a thermostable GH5 mannan endo-1,4-β-mannosidase from Aspergillus niger BK01 [J].Microbial Cell Factories,2009(8):59.

