灰平链霉菌Streptomyces griseoplanus S501产外切菊粉酶的分离纯化及酶学性质研究*
于春,于基成,张春红,刘秋,陈娇
1(沈阳农业大学食品学院,辽宁沈阳,110866)2(大连民族大学生命科学学院,辽宁大连,116600)
菊粉是由多个D-果糖分子通过β-2,1果糖糖苷键连接而成的多聚果糖,末端有1个葡萄糖残基以α-2,1糖苷键与之相连,呈直链结构,聚合度为2~60[1]。菊粉酶又称果聚糖酶(β-2,1-D-果聚糖水解酶),其催化水解菊粉中β-2,1呋喃果糖苷键,酶解产物为低聚果糖和果糖,在工业上有重要的应用价值[2]。直接利用粗酶液来生产低聚果糖或果糖时,常常由于菊粉酶性质不稳定或酶活力较低而影响低聚果糖或果糖产率。此外,菊粉酶粗酶液在使用过程中还常存在易变质和不易保存等问题[3-6]。针对这些问题,研究者通常采用酶的固定化来解决。但是在酶的固定化过程中,由于一些杂蛋白的存在而影响酶的活力和酶的固定化效果[7-8]。因此,研究菊粉酶的分离纯化并获得较高纯度的菊粉酶,对进一步了解其酶学性质和研究其固定化方法具有重要意义。
本实验以从分离自鸭绿江滨海湿地环境中的1株产酶活性高、稳定性好的灰平链霉菌S.griseoplanus S501为研究对象,采用固态发酵法制备菊粉酶粗酶液,结合不同的分离纯化方法获得纯酶组分,并对其酶学性质进行了研究。
1 材料与方法
1.1 材料
菊粉(大连佐源集团公司提供);灰平链霉菌S.griseoplanus S501(CGMCC No.8185)由大连民族大学功能微生物项目组保藏;所用试剂均为分析纯。
1.2 固态发酵培养基
麸皮:833.33 g/L,营养液:KNO30.83 g/L,NaCl 0.42 g/L,MgSO4·7H2O 0.42 g/L,K2HPO4·3H2O 0.42 g/L,FeSO4·7H2O 0.009 g/L,去离子水1 L,pH值自然。
1.3 粗酶液的制备
菌株S501经固态发酵后,按1∶5(g∶mL,以发酵基质干重计)加入去离子水,振荡提取1 h,4℃ 8 000 r/min离心20 min,上清液即为粗酶液。
1.4 菊粉酶活力的测定
[9]方法测定。
1.5 菊粉酶的分离纯化
1.5.1 硫酸铵分级沉淀
将粗酶液置于冰水浴中,在磁力搅拌下,缓缓加入硫酸铵至质量浓度为200 g/L,4℃静置3~5 h,8 000 r/min离心20 min,除杂蛋白。上清液再添加硫酸铵至浓度为900 g/L,4℃ 8 000 r/min离心20 min,沉淀用0.1 mol/L pH5.6的醋酸缓冲液溶解,4℃对去离子水透析,每12 h换透析液1次,共6次。透析后,冷冻干燥即为粗酶。
1.5.2 Sephadex G-75凝胶层析
将1.5.1中制得粗酶采用Sephadex G-75凝胶层析柱(2.0 cm×30.0 cm)分离。上样量2.0 mL,洗脱液为0.02 mol/L pH5.6的醋酸缓冲液,流速0.2 mL/min,监测波长280 nm,每30 min收集1管洗脱液。测定各管收集液活性,将具有酶活性峰洗脱液收集备用。
1.5.3 DEAE-Sepharose CL-6B离子交换色谱
将1.5.2收集到的具有酶活性的收集液采用DEAE-Sepharose CL-6B离子交换色谱柱(2.0 cm×40.0 cm)分离。上样量2.0 mL,采用0.0~0.5 mol/L NaCl和0.02 mol/L pH5.6的醋酸缓冲液进行线性梯度洗脱,流速为1.0 mL/min,监测波长280 nm,每管收集5.0 mL。同时测定其活力,收集具有酶活性峰洗脱液备用。
1.5.4 菊粉酶蛋白纯度和分子量测定
采用SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)测定分离获得酶的纯度和分子量。分离胶和浓缩胶浓度分别为15%和5%。
1.6 菊粉酶酶学性质研究
1.6.1 菊粉酶的最适温度及热稳定性
最适温度测定:以20 g/L菊粉溶液为底物,定量加入酶液,分别在 20、30、40、50、60、70、80 ℃下反应30 min后测定酶活。以最高酶活性组为100%,以相对酶活考察菊粉酶的最适温度。
热稳定性测定:酶液在不同温度下预保温1 h后,迅速冷却到室温后,分别测定残余酶的相对活力,以未经保温处理的酶液活性为100%。计算其相对酶活。

1.6.2 菊粉酶的最适pH值及酸碱稳定性
最适pH值测定:分别以pH 3.8~5.8的0.2 mol/L的醋酸缓冲溶液配制2%的菊粉底物溶液,定量加入酶液,50℃下反应30 min后测定酶活,计算相对酶活。
酸碱稳定性测定:采用不同pH值缓冲溶液定量稀释酶液,4℃放置过夜,测定其残余酶的相对酶活。
1.6.3 底物浓度对菊粉酶活力的影响
用0.2 mol/L pH5.0的醋酸缓冲液分别配制浓度为20、40、60、80 和100 g/L 的菊粉溶液,定量加入酶液,50℃下反应30 min后,测定酶活,计算相对酶活。
1.6.4 金属离子对菊粉酶活力的影响
用0.2 mol/L pH5.0的醋酸缓冲液分别配制5.0 mmol/L 的 Ba2+、Cu2+、Zn2+、K+、I-、Mg2+、Al3+、Ca2+、Li+、Ag+、Fe2+、Fe3+溶液,以 40 g/L 的菊粉溶液为底物,定量加入酶液,50℃下反应30 min后测定酶活,以未加金属离子的底物溶液为空白,考察金属离子对菊粉酶活力的影响。
1.6.5 反应时间对菊粉酶活力的影响
以4%的菊粉溶液为底物,定量加入酶液,50℃下分别反应 5、10、15、20、25 和 30 min 后,测定其的酶活,以酶解产物还原糖含量对反应时间作图。
1.6.6 菊粉酶的动力学常数测定
分别以不同浓度的菊粉溶液为底物,定量加入酶液,50 ℃下,分别反应 5、10、15、20、25 和 30 min,计算底物浓度[s]和反应速度[v],以 1/v对 1/[s]作图,求算以菊粉为底物时菊粉酶的动力学常数Km和最大反应速率vmax。
2 结果与讨论
2.1 菊粉酶的分离纯化
2.1.1 硫酸铵分级沉淀
由表1可以看出,粗酶液经不同饱和度的硫酸铵沉淀后,其上清液相对酶活性差异显著。随着硫酸铵饱和度的增加,上清液相对酶活性逐渐减低,当硫酸铵饱和度达到900 g/L时,上清液残余酶活性为9.43%,说明超过90%的酶通过沉淀被分离;而当硫酸铵饱和度为200 g/L时,其上清液相对酶活性为92.35%,则表明大部分具有活性的菊粉酶仍留在上清液中。因此,菊粉酶粗提纯时先采用饱和度为200 g/L硫酸铵进行沉淀去除杂蛋白后,将上清液中硫酸铵饱和度调至900 g/L,沉淀后可得粗酶。
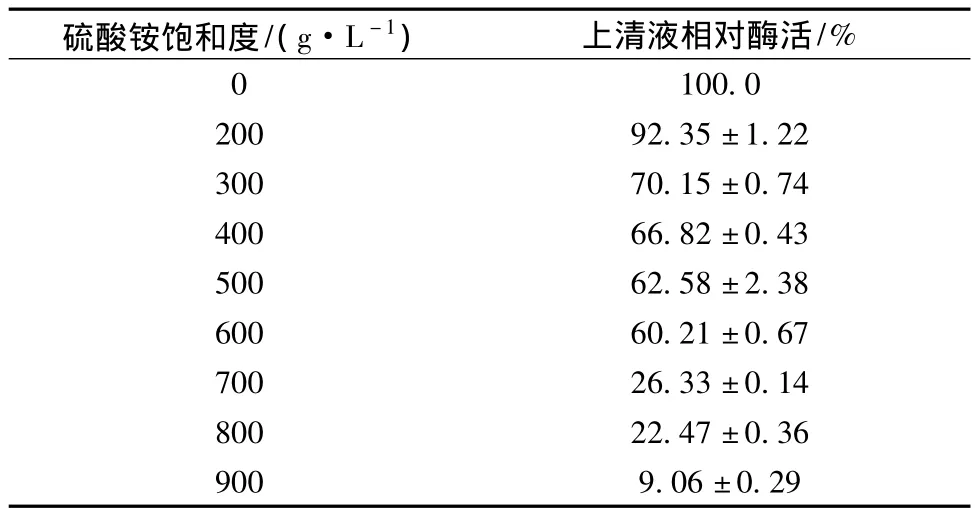
表1 不同浓度硫酸铵沉淀后上清液相对酶活(n=3)Table 1 The relative enzyme activity of supernatant after precipitated by different concentrations of ammonium sulfate(n=3)
2.1.2 Sephadex G-75凝胶层析
由洗脱曲线(图1)可见,硫酸铵分级沉淀分离的粗酶经Sephadex G-75葡聚糖凝胶层析分离后,共获得5个组分。收集各个组分并测定其酶活性发现,其中1号和2号峰具有酶活性,活性分别为57.5 U/mg和254.9 U/mg,合并二者酶液作为下一步离子交换色谱法分离和电泳实验样品。
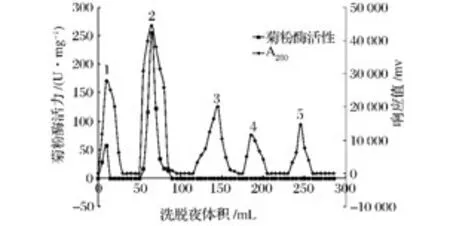
图1 菊粉酶的Sephadex G-75葡聚糖凝胶柱层析图Fig.1 Gel filtration chromatography of inulinase on Sephadex G-75 column
2.1.3 粗酶液的DEAE-Sepharose CL-6B离子交换色谱分离
据文献报道,菊粉酶的等电点一般为4.0~5.0[10-18],因此,选用阴离子交换柱对其进行进一步的纯化。由图2可以看出,经DEAE-Sepharose CL-6B离子交换色谱分离后,共获得3个组分。虽然组分2和组分3并没有完全分离,但经活性测定后发现,这2个组分峰收集液无酶活性。而组分1则具有较强的外切菊粉酶活性,活性达到483 U/mg,因此,收集组分1峰浓缩备用。
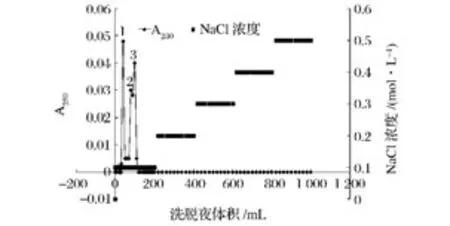
图2 菊粉酶的DEAE-Sepharose CL-6B离子交换色谱层析图Fig.2 Ion exchange chromatography of inulinase on DEAE-Sepharose CL-6B
2.1.4 不同纯化方法获得酶组分的酶活和比酶活测定
菌株S501产外切菊粉酶的分离纯化结果见表2。由表2可知,发酵液经过硫酸铵沉淀、Sephadex G-75凝胶柱、DEAE-Sepharose CL-6B离子柱分离纯化后,比酶活和纯化倍数逐渐增加。3种方法获得酶组分活性和纯化倍数分别为27.48、46.11、249.5 U/mg和 1.15、1.93、10.42。

表2 菌株S501产外切菊粉酶的分离纯化结果(n=3)Table 2 Summary of inulinase purification(n=3)
2.1.5 菊粉酶纯度和分子量测定
采用SDS-PAGE分别测定了粗酶液和硫酸铵分级沉淀法、Sephadex G-75凝胶层析法、DEAE-Sepharose CL-6B离子交换色谱法分离后的粗酶纯度和分子量。由图3可见,未经处理粗酶液约有10个条带,经Sephadex G-75分离获得5条组分带,而经DEAESepharose CL-6B离子交换色谱柱分离后的酶液仅有1条条带,说明采用DEAE-Sepharose CL-6B柱分离后已获得纯度较高的外切菊粉酶。经计算其分子质量约为23.442 kDa。与文献报道比较,该酶的分子质量较小,这可能与不同菌株所产的菊粉酶在分子结构和组成方面存在差异有关;另一方面,SDS-PAGE技术只能粗略估算蛋白分子量。
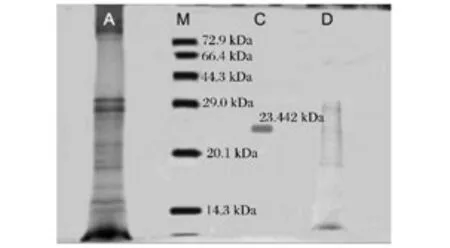
图3 菊粉酶的SDS-PAGE电泳图Fig.3 Electrophoretogram of SDS-PAGE of inulinase
2.2 菊粉酶的酶学性质
2.2.1 菊粉酶的最适温度及热稳定性
温度对酶反应速度的影响非常复杂。温度既影响到酶蛋白的构象,参与酶促反应功能团的解离状态,也影响酶与底物的亲和力,酶-底物络合物的分解;甚至还影响酶与激活剂、抑制剂的亲和力等[19]。
由图4可以看出,随着反应温度的增加,菊粉酶的活性先增加后减小,在50℃时达到最高(464.0 U/mg),说明该菊粉酶的最适温度为50℃。这一结果与张国青等人[20-24]报道结果相符合。而图5结果进一步证明,将菊粉酶在不同温度下预保温1 h,迅速冷却至室温,于50℃下反应30 min后测定其酶活,其酶活力在50℃时达到最高。
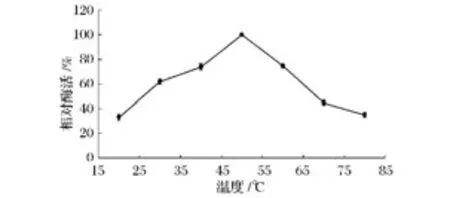
图4 温度对菊粉酶活力的影响Fig.4 Effects of different temperature on inulinase activity
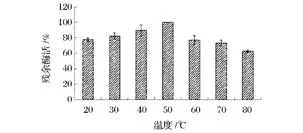
图5 菊粉酶的热稳定性Fig.5 Effects of different temperature on inulinase stability
2.2.2 菊粉酶的最适pH值及酸碱热稳定性
最适pH是酶的一个很重要的特征,对酶的催化反应速率影响很大,主要表现为:(1)通过影响酶的空间结构来影响酶的稳定性;(2)通过影响酶活性中心的催化基团的解离来影响酶与底物的结合;(3)通过影响底物的解离来影响其与酶的结合。酶的最适pH与酶的种类、底物浓度及种类、缓冲液种类等条件有关,它并不是一个常数,会随着反应条件的变化而变化。因此,酶的最适pH只是在某一特定条件下的一个确定的数值。pH的稳定性则是表明酶液在不同pH 下的耐受程度[25-26]。
由图6可以看出,随着体系pH值的增加菊粉酶的活性变化较为显著,在pH5.0时酶活达到最高(448 U/mg)。为了进一步验证这一实验结果,研究中采用不同pH值的0.2 mol/L醋酸缓冲溶液配制同浓度酶液,室温下放置1 h后,测定其残余酶的相对活性。结果发现,该菊粉酶活性仍在pH=5.0时活性最高(图7),因此,说明该菊粉酶的最适pH值为5.0。
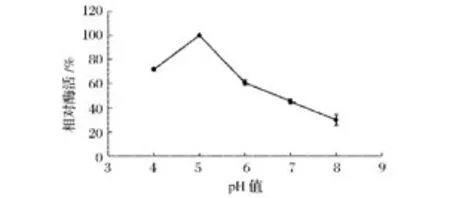
图6 不同pH值对菊粉酶活力的影响Fig.6 Effect ofdifferent pH on inulinase activity
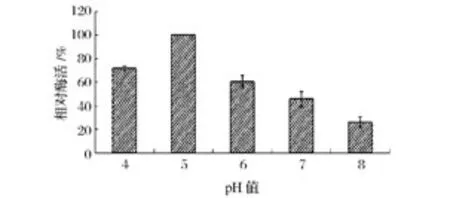
图7 菊粉酶的酸碱稳定性Fig.7 Effects of different pH on inulinase stability
2.2.3 底物浓度对菊粉酶活力的影响
底物浓度对酶促反应具有显著的影响。当底物浓度较低时,提高底物浓度可以提高反应速度;但当底物浓度较高时,底物浓度进一步提高,反应速度的增加变得缓慢甚至不再增加。由图8可以看出,随着底物浓度的增加,菊粉酶活力先增加后趋于平稳,说明当酶浓度一定时,继续增加底物浓度对产物影响不显著。也进一步说明在酶促反应中酶浓度与底物浓度互相影响的关系。因此,研究中将菊粉酶的最适底物浓度设定为40 g/L。
2.2.4 金属离子对菊粉酶活力的影响
金属离子主要影响酶活性中心部位,从而影响酶的反应速率。金属离子对酶活性的影响表现为一为活化或激活作用,一为抑制作用[27]。图9结果表明,Mg2+、I-、Li+、Fe3+、Al3+、K+对该菊粉酶有很强的抑制作用,Cu2+、Ca2+、Ag+对该菊粉酶活性起促进作用,而Fe2+、Ba2+对该菊粉酶活性影响很小。
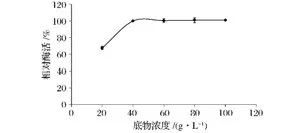
图8 底物(菊粉)浓度对菊粉酶活力的影响Fig.8 Effect of inulin concentration on inulinase stability

图9 金属离子对菊粉酶活力的影响Fig.9 Effect of various metallic ions on inulinase activity
2.2.5 反应时间对菊粉酶活力的影响
由图10可见,菊粉酶在0~30 min反应时间与生成物浓度呈线性关系,此反应速度是恒定的。因此,前30 min内所测的反应速度可以认为是酶的初反应速度。所以,确定测定该酶活性的最适反应时间为30 min。
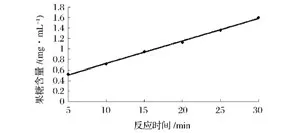
图10 反应时间对菊粉酶活力的影响Fig.10 Effect ofreaction time on inulinase activity
2.2.6 菊粉酶的酶促反应动力学
酶反应动力学是研究酶反应速度规律以及各种因素对酶反应速度影响的科学。研究酶反应动力学规律对于基础研究及生产应用都有十分重要的意义。酶反应动力学关系式,一般用米氏方程来表示。米氏方程中的Km是一个特征常数,它部分地描述了酶反应性质、反应条件对酶反应速度的影响。Km值越大,说明酶与底物的亲和力越小;反之,可认为酶与底物的亲和力越大[28]。根据图11,由拟合直线的斜率和纵截距之比可求得米氏常数(Km),菊粉酶催化底物菊粉的酶促反应的米氏常数Km=3.83 mg/mL,最大反应速度(vmax)为4.64 mg/(mL·min)。
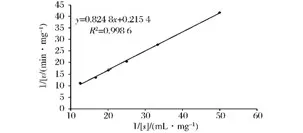
图11 菊粉酶的Lineweave-Burk双倒数曲线Fig.11 Lineweave-Burk double reciprocal curve of inulinase
3 结论
灰平链霉菌S.griseoplanus S501固态发酵液经采用硫酸铵分级沉淀、Sephadex G-7和DEAE-Sepharose CL-6B柱分离,获得单组分菊粉酶,纯化倍数为10.42倍,酶比活性249.5 U/mg蛋白。采用 SDSPAGE测定该菊粉酶组分的相对分子质量为23.442 kDa。酶学性质研究表明,该菊粉酶最适反应温度和pH值分别为50℃和5.0。金属离子Mg2+、I-、Li+、Fe3+、Al3+、K+对该菊粉酶有很强的抑制作用,Cu2+、Ca2+、Ag+对该菊粉酶活性起促进作用。以菊粉为底物时,该菊粉酶的Km为3.83 mg/mL,vmax为4.64 mg/(mL·min),表现为与菊粉底物具有较强的亲和力。
参考文献
[1] Roberfroid M B.Inulin-type fructans:functional food ingredients[J].The Journal of Nutrition,2007,137(11):2 493-2 502.
[2] 倪晓颖,李秉超,林荣峰,等.柱层析法分离纯化菊粉酶的研究[J].沈阳农业大学学报,2010,41(4):484-487.
[3] 闫位娟,陈艳珍.菊粉酶分离纯化方法的研究[J].食品与发酵工业,2006,32(5):42-44.
[4] 周帼萍,沙涛.菊粉酶的研究与应用[J].食品与发酵工业,2001,27(7):54-58.
[5] 王艳,金征宇.酵母菌C10产内切菊粉酶发酵条件的研究[J].生物技术,2001,11(6):25-27.
[6] 王艳,金征宇,徐学明,等.内切菊粉酶产生菌株的筛选及诱变选育[J].生物技术,2001,11(1):26-28.
[7] 陈晓明,朱太海.菊糖的功能及其在食品工业的应用[J].食品科技,2000(5):5-9.
[8] 张连富,李红.内切菊粉酶法生产低聚果糖研究进展[J].中国食品添加剂,2000(1):20-25.
[9] 大连轻工学院,华南理工大学,郑州轻工学院,等.食品分析[M].北京:中国轻工业出版社,2002:173.
[10] Gill P K,Sharma A D,Harchand R K,et al.Effect of media supplements and culture conditions on inulinase production by an actinomycete strain [J].Bioresource Technology,2003,87(3):359-362.
[11] Cazetta M L,Martin P M,Montir,et al.Yaeon(Polymnia sanehifolia)extract as a substrate to produce inulinase by KIuyveromyces marxianus var.bulgaricus[J].Journal of Food Engineering,2005,66(3):301-305.
[12] 陈冠军,孙忠东.黑曲霉菊糖酶的纯化及性质[J].微生物学报,1997,37(5):362-367.
[13] Uzunova K,Vassileva A,Kambourova M,et al.Production and properties of a bacterial thermostable exo-inulinase[J].Z Naturforsch,2001,56c:1 022-1 028.
[14] 贾英民,赵学慧.黑曲霉M89菊粉酶的提纯与性质[J].微生物学报,1998,38(2):120-125.
[15] Moriyama S,Akitmoto H,Suctsugu N,et al.Purification and properties of an exracellular exoinulinase from Penicillium sp.strain TN-88 and sequence analysis of the encoding gene[J].Bioscience,Biotechnology,and Bioehemistry,2002,66(9):1 887-1 896.
[16] Uhm T B,Chung M S,Lee S H,et al.Purification and characterization of Aspergillus ficuum endoinulinase [J].Bioscience,Biotechnology,and Bioehemistry,1999,63(1):146-151.
[17] Ferreira M S S,De Andrade A V M,Kennedy J F.Properties of a thermostable nonspecific fructofuranosidase produced by cladosporium cladosporioides cells for hydrolysis of Jerusalem artichoke extract[J].Applied Biochemistry and Biotechnology,1991,31(1):1-9.
[18] Hamdy,Hossam S.Purification and some important characters of extracellular inulinase of Alternaria alternate(Fr)Keissle[J].Indian Journal of Experimental Biology,2002,40(12):1 393-1 398.
[19] Elena G D,Rui C,Bruno S F,et al.Towards the development of a membrane reactor for enzymatic inulin hydrolysis[J].Journal of Membrane Science,2006,273(1-2):152-158.
[20] Xiao R,Tanida M,Takao S.Purification and some properties of endoinulinase from Chrysosporium pannorum[J].Journal of Fermentation and Bioengineering,1989,67(4):244-248.
[21] 张国青,崔福绵,杨秀清.毛壳霉内切菊粉酶的纯化与性质[J].微生物学报,2004,44(6):785-788.
[22] Nakamura T,Shitara A,Matsuda S,et al.Production,purification and properties of an endoinulinase of Penicillium sp.TN-88 that liberates inulotriose[J].Journal of Fermentation and Bioengineering,1997,84(4):31-318.
[23] Cho Y J,Yun J W.Purification and characterization of an endoinulinase from Xanthomonas oryzae No.5[J].Process Biochemistry,2002,37(11):1 325-1 331.
[24] Kang S I,Chang Y J,Oh S J,et al.Purification and properties of an endo-inulinase from an Arthrobacter sp.[J].Biotechnology Letters,1998,20(10):983-986.
[25] 张菊芬.宇佐美曲霉产菊粉酶及其酶学特性研究[D].镇江:江苏大学,2007.
[26] 徐艳新.菊粉酶产生菌的选育及其酶学性质的初步研究[D].无锡:江南大学,2013.
[27] Singh RS,Sooch B S,Puri M.Optimization of medium and process parameters for the production of inulinase from a newly isolated Kluyveromyces marxianus YS-1[J].Bioresource Technology,2006,98(13):2 518-2525.
[28] 肖厚荣.烟草多酚氧化酶同工酶的分离纯化、表征、酶学性质和应用研究[D].合肥:中国科学技术大学,1999.

