人工液体培养发菜与野生发菜营养成分比较*
郭金英,李彤辉,朱蓓茹,任国艳,崔国庭,李政军,冯惠敏
(河南科技大学食品与生物工程学院,河南 洛阳,471023)
发菜(Nostoc flagelliforme),又称发状念珠藻,属蓝菌门念珠藻目,广泛分布于世界各地的干旱、半干旱地区。发菜营养丰富,富含多糖、氨基酸和Mn、Fe、Ca、Cu、Sr等微量元素[1-2],属于药食两用植物[3],且因其谐音寓意“发财”而备受我国沿海和东南亚地区居民的喜爱[4],为我国出口外汇带来了巨大的经济效益。
野生发菜多贴于荒漠植物下方生长,生长缓慢,采摘时极易破坏地表植被,造成土壤沙漠化,对发菜的掠夺性采收严重破坏了荒漠草场的生态环境。为保护生态环境,我国政府于2000年将发菜列为国家一级野生保护植物,并颁布规定严禁发菜的采集和贸易。因此,将发菜藻体细胞从野生发菜中成功分离并实现人工培养得到了较多的关注。人工液体培养发菜是解决供应矛盾的一个重要发展方向。
近年来,对发菜的人工培养进行了较多的研究,有关研究人员以发菜细胞为培养材料,研究了培养基、温度、营养和光强等条件对发菜细胞生长以及胞外多糖产量的影响,发现发菜细胞在BG-11培养基中有最高生长速率,适合发菜生长[5],而N、P和Ca2+缺乏会显著降低液体培养发菜细胞的生长速率,一定浓度(1~200 mg/L)的La(NO3)3能促进发菜细胞的生长,同时还能够影响部分氨基酸的含量[6]。随着培养温度的增加,发菜细胞胞外多糖产量逐渐下降,不同光强对胞外多糖产量具有显著影响,高光强和低光强下的多糖含量均较高[7-8]。
本实验用优化后的BG-11培养基[5]进行人工液体培养发菜细胞,通过高效液相色谱、ICP-OES等方法分别对人工液体培养发菜细胞与野生发菜中的蛋白质、氨基酸、微量元素和多糖等营养成分进行检测比较。
1 材料与方法
1.1 材料培养和处理
发菜采集于宁夏银川贺兰山东麓,河南科技大学微生物实验室分离、纯化、保存。发菜细胞经活化后,收集细胞接种于优化后新鲜无菌的含外源N的BG-11培养基中,放置在生化培养箱中在25℃和80 μmol/(m2·s)光照强度条件下进行培养,20 d后,4 000 r/min离心10 min,取上清液,备用。其余发菜培养液用4层纱布过滤得到藻体细胞,将发菜细胞放入80℃烘箱中烘干1 h后,多次称量至恒重,在研钵中研磨成粉,过100目筛,得到发菜细胞粉,备用。
野生发菜:甘肃采集。将野生发菜反复清洗后80℃烘干1 h后研磨,继续烘干30 min,多次称量至恒重,得到野生发菜粉,备用。
1.2 试剂
Ca、Mg、Cu、Zn、Fe、Sr、Se(1 000 μg/mL)标准存储溶液国家有色金属及电子材料分析测试中心。
1.3 仪器
1260高效液相色谱,美国安捷伦科技有限公司;MARS6型微波消解仪,美国CEM公司;700系列ICP-OES,美国安捷伦科技有限公司;AFS-9800原子荧光光度计,北京科创海光仪器有限公司;SPX-250型生化培养箱,北京市永明医疗仪器厂;TGL-18C型离心机,上海安亭科学仪器厂;RE-52A型旋转蒸发器,上海亚荣生化仪器厂;722S型可见分光光度计,上海精密科学仪器有限公司;LG-5型真空冷冻干燥机,上海市离心机械研究所;101-0型电热鼓风干燥箱,天津市泰斯特仪器有限公司;Milli-Q超纯水机,美国Millipore公司。
1.4 实验方法
1.4.1 发菜粗多糖含量测定
人工液体培养发菜细胞胞外多糖提取:用超滤浓缩和乙醇沉淀法[9]。
人工液体培养发菜和野生发菜荚膜多糖提取:用热水浸提法[10]。
多糖含量测定:用苯酚-硫酸法。
1.4.2 发菜粗脂肪含量测定
分别取发菜细胞粉、野生发菜粉适量,用索氏抽提法[11]测定其粗脂肪含量。
1.4.3 发菜粗蛋白质含量测定
分别取发菜细胞粉、野生发菜粉适量,用凯氏定氮法[11]测定其粗蛋白质含量。
1.4.4 氨基酸含量测定
样品前处理:分别取2.5 g样品放入安培瓶中,各加6 mol/L HCl 4 mL,加2~3滴重蒸苯酚,用氮气吹扫数秒后迅速用酒精喷灯对安培瓶封口,封口完毕后置于烘箱中110℃恒温消解23 h,消解后去封口,将消解液置于离心管中9 000 r/min离心10 min去沉淀,抽取上清液于50 mL容量瓶,用6 mol/L NaOH调pH值为6~7,用磷酸缓冲液进行定容,0.22 μm微孔膜过滤去杂质。
柱前衍生:吸取5 mL上述样液于10mL容量瓶中,依次加 0.5 mol/L NaHCO32mL,1%2,4-二硝基氟苯乙腈1 mL,混匀置于暗处,60℃水浴衍生6 h,放置室温。
高效液相色谱测定:氨基酸单品标准液浓度为5 mg/mL,混标为200 μg/mL,抽取适量进行高效液相色谱测量,流动相流速为1.0 mL/min,检出波长360 nm,柱温 40℃,进样量10 μL。
1.4.5 Ca、Mg、Cu、Zn、Fe、Sr含量测定
样品处理:分别称取适量样品于消解罐内,加6 mL HNO3和2 mL H2O2,振荡摇匀后加盖密封,放入微波消解仪中进行消解,消解条件见表1,同时做空白对照。消解完全后将消解液移至烧杯中放在电热板上加热驱除过量的HNO3,取下放冷,将消解液移入25 mL具塞管中,用0.5 mol/L的HNO3定容,备用。
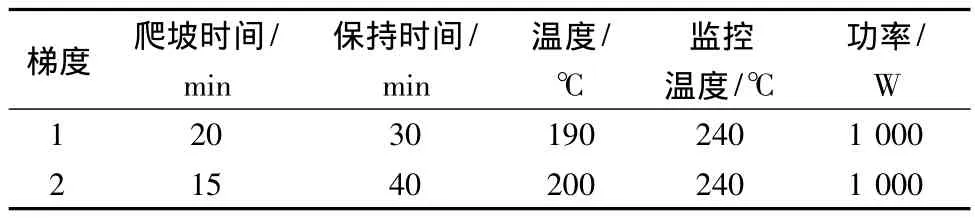
表1 微波消解条件Table 1 The conditions of microwave digestion
标准系列工作液的制备及回归方程、相关系数的获得:用0.5 mol/L的HNO3配制各元素标准工作曲线,配制浓度见表2。以表3的工作条件用ICP-OES测定标准系列工作液的强度值绘制标准工作曲线,得出回归方程和相关系数(见表4)。

表3 725型ICP-OES工作条件Table 3 The working conditions

表4 各元素回归方程及其相关系数Table 4 The regression equation and correlation coefficient of each element
参照 DB53/T 288-2009云南省地方标准ICPAES 法测定样品中 Ca、Mg、Cu、Zn、Fe、Sr的含量。
1.4.6 Se含量测定
样品处理:取适量样品于消解罐中,加6 mL HNO3和2 mL H2O2,振荡摇匀后进行微波消解,消解条件同表1。待消解液冷却后移入烧杯中放在电热板上加热至近干,不能蒸干,再加5 mL HCl,继续加热至溶液变为清亮无色并伴有白烟出现,将六价硒还原为四价硒。冷却后移至25 mL具塞管中定容,摇匀备用。吸取5 mL消化液于10 mL离心管中,加 1 mL HCl,0.5 mL 100 g/L 的 K3Fe(CN)6,混匀待测。
标准曲线的制备:用0.5 mol/L HNO3配制Se元素标准工作曲线,配制浓度依次为 0、1、2、4、8、10 ng/mL,用原子荧光光度计测定Se系列标准溶液,得到硒的标准曲线为:y=107.665x+67.105,R2=0.999 7。参照国标GB 5009.93-2010氰化物原子荧光光谱法测定样品中Se的含量。
1.4.7 营养价值评价方法
根据FAO/WHO建议的氨基酸评分标准模式和全鸡蛋蛋白质的氨基酸模式[12],分别按以下公式计算氨酸酸评分(AAS)、化学评分(CS)和必需氨基酸指数(EAAI)。
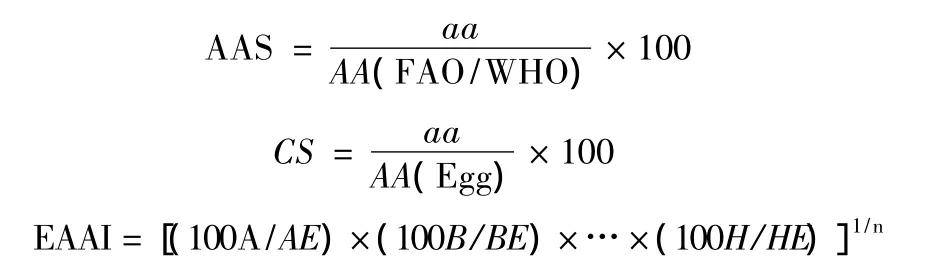
式中:aa为样品氨基酸含量,mg/g;AA(FAO/WHO)为FAO/WHO评分标准模式中同种氨基酸含量,mg/g;AA(Egg)为全鸡蛋蛋白质中同种氨基酸含量,mg/g;n为比较的必需氨基酸数目,本文n=7;A、B…H为样品蛋白质中必需氨基酸含量,mg/g;AE、BE…HE为全鸡蛋蛋白质中相对应的必需氨基酸含量,mg/g。
2 结果与讨论
2.1 人工培养发菜与野生发菜中粗多糖、脂肪、蛋白质含量
人工培养发菜与野生发菜中粗多糖、脂肪、蛋白质含量见表5。由表5可知,人工培养发菜中的胞外多糖达到36.95 mg/L,荚膜多糖为15.03 mg/kg,而野生发菜中的荚膜多糖为13.84 mg/kg。野生发菜具有特殊的生长特性[13],一方面,它在干旱时期休眠状态积累干物质,另一方面它在湿润条件下复吸水进行生长繁殖,而人工培养能根据细胞的生长状况调整培养条件,使其一直处于稳定状态,使得人工培养发菜能分泌较多的胞外多糖,荚膜多糖含量也有所增加。人工液体培养发菜中蛋白质含量为26.17 g/100 g,野生发菜蛋白质含量为23.05 g/100g,两者的脂肪含量都较少,分别为0.23 g/100 g和0.31 g/100 g。
表5 人工液体培养与野生发菜中粗多糖、脂肪、蛋白质含量(± S,n=3)Table 5 Crude polysaccharide,fat and protein contents of cultured and wild Nostoc flagelliforme(± S,n=3)

表5 人工液体培养与野生发菜中粗多糖、脂肪、蛋白质含量(± S,n=3)Table 5 Crude polysaccharide,fat and protein contents of cultured and wild Nostoc flagelliforme(± S,n=3)
胞外多糖/(mg·L-1)荚膜多糖/(mg·kg-1)脂肪/[g·(100g)-1]蛋白质/[g·(100g)-1]人工液体培养发菜 36.95±0.19 15.03±0.05 0.23±0.004 26.17±1.31野生发菜- 13.84±0.11 0.31±0.002 23.05±0.94
2.2 人工液体培养发菜与野生发菜中氨基酸含量
由表6可以看出,人工液体培养发菜与野生发菜总氨基酸含量分别为21.99 mg/g和21.20 mg/g,但人工培养发菜的必需氨基酸含量为11.73 mg/g,高于野生发菜,是野生发菜的1.47倍。两者的EAA/TAA分别为53.34%、37.60%,符合FAO/WHO推荐的质量较好的蛋白质氨基酸组成在40%左右的要求,其中EAA/NEAA为1.14和0.60,也符合理想蛋白质模式[14]。两者的必需氨基酸中苯丙氨酸的含量最高,对改善记忆力提高思维敏捷度有明显功效。呈味氨基酸天冬氨酸、谷氨酸、甘氨酸、丙氨酸在野生发菜中的含量略高于人工液体培养发菜,占总氨基酸量的28.40%,丰富的呈味氨基酸是构成发菜特有风味的重要原因。野生发菜中脯氨酸的含量是人工液体培养发菜的15.88倍,分析在野生条件下,环境温度较高,土壤盐碱性较大,脯氨酸含量的增加能提高发菜的耐盐性[15]。
表6 人工液体培养与野生发菜中氨基酸含量(±S,n=3) 单位:mg/kgTable 6 Amino acid contents of cultured and wild Nostoc flagelliforme(± S,n=3)
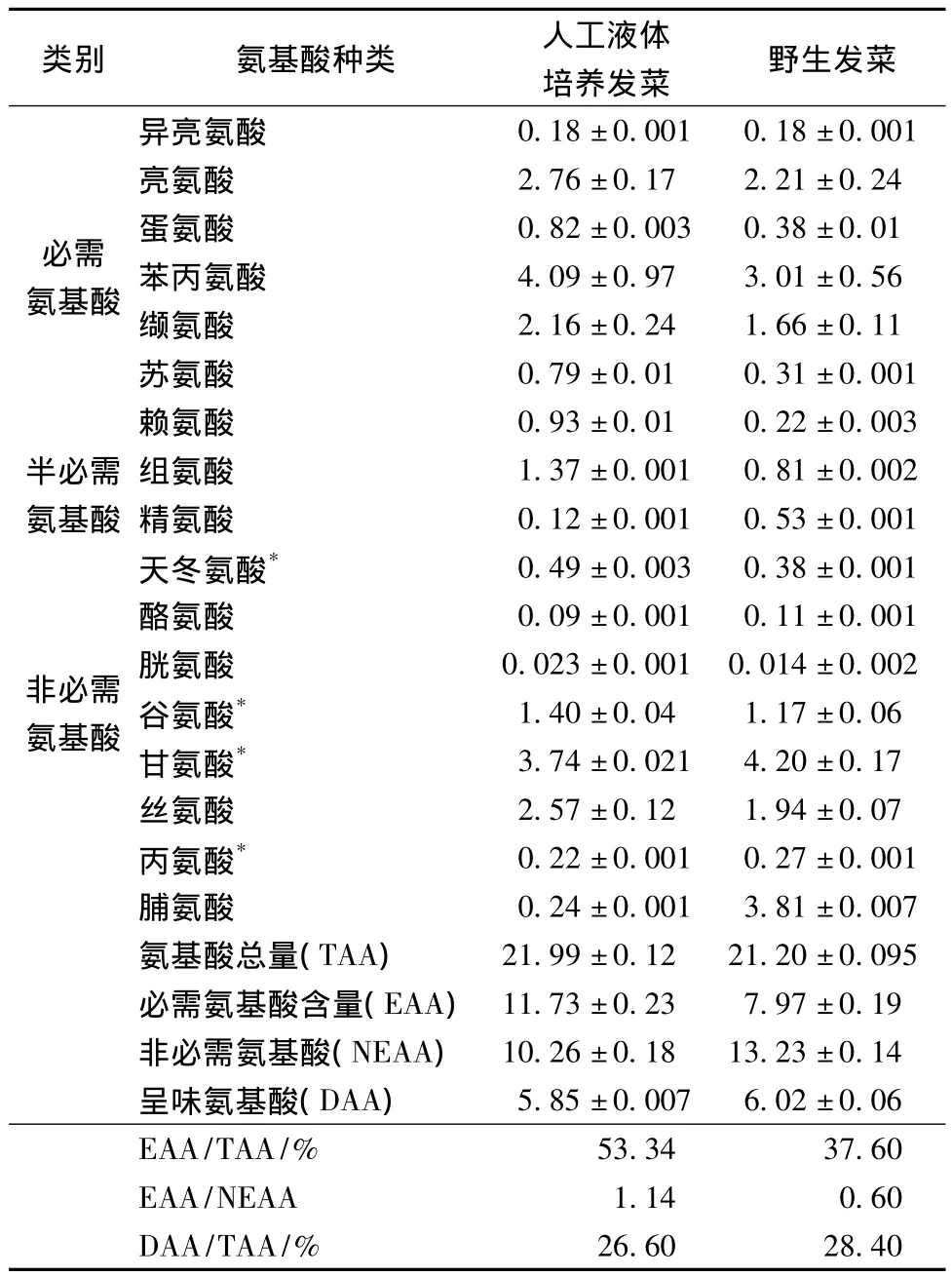
表6 人工液体培养与野生发菜中氨基酸含量(±S,n=3) 单位:mg/kgTable 6 Amino acid contents of cultured and wild Nostoc flagelliforme(± S,n=3)
注*:呈味氨基酸。
类别 氨基酸种类 人工液体培养发菜 野生发菜异亮氨酸0.18±0.001 0.18±0.001亮氨酸 2.76±0.17 2.21±0.24必需 蛋氨酸 0.82±0.003 0.38±0.01氨基酸 苯丙氨酸 4.09±0.97 3.01±0.56缬氨酸 2.16±0.24 1.66±0.11苏氨酸 0.79±0.01 0.31±0.001赖氨酸 0.93±0.01 0.22±0.003半必需 组氨酸 1.37±0.001 0.81±0.002氨基酸 精氨酸 0.12±0.001 0.53±0.001天冬氨酸* 0.49±0.003 0.38±0.001酪氨酸 0.09±0.001 0.11±0.001非必需 胱氨酸 0.023±0.001 0.014±0.002氨基酸 谷氨酸* 1.40±0.04 1.17±0.06甘氨酸* 3.74±0.021 4.20±0.17丝氨酸 2.57±0.12 1.94±0.07丙氨酸* 0.22±0.001 0.27±0.001脯氨酸 0.24±0.001 3.81±0.007氨基酸总量(TAA) 21.99±0.12 21.20±0.095必需氨基酸含量(EAA)11.73±0.23 7.97±0.19非必需氨基酸(NEAA) 10.26±0.18 13.23±0.14呈味氨基酸(DAA) 5.85±0.007 6.02±0.06 EAA/TAA/% 53.34 37.60 EAA/NEAA 1.14 0.60 DAA/TAA/% 26.60 28.40
AAS和CS从不同角度反映了蛋白质构成和利用率的关系,而EAAI反映了蛋白源的必需氨基酸组成与标准蛋白必需氨基酸组成的拟合程度,是评价蛋白质营养价值的常用指标[16]。由表7中氨基酸评分结果(AAS)和化学评分(CS)可知,人工液体培养发菜的第一限制性氨基酸为异亮氨酸,第二限制性氨基酸为赖氨酸,而野生发菜的第一限制性氨基酸为赖氨酸,第二限制性氨基酸为异亮氨酸。
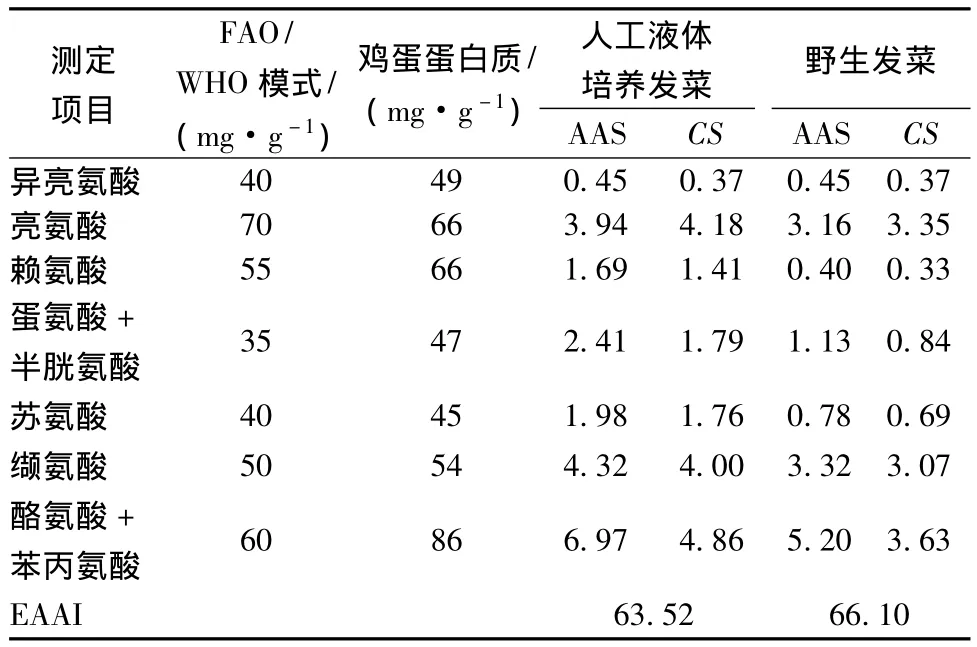
表7 人工液体培养与野生发菜中必需氨基酸组成的评价Table 7 Evaluation of essential amino acid contents of cultured and wild Nostoc flagelliforme
2.3 人工液体培养发菜与野生发菜中Ca、Mg、Cu、Zn、Fe、Sr、Se 含量
藻类的细胞壁带有一定的负电荷,细胞膜具有高度选择性的半透膜,能富集一些金属离子[17],而其细胞壁表面存在的多糖、蛋白质、脂肪等物质增强了它的金属结合能力[18],使得藻类含有较丰富的矿物质元素。表8为野生发菜和人工液体培养发菜中的微量元素含量。表8中显示,发菜中含有丰富的Ca、Mg、Fe、Zn、Sr,两者Fe的含量相差不大,人工液体培养发菜中Mg、Cu、Zn、Se 的含量分别是野生发菜的2.9、3.4、3.8、1.6倍,而Ca和Sr的含量则少于野生发菜,Ca具有保护细胞膜、调控细胞内酶活动和细胞膜渗透的作用,Ca元素对增强植物碳水化合物含量,提高植株抗性等方面起着重要的作用[19]。野生发菜生长在环境恶劣、土壤贫瘠的地方,钙的积累更有利于其生长,Sr和Se的含量与其生长环境及土壤富集有关系。
表8 人工液体培养和野生发菜中元素含量(±S,n=3) 单位:mg/kgTable 8 Element contents of cultured and wild Nostoc flagelliforme(± S,n=3)
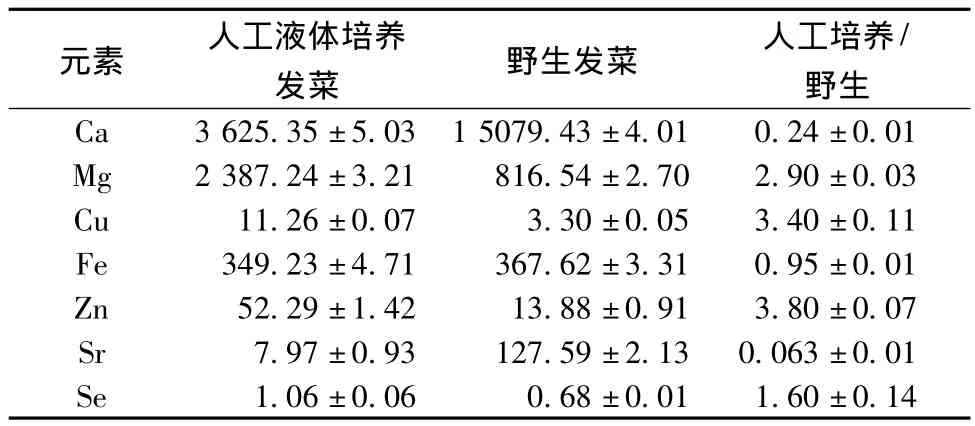
表8 人工液体培养和野生发菜中元素含量(±S,n=3) 单位:mg/kgTable 8 Element contents of cultured and wild Nostoc flagelliforme(± S,n=3)
元素 人工液体培养发菜 野生发菜 人工培养/野生Ca 3 625.35±5.03 1 5079.43±4.01 0.24±0.01 Mg 2 387.24±3.21 816.54±2.70 2.90±0.03 Cu 11.26±0.07 3.30±0.05 3.40±0.11 Fe 349.23±4.71 367.62±3.31 0.95±0.01 Zn 52.29±1.42 13.88±0.91 3.80±0.07 Sr 7.97±0.93 127.59±2.13 0.063±0.01 Se 1.06±0.06 0.68±0.01 1.60±0.14
3 结论
本文分析研究了野生发菜和人工液体培养发菜细胞的蛋白质、多糖、氨基酸及微量元素的含量,结果表明,人工液体培养发菜的荚膜多糖、粗蛋白、脂肪含量与野生发菜差别较少,两者都含有较高比例的蛋白质,较低比例的脂肪,是一种高蛋白低脂肪的藻类食品;氨基酸种类丰富,含量高,人工培养和野生发菜中的呈味氨基酸/总氨基酸分别为26.60%和28.40%,构成发菜的特有风味,必需氨基酸/总氨基酸分别为37.60%和53.34%,趋近于或高于40%的普通蛋白质正常比例,营养价值符合FAO/WHO推荐的蛋白质氨基酸要求;人工培养发菜和野生发菜中各微量元素的含量略有不同,但均富含人体所需的 Ca、Mg、Cu、Fe、Zn、Sr、Se 等人体必需矿物元素。人工液体培养发菜营养均衡,营养价值高,符合人类营养需求,具有广阔的发展前景。
[1] Gao Kun-shan.Chinese studies on the edible blue-green al-ga,Nostoc flagelliforme:a review [J].Journal of Applied Phycology,1998,10(1):37-49.
[2] Lim J,Li A,Yat Y W,et al.Discriminating authentic Nostoc flagelliforme from its counterfeits by applying alternative ED-XRF and FTIR techniques[J].Food Chemistry,2011,129(2):528-532.
[3] GAO Xiang,YANG Yi-wen,AI Yu-feng,et al.Quality evaluation of the edible blue-green alga Nostoc flagelliforme using a chlorophyll fluorescence parameter and several biochemical markers[J].Food Chemistry,2014,143:307-312.
[4] YU Hai-feng,JIA Shi-ru,DAI Yu-jie.Accumulation of exopolysaccharides in liquid suspension culture of Nostoc flagelliforme cells [J].Appl Biochem Biotechnol,2010,160(2):552-560.
[5] 梁文裕,赵辉,谢亚军,等.几种发菜培养体系的筛选[J].农业科学研究,2005,26(3):33-35,38.
[6] 刘世名,梁世中.镧对发状念珠蓝细菌细胞培养及氨基酸成分的影响[J].中国稀土学报,1999,17(1):60-64.
[7] YE C P,ZHANG M C,YANG Y F,et al.Photosynthetic performance in aquatic and terrestrial colonies of Nostoc flagelliforme(Cyanophyceae)under aquatic and aerial conditions[J].Journal of Arid Environments,2012,85:56-61.
[8] HAN Pei-pei,SUN Ying,JIA Shi-ru,et al.Effects of light wavelengths on extracellular and capsular polysaccharide production by Nostoc flagelliforme[J].Carbohydrate Polymers,2014,105:145-151.
[9] 侯茂霞,戴玉杰,符宏磊,等.人工悬浮培养发菜胞外多糖对小鼠免疫功能的影响[J].天津科技大学学报,2014,29(4):16-20.
[10] 林永贤,于海峰,许鹏,等.发菜多糖的提取及性质研究[J].现代食品科技,2007,23(6):34-36,49.
[11] 周艳明.现代饲料分析与检验技术[M].沈阳:辽宁科学技术出版社,1994:38-44.
[12] 王红梅.营养与食品卫生学[M].上海:上海交通大学出版社,2000:8-10.
[13] ZHAO Xue-min,BIYong-hong,CHEN Lin,et al.Responses of photosynthetic activity in the drought-tolerant cyanobacterium,Nostoc flagelliforme to rehydration at different temperature[J].Journal of Arid Environments,2008,72(4):370-377.
[14] 何清,胡晓波,周峙苗,等.东海绿藻缘管浒苔营养成分分析及评价[J].海洋科学,2006,30(1):34-38.
[15] 梅俊学.逆温下发莱脯氨酸含量及质膜透性的变化与含水量的关系[J].山东师大学报:自然科学版,2000,15(2):178-181.
[16] 陈道海,文菁,赵玉燕,等.野生与人工养殖的虎斑乌贼肌肉营养成分比较[J].食品科学,2014,35(7):217-222.
[17] 林建云,陈维芬,贺青,等.福建沿岸海域浒苔藻类的营养成分含量与食用安全[J].台湾海峡,2011,30(4):570-576.
[18] Bulgariu D,Bulgariu L.Equilibrium and kinetics studies of heavy metal ions biosorption on green algae waste biomass[J].Bioresource Technology,2012,103(1):489-493.
[19] QIU Y J,XI J,DU L Q,et al.Coupling calcium/calmodulin-mediated signaling and herbivore-induced plant response through calmodulin-binding trascription factor AtSR1/CAMTA3[J].Plant Molecular Biology,2012,79(1/2):89-99.

