GSK-3β在胃癌中的表达及其与5-氟尿嘧啶、顺铂药物敏感性之间的关系
刘 洋,梁建芳,郑绘霞(山西医科大学基础医学院病理学教研室,太原 03000;山西医科大学第一临床医学院病理科;通讯作者,E-mail:huixiazheng6@63.com)
胃癌(gastric carcinoma,GC)是消化系统常见的恶性肿瘤,在我国其发病率呈逐年上升的趋势。辅助化疗是胃癌综合治疗的重要组成部分,但在临床实践中由于肿瘤患者个体差异的存在,以及获得性耐药的产生,导致其临床疗效不甚理想,如何客观地选择有效的药物进行个体化治疗是亟待解决的问题。糖原合成酶激酶-3β(GSK-3β)是一种多功能的丝氨酸/苏氨酸蛋白激酶,除参与糖代谢外,还与细胞生长、增殖和凋亡等多种生理过程密切相关[1]。此外,GSK-3β 在多种肿瘤中异常表达[2-4],并且与化疗药物的耐药性有关[5]。本研究对50例胃癌新鲜组织中GSK-3β的表达进行检测,并分析了不同药物敏感/耐药与GSK-3β表达的关系,现将研究结果报道如下。
1 资料与方法
1.1 一般资料
收集山西医科大学第一医院普外科2014-02~2014-11住院手术治疗胃癌新鲜标本50例及癌旁组织(距肿瘤组织大于5 cm),一部分用于细胞原代培养,一部分立即冻存于低温冰箱用于Western-blot实验。所有患者术前未经放化疗,术后经病理诊断为胃腺癌。50例患者中,男性34例,女性16例;年龄42-73 岁,平均年龄(55.6 ±11.3)岁。
1.2 主要试剂、药品及仪器
噻唑蓝MTT、二甲基亚砜DMSO(美国Sigma);1640培养基(美国GIBCO);胎牛血清、双抗液(美国Hyclone);5-氟尿嘧啶、顺铂(齐鲁制药有限公司);二氧化碳细胞培养箱(美国Thermo Fisher);酶标仪(日本BIO-RAD);电泳仪(北京六一);转膜仪、凝胶成像仪(上海Tannon);GSK-3β一抗(美国Santa Cruz),GAPDH一抗(武汉博士德生物公司)。
1.3 胃癌细胞原代培养
取手术切除的新鲜胃癌标本,剔除周围坏死糟碎组织后称取1 g。双抗液反复冲洗数次后将肿瘤组织剪碎至直径1 mm3大小碎块,尽量至稀糊状,加入5 ml消化酶,37℃孵育1 h,震荡混匀并通过200目滤网,收集滤液,1 000 r/min离心10 min,弃去上清。台盼蓝计数,调整细胞浓度至1×105/ml,接种于96孔板中,用含10%血清的1640培养基于37℃,5%CO2饱和湿度培养箱中培养。
1.4 MTT 实验检测
细胞生长至指数增长期进行MTT药敏实验,5-氟尿嘧啶、顺铂药物终浓度为血药峰值浓度(5-FU 35.0 μg/ml,DDP 4.6 μg/ml),每组设 6 个平行孔,另设调零组(无细胞,加200 μl培养基)及对照组(不予任何药物干预)。培养48 h后,每孔加入MTT液20 μl(浓度5%),继续培养4 h后,吸去上清,每孔加150 μl DMSO,室温轻摇5 min,立即置于酶标仪测定490 nm波长下吸光度值(A)。计算细胞生长抑制率(IR),IR(%)=1-试验孔A均值/对照孔 A均值 ×100%。按照实体瘤体外敏感标准[6],抑制率>30%定为敏感,<30%定为耐药。
1.5 Western blot检测
电子天平称取0.2 g肿瘤新鲜组织及癌旁组织,置于EP管中尽量剪碎,加入组织裂解液提取蛋白。常规提取蛋白,分光光度计检测OD值,标准曲线法计算蛋白含量。常规制备8%SDS-PAGE凝胶,蛋白电泳(100 V,50 min)。湿转法转移至硝酸纤维素膜(100 V,40 min),蛋白干粉封闭,滴加一抗(GSK-3β 浓度1∶600,GAPDH 浓度 1∶1 000)4 ℃冰箱孵育过夜,二抗(浓度1∶3000)室温孵育1 h,ECL法成像,Tannon成像仪摄片。对显影条带进行灰度分析,计算目的蛋白的相对表达量。
1.6 统计学分析
2 结果
2.1 GSK-3β在胃癌及癌旁组织中的表达
与癌旁正常组织(0.868 0 ±0.079 1)相比,GSK-3β在胃癌组织中的表达明显降低(0.4286±0.0929),差异有统计学意义(t=7.199,P=0.000,见图 1)。在胃癌组织中GSK-3β的表达与患者的年龄、分化程度、TNM分期和淋巴结转移有关(P<0.05),与患者性别无关(P >0.05,见表1)。
2.2 胃癌对5-氟尿嘧啶、顺铂的体外药物敏感性检测及其与GSK-3β蛋白表达的关系
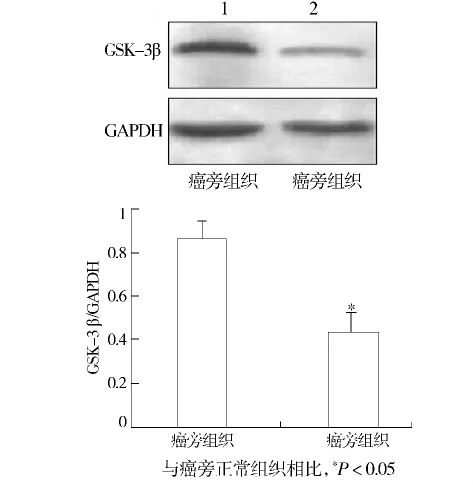
图1 GSK-3β在胃癌及癌旁组织中的表达Figure 1 Expression of GSK-3β in gastric carcinoma and paracancerous specimens by Western blot
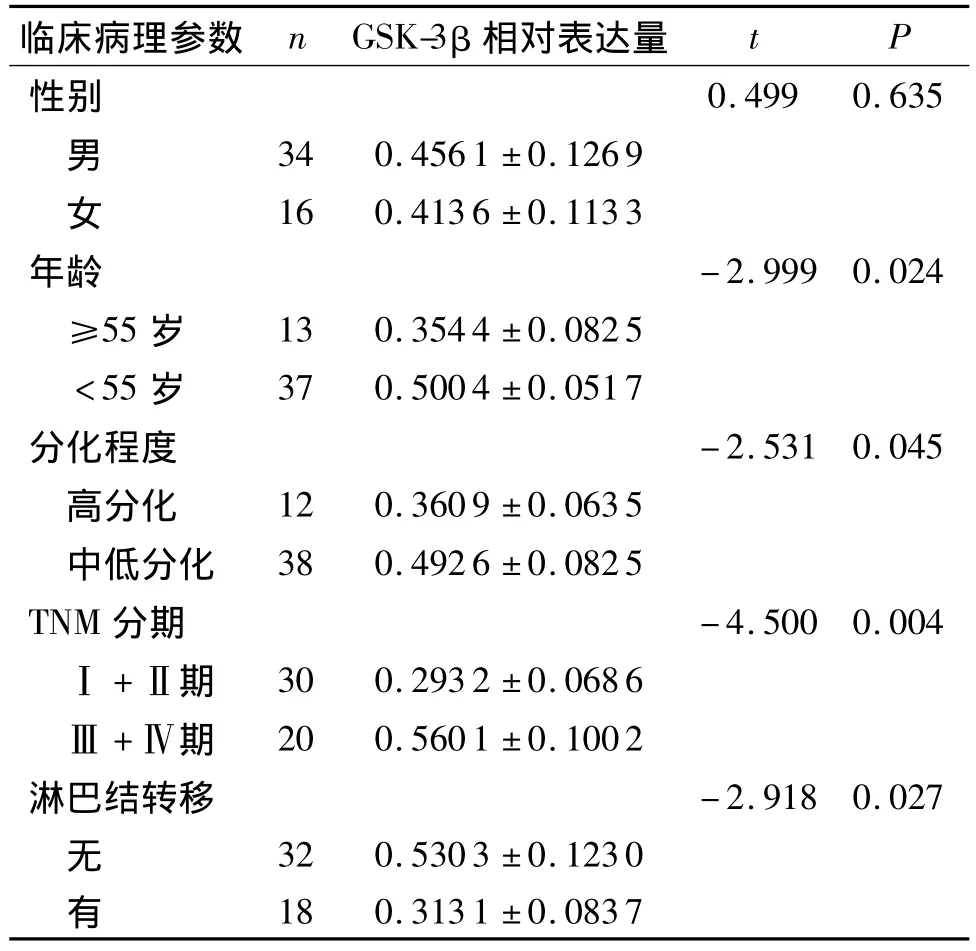
表1 GSK-3β蛋白的表达与临床病理参数之间的关系Table 1 Correlation between GSK-3β protein expression and clinicopathological featuress
50例胃癌标本最终39例成功进行了原代培养及药物敏感性测定,可评价率为78.0%。按照不同药物的体外抑制率进行评价,最终39例胃癌患者对5-FU敏感者14例,耐药者25例,对DDP敏感者10例,耐药者29例,见表2。39例成功进行药敏检测的胃癌病例中,对DDP及5-FU耐药组织GSK-3β蛋白的表达量低于敏感组织,差异有统计学意义(P <0.05,见图 2,表3)。

表2 胃癌患者对5-FU、DDP体外敏感及耐药情况 (例)Table 2 Sensitivity and drug-resistance of 5-FU and DDP to gastric carcinoma (cases)
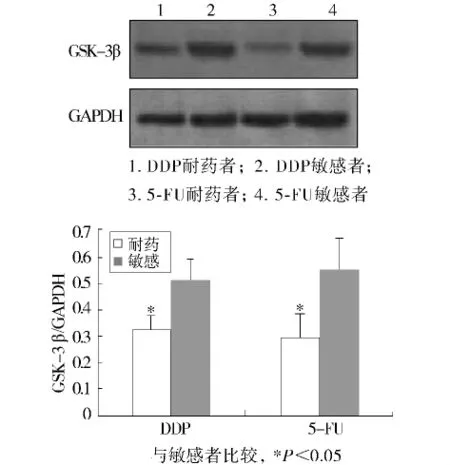
图2 GSK-3β蛋白的表达与DDP及5-FU药物敏感性的关系Figure 2 Correlation between GSK-3β protein expression and sensitivity and drug-resistance of 5-FU and DDP to gastric carcinoma
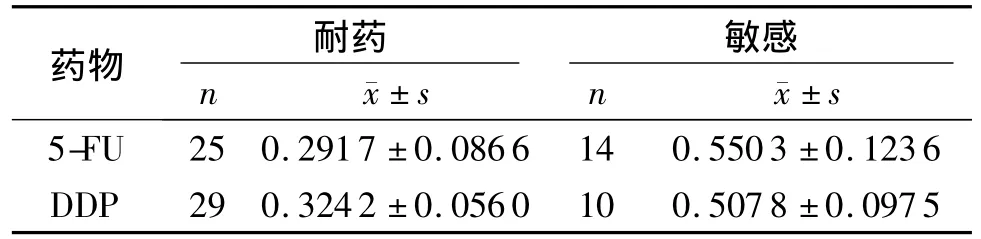
表3 GSK-3β蛋白的表达与药敏实验的关系Table 3 Correlation between GSK-3β protein expression and sensitivity and drug-resistance of 5-FU and DDP to gastric carcinoma
3 讨论
GSK-3β结构特殊,功能广泛,其表达异常或者活性改变可影响多种病理生理过程。在肿瘤中的研究表明,GSK-3β 主要通过参与 Wnt/β-catenin,PI3K/Akt等信号通路发挥作用,通过磷酸化/去磷酸化进行活性调节。由于GSK-3β信号转导极为复杂,受细胞类型和内环境等因素影响,因此在肿瘤中具有双向调节作用,例如,GSK-3β既可以通过调节p53基因水平促进细胞凋亡、抑制细胞生长,也可通过维持 NF-κB水平抑制细胞凋亡、促进细胞生长[7]。现有的报道显示,在不同的肿瘤中 GSK-3β的表达功能不一,例如在卵巢癌中GSK-3β的活化促进细胞增殖[8],而在乳腺癌中GSK-3β的活化抑制细胞增殖[9]。目前GSK-3β在胃癌中的相关研究报道较少。
本研究首先对胃癌组织及癌旁正常组织进行了定量分析,结果表明,癌组织中GSK-3β蛋白的表达水平较癌旁正常组织明显下调,说明GSK-3β低表达可能促进了胃癌细胞的增殖,与胃癌的发生密切相关。在50例胃癌中,GSK-3β的表达与患者的性别无显著关系,而在分化程度低、TNM分期高以及淋巴结发生转移的癌组织GSK-3β表达更低,提示GSK-3β可能与胃癌的恶性程度及预后相关,这与杜维等学者的免疫组化结果相一致[10]。就可能的机制而言,Zheng等认为GSK-3β在胃癌组织中的低表达促进 APC/Axin/GSK-3β/β-catenin复合物的解聚,从而导致β-catenin在核内的积聚与活化,参与胃癌的发生和浸润转移[11]。Thiel等的研究则表明,GSK-3β活性下降可导致环氧合酶2(COX-2)活性升高,从而促进胃癌的发生发展[12]。此外,本研究小于55岁的患者癌组织中GSK-3β的表达水平高于55岁以上患者,我们认为可能与年龄的增长引起的机体物质代谢功能下降有关。
除了对肿瘤细胞进行调节之外,GSK-3β还可能参与了化疗药物的耐药过程。在顺铂耐药肺腺癌A549/DDP细胞中,磷酸化GSK-3β水平显著升高,提示GSK-3β活性受到抑制可能是非小细胞肺癌顺铂耐药的原因[13]。结肠癌中,GSK-3β通过细胞质/核迁移的方式参与并促进了5-氟尿嘧啶诱导的细胞凋亡[14]。本研究50例胃癌新鲜组织最终39例成功进行了原代培养及胃癌基础化疗药5-氟尿嘧啶、顺铂MTT药敏实验,可评价率较高(78.0%),按照癌细胞对不同化疗药体外的抑制率,我们将其分为敏感和耐药两组,结果显示GSK-3β在两种药物敏感组中的表达水平均明显高于耐药组,提示在胃癌中GSK-3β的活性下降可能与5-氟尿嘧啶及顺铂的耐药有关。目前GSK-3β参与化疗药物耐药的具体机制尚不明确,较为一致的观点是其通过上调耐药相关蛋白发挥作用:GSK-3β活性下调后细胞内P-糖蛋白的浓度显著升高[15],而P-糖蛋白可将胞内化疗药物泵至胞外,使得胞内达不到有效浓度。抑制GSK3β的表达还可以稳定β-catenin蛋白,通过活化MDR1(多药耐药基因1)启动子上调MDR-1蛋白的表达介导耐药[16]。此外,GSK-3β的耐药作用还可能与P53、NF-κB通路介导的细胞凋亡有关。
综上所述,在胃癌中GSK-3β表达水平下调,该作用可能与胃癌的发生、发展及耐药相关,有望成为胃癌个体化治疗的有效靶点。
[1]Jope RS,Johnson GV.The glamour and gloom of glycogen synthase kinase-3[J].Trends Biochem Sci,2004,29(2):95-102.
[2]Manoukian AS.Role of glycogen synthase kinase-3 in cancer:regulation by Wnts and other signaling pathways[J].Adv Cancer Res,2002,84:203-229.
[3]Shakoori A,Ougolkov A,Yu ZW,et al.Deregulated GSK3beta activity in colorectal cancer:its association with tumor cell survival and proliferation[J].Biochem Biophys Res Commun,2005,334(4):1365-1373.
[4]Cao Q,Lu X,Feng YJ.Glycogen synthase kinase-3beta positively regulates the proliferation of human ovarian cancer cells[J].Cell Res,2006,16(7):671-677.
[5]刘坤平,钟雪云,罗枫,等.GSK-3β抑制剂对结肠癌SW480细胞增殖和凋亡的影响[J].中国病理生理杂志,2011,27(1):97-101.
[6]辛华雯,陈肖嘉,杜光祖,等.两种抗癌药物敏感性试验方法与临床相关性研究[J].中国医院药学杂志,1994,14(12):548-550.
[7]Kumar A,Pandurangan AK,Lu F,et al.Chemopreventive sphingadienes downregulate Wnt signaling via a PP2A/Akt/GSK3β pathway in colon cancer[J].Carcinogenesis,2012,33:1726-1735.
[8]Cao Q,Lu X,Feng YJ.Glycogen synthase kinase-β positively regulates the proliferation of human ovarian cancer cells[J].Cell Res,2006,16(7):671-677.
[9]Farago M,Dominguez I,Landesman-Bollag E,et al.Kinase-inactive Glycogen synthase kinase 3 promotes Wnt signaling and mamma tumorigenesis[J].Cancer Res,2005,65(13):5792-5801.
[10]杜维,贺修胜.胃癌中β-catenin和GSK-3β的表达及临床意义[J].中国医师杂志,2012,14(9):1189-1192.
[11]Zheng HC,Xu XY,Xia P,et al.Involvement of inactive GSK3beta overexplession in tumorigenesis and progression of gastric carcinolilas[J].Hum Pathol,2010,41(9):1255-1264.
[12]Thiel A,Heinonen M,Rintahaka J,et al.Expression of cyclooxygenase-2 is regulated by glycogen synthase kinase-3 beta in gastric cancer cells[J].J Biol Chem,2006,281:4564-4569.
[13]谢成耀,高原,张秀伟,等.肺腺癌细胞A549及其顺铂耐药细胞株A549/DDP中GSK-3β蛋白磷酸化水平的差异[J].中华临床医师杂志,2013,7(20):9194-9199.
[14]焦志军,张蓓,徐翀,等.GSK-3β在结直肠癌细胞凋亡中的作用[J].上海第二医科大学学报,2005,25(2):161-166.
[15]Liu YY,Gupta V,Gauri A.Glucosylceramide synthase upregulates MDRl expression in the regulation of cancer drug resistance through cSrc and β-catenin signaling[J].Mol Cancer,2010,9:145.
[16]Lim JC,Kania KD,Wijesuriya H,et al.Activation of beta-catenin signaling by GSK-3 inhibition increases p-glycoprotein expression in brain endothelial cells[J].J Neurochem,2008,106(4):1855-1865.

