西南桦优良无性系组培快繁技术*
西南桦优良无性系组培快繁技术*
陈芳1,2,白平1,李勇杰1,陈海云1,徐田1,师春娟1,聂艳丽3,董晓光3,陆斌3,包晴忠4
(1.云南省林业科学院,云南昆明650201;2.国家林业局重点开放性实验室云南珍稀濒特森林植物保护和繁育实验室;
云南省森林植物培育与开发利用重点实验室,云南昆明650201;3.云南林业技术推广站,云南昆明650201;
4.西双版纳州林业局,云南景洪666100)
摘要:为高效集约经营云南乡土珍贵用材树种西南桦,在云南思茅、德宏选22个优良无性系为试材,从取材、材料的处理、外植体的诱导分化、芽的增殖、生根等方面探讨了西南桦组织培养繁殖技术和方法,结果表明,西南桦无性系间增殖系数及生根率均有一定差异,适宜增殖培养基为MS+6-BA 1.0 mg/L+KT 0.5 mg/L,增殖系数可达3~6倍,生根培养基为1/2 MS+IBA 1.0 mg/L+NAA 2.0 mg/L,生根率可达94.4 %。
关键词:西南桦;无性系;组织培养
西南桦(Betulaalnoides)是云南省热带及亚热带地区优良速生乡土用材林和高效的生态公益林树种,生长快,抗性强,材质优,弦径向干缩比仅为1.056,不易变形,花纹及色泽美观,是制作高档家具和木地板的理想材料[1],2013年每立方达3 000元以上,在云南德宏、版纳及思茅地区均有分布及人工种植。据统计,2010年中国西南桦人工林面积达到9×105hm2,1990年以来,中国对西南桦开展了比较系统的研究,对其生物学和生态学特性、种质资源调查、种源试验与良种选育、育苗技术、造林技术、生长适应性和丰产性及生态效益等方面进行了研究,取得了重大进展和丰硕成果[2]。
在育苗技术方面发现西南桦实生苗人工林分化比较严重[3],而通过选优,以优良单株为材料进行组培的无性系人工林分化较小,林相整齐,便于集约化经营管理,有利于提高单位面积林木生长量,2010年4月云南省林业科学院从云南思茅、德宏两地选了22个单株进行组培无性繁殖技术研究,建立无性繁育体系,并建立了无性系子代观察林,为云南培育优质高产西南桦无性系种苗提供技术支撑。
1材料与方法
1.1试验材料
材料取自普洱市、西盟及孟连、德宏的芒市,参照优树研究的方法[4]选择优良单株22株,采当年生枝条茎段、2年生枝条茎段及树干萌生芽。
1.2试验方法
外植体消毒材料采集后,剪去叶片,用软毛笔轻轻刷洗,清洗干净后,在超净工作台上,用0.1 % Hgcl2灭菌5-10 min,再用无菌水冲洗4~5次,然后约2~3 cm分节切割,接种在初代培养基MS+BA 1.0 mg/L+KT 0.5 mg/L上进行诱导培养。
初代诱导培养当萌发的新梢长到2~3 cm时,转入增殖培养基上进行扩繁,继代培养几次后,母瓶扩繁到一定数量时,即可切取1.5~2.0 cm的茎尖进行生根试验[5~6]。
芽增殖培养在基本培养基筛选确定MS后,添加不同浓度的细胞分裂素及生长素〔细胞分裂素KT(6-糠基氨基嘌呤)、BA(6-苄基氨基嘌呤)及生长素NAA(α-萘乙酸)〕13组培养基(表3),进行对比试验,pH值5.8±0.2,蔗糖30 g/L,琼脂0.5 %~0.6 %。
生根培养以1/2 MS为基本培养基,添加不同浓度配比的生根诱导剂IBA(吲哚丁酸)、NAA,10组培养基(表5),蔗糖10 g/L,培养基的pH值5.8±0.2[7~8]。以上培养室温度25±5℃,光照强度4 000±1 000 lux,光照时间12 h/d。
1.3数据分析
试验采用对比试验,每组培养基接种10个外植体,重复3次。分化芽形成后,芽生长到0.5 cm,进行计数,统计出芽的个数,计算芽增殖系数(增殖系数=形成丛芽数/接种数)生根试验,当增殖到一定数量时,按节2~3 cm,进行分切进行生根试验,每组接种30个节段,3次重复,30天生根后,按根长0.5 cm的进行计数,统计生根数,计算生根率(生根率=生根数/接种数),最后进行数据统计分析。
2结果与分析
2.1芽的诱导与增殖
2.1.1枝条年龄对芽增殖率的影响
选用茎段及芽较多的S-1的优良单株做试验材料,以MS+BA 1.0 mg/L+KT 0.5 mg/L为诱导培养基进行试验。西南桦由于其自身原因,高度分化,脱分化过程较为漫长,从芽接种到丛生芽形成时间比较长,约需90-120天,而巨尾桉(Eucalyptusgrandis×E.urophylla)仅需20-30天。西南桦需30天左右转接1次,更换新鲜培养基,补充营养,枝条年龄对芽增殖有明显影响(表1)。经过3个继代周期,不同外植体年龄,形成丛生芽数差异较大,2年生枝条增殖率只有80 %,当年生萌芽条作外植体,增殖率可达367 %,但消毒灭菌较难控制,时间稍长,污染率低,且芽易褐化死亡。如果消毒处理时间短,污染率又高,但芽萌动快,出芽率高,这可能是芽幼态,分生细胞还处于活跃状态。

表1 不同年龄的外植体芽增殖情况
2.1.2基本培养基对芽增殖的影响
以S-1的优良单株做试材,选用含高、中、低无机盐的MS、H、WH培养基3种基本培养基进行试验。结果表明3种培养基差异显著:在MS培养基中,增殖较好,经过诱导能分化丛芽,芽增殖系数为4.52倍;在WH可能是无机盐浓度较低,增殖系数最低,仅为2.03;H培养基居中。而在丛生芽继代培养中,3种培养基增殖系数差异不显著。西南桦芽增殖在各营养成分较丰富的MS培养基较好(表2)。

表2 基本培养基对西南桦芽增殖的影响
注:激素添加BA 1.0 mg/L+KT 0.5 mg/L。
2.1.3细胞分裂素对芽增殖的影响
在MS培养基中附加不同浓度的细胞分裂素BA和KT(表3)。在无细胞分裂素的对照试验中,只形成单芽,芽径直向上生长,没有形成丛芽。添加BA和KT在1~2 mg/L,在芽初代培养和继代增殖培养中明显有促进作用,增殖系数逐渐增加,KT刺激作用略高于BA;当BA或KT浓度超过3.0 mg/L,芽增殖系数反而下降,苗出现畸形;而同时添加BA和KT时,初始培养和继代增殖培养芽增殖系数有显著提高;同时添加BA 1.0 mg/L和KT 0.5 mg/L时,芽增殖系数最高,分别达到3.8倍和4.3倍,苗健壮,叶色浓郁,说明2种细胞分裂素在一定浓度范围内,配合使用对芽增殖生长较好;但当BA浓度为2.5 mg/L,KT 2.0 mg/L或再加大用量时,芽增殖系数降低,并出现大量畸形苗,说明西南桦茎段离体培养中,BA和KT一起使用,效果较好,但需要一定的浓度配比,促进西南桦茎段培养的芽增殖系数3~4,苗健壮的培养基为MS+BA 1.0 mg/L+KT 0.5 mg/L。
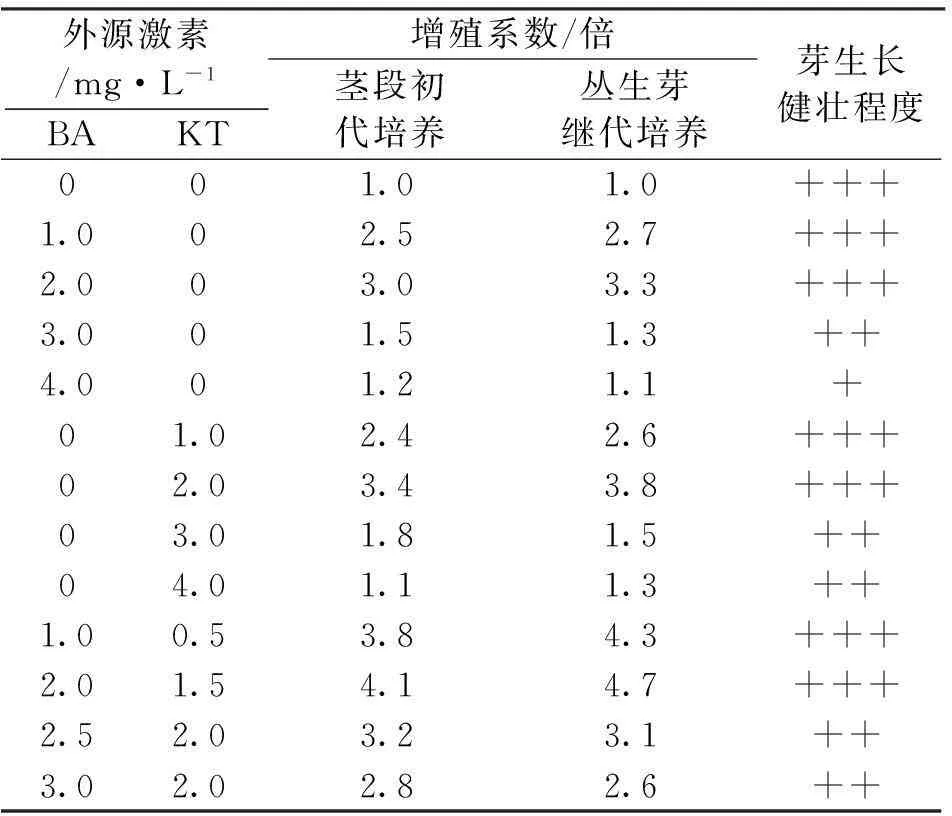
表3 外源激素对西南桦离体培养芽增殖的影响
2.1.4不同无性系芽增殖
当芽增殖培养基采用MS+6-BA 1.0 mg/L+KT 0.5 mg/L,把从思茅及德宏22个优良无性系茎尖及茎段按清洗消毒灭菌后,接种在诱导培养基上,20-25天后芽开始萌动,30-40天伸长,当芽伸长到3~4 cm,2~3节时,即可分切转接到新鲜培养基上继续进行培养,30天后逐渐形成芽丛,60天左右再分切继代培养,60-65天继代1次,增殖率可达3~6倍。经过5次转接,22个无性系诱导成功,平均增殖率达3~6倍,S-1、D-12号经过5次继代达5~6倍(表4)。
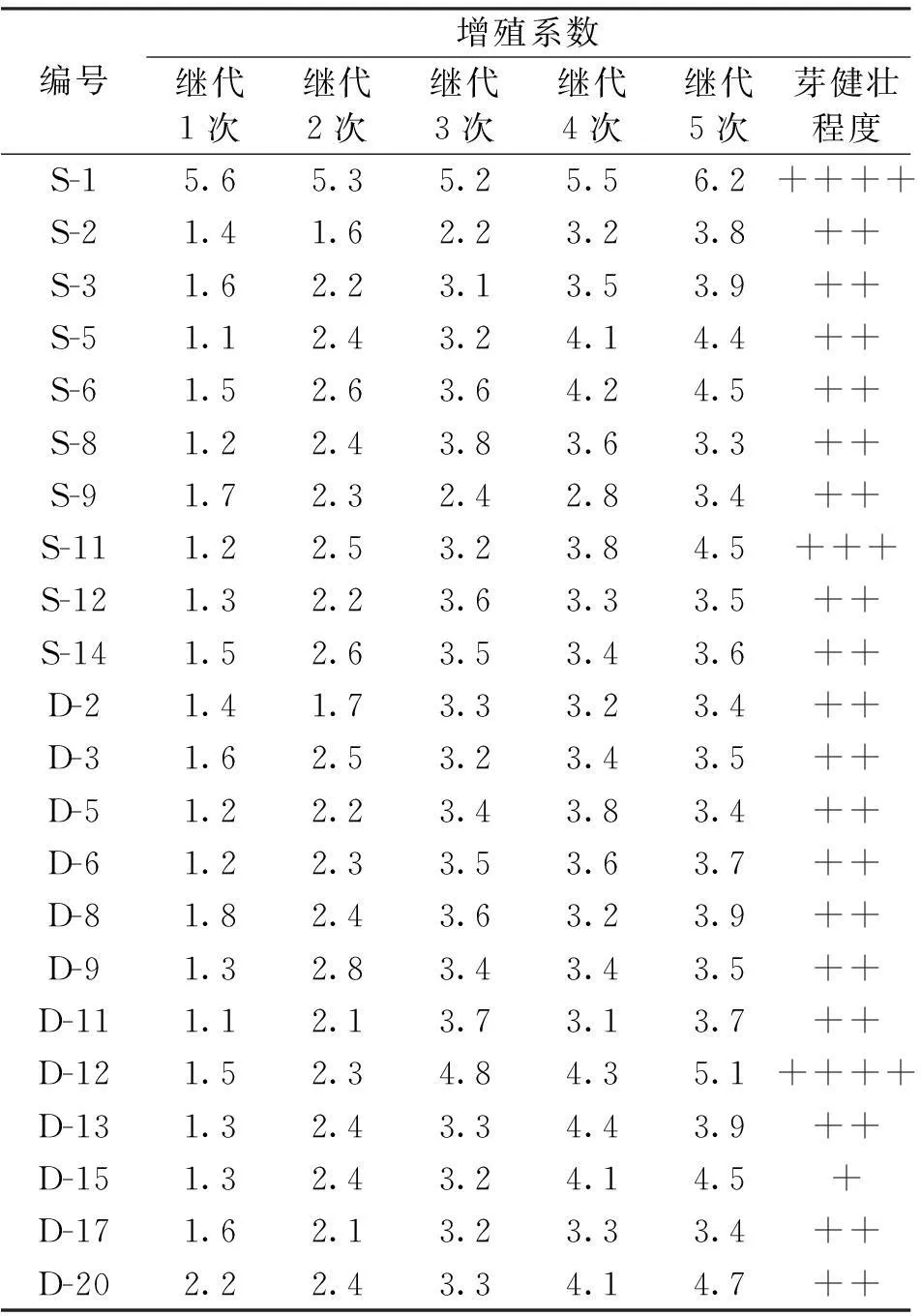
表4 不同无性系增殖率试验
2.2根的诱导
2.2.1激素组合对生根的影响
当试管苗增殖到一定数量,即可开始生根试验,切取2~3 cm的健壮西南桦试管绿苗接种在生根培养基上。在空白对照组中,接种到30天后,均未见生根;添加不同浓度的IBA及NAA,10-15天试管苗基部开始膨大,发根,随浓度的增加,生根率明显提高,增加到5.0 mg/L时,接种后15天生根率为11.2 %,30天后达20.1 %,但苗基部愈伤块较大,组织疏松,根粗,根从愈伤组织上伸出,没有和韧皮部连接,脆易断,移栽成活率不高;而NAA和IBA配合使用,IBA 1.0 mg/L,NAA 2.0 mg/L时,接种后15天生根率为15.1 %,30天后生根率达91.2 %,根从茎韧皮部发出,愈伤组织较小,须根较多,可形成2~3级须根,移栽成活率较高,可达80 %以上(表5)。

表5 激素组合对生根的影响
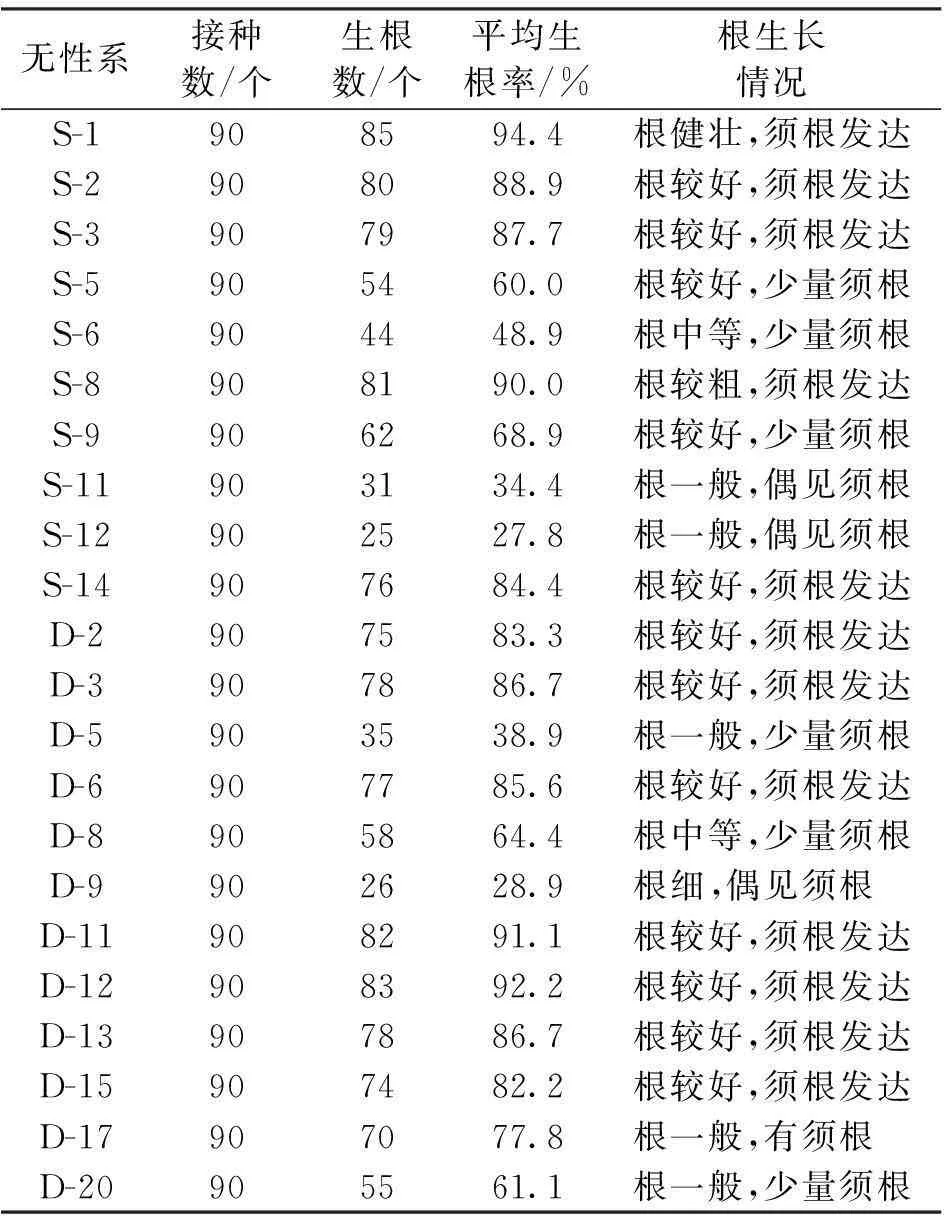
表6 不同无性系生根率
2.2.2不同无性系生根试验
从22个单株建立的无性繁育体系中,取2~3 cm的绿苗,接种在1/2 MS+IBA 1.0 mg/L+NAA 2.0 mg/L培养基上,发现各无性系生根差异明显,最好的是S-1生根率可达94.4 %,D-12达92.2 %,而S-12仅为27.8 %(表6)。
2.3试管苗的移栽
当苗生长到5~6 cm,出现2~3级须根时,把培养瓶移出培养室,放置在散射光较强处逐步从光照强度4 000 lx,增加到10 000 lx进行炼苗,提高试管苗木质化程度,当苗茎干发红,叶片角质化后,拧松瓶盖,移栽前2天将瓶盖打开,1-2天后取出瓶苗,用自来水冲洗,洗净培养基,用10 %的多菌灵浸泡1 min,即可移植到大棚或温室的苗床上,基质采用疏松腐质土和生土(按1:1的比例)装4 cm×8 cm的营养袋;试管苗移植成活率与生长季节和移栽地气候关系较大,移栽试验在宁洱进行,2-3月成活率较高,可达85 %以上,4-5月由于气温较高,移栽难度较大,成活率仅为50 %左右,估计这与普洱当地气候条件有关。
3结语
采用芽及茎段离体无性繁殖,未经愈伤组织阶段,通过添加细胞分裂素,抑制顶端优势,促进侧芽萌发,以芽繁芽,较好的保持单株的优良特性。
以西南桦芽为外植体进行组培试验,从外植体接种到丛生芽的形成时间较长,需3~4个继代周期培养,约120-180天,细胞脱分化启动较缓,这可能与木本植物特性有关。
在相同条件下培养,有2个无性系增殖率相对较高,即S-1及D-12,其他无性系差异不明显,在生产中,有待对各无性系试管苗建立观测林后,对各无性系进行综合观测评价,选择试管增殖及生根率高,长势较好的无性系进行规模化生产。
西南桦实生苗遗传变异大,扦插生根率不高,进行西南桦优良无性系组培繁育将有助于云南省培育优质高效人工林提供技术支撑。
通过采集优良单株上的材料进行无性繁殖的试管苗,再返回原生地进行无性系子代测定,观察其生长状况,其结果将在随后论文报道。
致谢:本课题得到中国林业科学研究院热带林业中心谌江辉博士的大力支持和帮助,特此表示感谢!
参考文献:
[1]庞正轰.我国西南桦研究进展[J].广西科学院学报,2011,27(3):243-250.
[2]曾杰,郭文福,赵志刚,等.我国西南桦研究的回顾与展望[J].林业科学研究,2006,19(3):379-384.
[3]王达明.西南桦的分布与生态环境[C].热区造林树种研究论文集,昆明:云南科技出版社,1996:99-105.
[4]陈强,周跃华,常恩福,等.西南桦优树选择的研究[J].浙江林学院学报,2005,22(3):291-295.
[5]樊国盛,邓莉兰.西南桦组织培养研究[J].西南林学院学报,2000,20(3):147-151.
[6]刘英,曾炳山,裘珍飞,等.西南桦以芽繁芽组培快繁研究[J].林业科学研究,2003,16(6):715-719.
[7]陈伟,施季森,陈金慧,等.西南桦不同种源外植体组织培养技术[J].南京林业大学学报,2007,31(1):27-30.
[8]谌红辉,曾杰,贾宏炎.西南桦离体培养再生植株技术[J].林业实用技术,2001(10):21-22.

[上接第7页]
[24]Guan H C,Lin T H,Mee N Y,etal.Molecular characterization of a senescence-associated gene encoding cysteine proteinase and its gene expression during leaf senescence in sweet tomato[J].Plant and Cell Physiology,2002,43(9):984-991.
[25]Masahiro K,Kazuko Y,Hideo T,etal.Structure and expression of two genes that encode distinct drought-inducible cysteine proteinases in Arabidopsis thaliana[J].Gene,1993,129(2):175-182.
[26]Renu K C,Srivalli B,Ahlawat Y S.Drought induces many forms of cysteine proteases not observed during natural senescence[J].Biochemical and Biophysical Research Communications,1999,255(2):324-327.
[27]Tadamasa U,Shigemi S,Yuko O,etal.Circadian and senescence-enhanced expression of a tobacco cysteine protease gene[J].Plant Molecular Biology,2000,44:649-657.
[28]Bhalerao R,Keskitalo J,Sterky F,etal.Gene expression in autumn leaves[J].Plant Physiology,2003,131(2):430-442.
[29]Grudkowska M,Zagdanska B.Multifunctional role of plant cysteine proteinases[J].Acta Biochemical Polonica,2004,51(3):609-624.
Fast Propagation of Fine Clones of Betula alnoides
CHEN Fang1,2,BAI Ping1,LI Yong-jie1,CHEN Hai-yun1,XU Tian1,SHI Chun-juan1,
NIE Yan-li3, DONG Xiao-guang3, LU Bin3, BAO Qing-zhong4
(1.Yunnan Academy of Forestry,Kunming Yunnan 650201,P.R.China;2.Yunnan Laboratory for Conservation of Rare,
Endangered & Endemic Forest Plants,Public Key Laboratory of the State Forestry Administration;Yunnan Provincial Key Laboratory of
Cultivation and Exploitation of Forest Plants,Kunming Yunnan 650201,P.R.China;3.Yunnan Provincial Forestry Technology Promotion Center,
Kunming Yunnan 650201,P.R.China;4.Forestry Bureau of Xishuanbanna,Jinhong Yunnan 666100,P.R.China)
Abstract:In order to propagate and cultivate Betula alnoides,taking 22 varieties selected from Simao and Dehong as samples, a study on techniques and relevant measures of tissue culture of Betula alnoides was carried out from sample preparing ,explant differentiation inducting, bud propagating,and root generating.The results showed that the optimum medium for inducing bud differentiation was MS+6-BA 1.0 mg/L+KT 0.5 mg/L,with propagating rate of 3 to 6 times, and root medium was 1/2 MS+IBA 1.0 mg/L+NAA 2.0 mg/L, with rooting rate of 94.4 %.
Key words:Betula alnoide;clone;tisue culture
中图分类号:S 792.15
文献标识码:A
文章编号:1672-8246(2015)05-0008-05
作者简介:第一陈芳(1965-),女,正高级工程师,主要从事林木组培研究。E-mail:chenfang658@126.com
基金项目:国家林业局公益性项目(201104060)“西南桦、光皮桦优良无性系育林技术研究”,云南省林业厅推广课题“西南桦优 良无性系繁育”。
收稿日期:*2015-05-14
doi10.16473/j.cnki.xblykx1972.2015.05.002

