功能磁共振在血管性痴呆诊断中的应用*
曾艺,朱梦茜
(中南大学湘雅二医院老年病学科,湖南 长沙 410011)
·临床报道·
功能磁共振在血管性痴呆诊断中的应用*
曾艺,朱梦茜
(中南大学湘雅二医院老年病学科,湖南 长沙 410011)
血管性痴呆(VD)是由缺血性卒中、出血性卒中、控制认知及行为脑区低灌注的脑血管疾病引起的严重认知功能障碍综合征。在瑞士神经科学研究国际会议中提出VD的概念和诊断标准。其诊断基于神经心理学测试和临床表现,并结合相关影像学检查结果。诊断标准虽包括辅助诊断的相关影像学指标,却无明确的影像学确诊依据。目前,功能磁共振(fMRI)已成为一种具有高空间分辨率的非创伤性或者创伤性很小的研究脑功能的神经影像学检查手段。其检测静息或任务状态中各脑区间的功能连接方法可能在客观上明确诊断VD。
血管性痴呆;功能磁共振;诊断
血管性痴呆(vascular dementia,VD)是一种缓慢进展性的老年性痴呆,包括认知功能、记忆力、抽象判断力、计算力、视空间技能、社会生活能力的减退和情感、人格的改变等[1]。缺血性卒中、出血性卒中及脑白质病变脑血管危险因素均可导致VD,>65岁人群的痴呆患病率约为5%,其中阿尔茨海默病(alzheimer disease,AD)位列首位(约50%),VD其次(20%),而AD合并VD混合型痴呆占10%~20%,余为其他型痴呆[2]。
1 病因与发病机制
1.1 病因
VD发病的危险因素包括高龄、高血压、高血脂、高尿酸血症、糖尿病、心脏病、卒中次数、颈动脉斑块形成、吸烟及受教育程度低等。年龄为最重要的高危因素之一,随年龄增长,VD的发病率成倍增加,>55岁人群中,每增长10岁,痴呆的患病率就增加1倍[3]。VD的发病年龄相比AD更早,且在大龄老年人,即>85岁人群中,VD发病更为普遍[4]。DURON等[5]发现,收缩期血压与VD认知功能恶化的风险呈正相关,收缩压每增加10 mmHg,认知功能恶化的风险增加5%。但是也有研究表明,平均动脉压的降低会导致低脑灌注压,而脑循环低血流量会导致大脑神经纤维病变、记忆力下降,因此低血压可能增加老年人患痴呆的风险[6]。
1.2 发病机制
VD发病机制一般认为是脑血管病的病灶涉及大脑管理认知及执行功能脑区如额叶、颞叶及边缘系统,或卒中累及足够容量的脑组织,导致高级认知功能障碍,通常表现为记忆、注意、计算、空间认知、执行功能和语言等认知功能受损。有研究发现,脑血流及代谢率降低的程度与痴呆严重程度呈正相关[7],且认知能力受损程度越重,卒中累及认知功能脑区的范围越广。见附图。
2 诊断标准
目前,痴呆的诊断多依据精神疾病和统计手册(diagnostic and statistical manual of mental disorders,DSM-Ⅳ)的标准:①认知功能减退,主要表现为认知功能明显下降,尤其是自身前后对比存在记忆力下降,并且有定向、注意、语言、计算、视空间功能、执行功能、运动控制等≥2项认知功能损害。②日常生活能力下降,主要表现为日常生活自理能力明显下降或习惯改变,并经神经心理学测试证实[7-8]。
目前,VD仍使用瑞士神经科学研究国际会议和美国国立神经病与卒中研究所的诊断标准[8]。两者的共同诊断要点为:①首先符合痴呆诊断标准,包括认知功能明显减退和显著的社会能力下降。②必须有明确的既往史或临床症状,或有影像学证据的脑血管疾病,并提示痴呆的发病与其明显相关。③两者必须有明确的相关性,痴呆发生在脑血管病发病3~6个月内,痴呆症状可以突然发生也可是缓慢进展,病程呈波动性或阶梯样加重,可伴或不伴神经局灶体征或症状。④具有排他性诊断,须除外其他痴呆的病因以及意识障碍、精神疾患引起神志和认知能力上的改变[8-9]。

附图 VD的发病机制
国际上常用的几种痴呆诊断筛查的神经心理学量表是痴呆简易精神状态检查量表(mini-mental state examination,MMSE)、Mattis痴呆评定量表(dementia rating scale,DRS)、临床痴呆评定量表(clinical dementia rating,CDR)、蒙特利尔认知评估量表(montreal cognitive assessment,MoCA)及Addenbrooke改良认知评估量表(addenbrooke cognitive examination revised,ACE-R)等。Hachinski缺血评分量表主要用于VD和AD的鉴别,运用不同的神经心理学量表,痴呆的亚型诊断结果可能不同。有学者运用精神测试和DSM-Ⅲ-R标准诊断痴呆患者,并依据致痴呆的病因及临床症状不同,将痴呆分为AD、 VD和其他类型痴呆。其中AD参照美国国家神经病及语言障碍和卒中研究所阿尔茨海默病及相关学会制定的诊断标准;VD的诊断参照ERKINJUNTTI等[10]提出的诊断标准。结果显示,AD患者占痴呆患者总例数的61%,VD患者占25%,其余为混合性痴呆。通常VD患者多有卒中史,呈阶梯式进展,波动病程,通常予以Hachinski缺血量表鉴别,卒中致认知功能受损的痴呆症状,伴有局灶性神经体征或症状[11]。如果运用Hachinski缺血量表将痴呆患者分类,得出混合型痴呆占总痴呆例数>60%[4]。因此,参照不同的心理学量表,可能会导致疾病诊断的改变。
3 影像学特征
3.1 磁共振成像表现
磁共振成像(magnetic resonance imaging,MRI)的基本原理是人体中的氢原子核在特殊磁场的无线电射频脉冲下产生共振,并吸收能量。在脉冲停止射频后,人体氢原子核将吸收的能量释放出来,以特定频率发射出电信号,经接收器收录处理后,以图像形式呈现出来,称为核磁共振成像。
从MRI上获得证据来诊断VD十分必要且有效。造成VD的主要原因是小血管病或微血管病,通常脑小血管病是指脑部小动脉或细动脉受损的血液循环状态[9],定义为>25%的脑白质损害[12]。因此脑白质中的小血管损害对VD的起病十分关键[13]。小血管病在MRI上表达的信号包括脑白质高信号、新发的皮层下小血管梗死、腔隙性梗死、血管周围间隙扩大、微出血以及脑萎缩[12]。MRI的T2加权像中,双边极度对称高信号的脑白质损害在老年人中普遍存在。有研究发现,10%~90%认知功能正常的老年人同样有上述表现[14]。脑白质高信号范围越大,对临床诊断越有意义[15]。VD患者脑白质损害通常是多样化的,非对称或在大脑分水岭区局域化分布。脑白质稀疏提示缺血及VD,且脑白质稀疏、动脉粥样硬化及隐匿性腔隙性脑梗死与患者认知下降密切相关[16-17]。如果在疾病早期阶段即脑白质稀疏及腔隙性脑梗死阶段给予临床干预,VD的发生率会降低。但是,目前关于VD的诊断标准缺乏一个客观的诊断模式,如明确的神经影像学诊断,大多是建立在痴呆的高危因素、病因机制、神经系统表现和相关影像学检查等专家意见基础上。按照目前VD的诊断标准,其主要目的只是与AD临床表现相比时,取得较高的诊断特异性和敏感性,而患者得到诊断时往往病情已经很严重,行为、认知功能明显受损,错过治疗的最佳阶段,因此需要更多的客观依据支持[18]。
尽管X线可以发现脑白质的改变,但是在显示结缔组织结构方面,却不如MRI敏感[19]。而结构磁共振中提示无脑梗死的VD患者,功能磁共振(functional magnetic resonance imaging,fMRI)却可以有效的提示低灌注、低代谢的分散区域。
3.2 功能磁共振诊断研究
fMRI是一种新兴的神经影像学方式,利用磁共振造影来测量神经元活动所引发的血液动力的改变。依赖血氧水平的功能磁共振(blood oxygen level dependent functional magnetic resonance imaging,BOLD-fMRI)的基本原理是根据磁场中神经元的活动对脑激活区与未激活区局部血流影响程度的不同,使两者的氧合血红蛋白/脱氧血红蛋白比例不同,导致MRI信号的差异,通过相关分析软件对比进行数据分析,从而绘制大脑皮质功能图,达到无创而直观反映相关脑区皮质的功能变化[20]。近年来,fMRI逐渐成为一种具有高空间分辨率的非创伤性或者创伤性很小的研究脑功能的神经影像学检查手段。对VD的fMRI研究中发现,VD低灌注、低代谢区域与大脑血管分布区域基本一致,脑功能减低区主要累及控制大脑认知和执行功能脑区,还包括大脑中动脉供血区及基底节,少有侵及枕叶、小脑脑区[7]。
3.2.1 任务态BOLD-fMRI应用于VD的研究及价值现阶段基于任务态fMRI的目的就是运用BOLD-fMRI和任务来研究VD患者相关脑区的联系。许多任务态fMRI研究发现,大脑激活化的增强和减弱与脑白质损害相关[13]。最近一项任务态fMRI发现,皮质下血管性认知功能损害(subcortical vascular cognitive impairment,SVCI)患者脑部存在明显异常的皮质活动改变,主要位于前额叶[21],皮质下缺血性血管性痴呆(subcortical ischemic vascular dementia,SIVD)和AD具有不同的脑功能激活特征,AD组对比SIVD组而言,其后顶叶的激活体积明显增多[7]。VENKATRAMAN等[22]研究表明,当严重的脑白质损害患者在心理活动时,额叶的运动区及运动前区活化减弱。纪东旭等[18]在嗅觉刺激下fMRI检测VD患者的激活脑区,对比正常对照组(normal control,NC)的全脑嗅觉相关脑区以及双侧初级嗅觉皮层的嗅觉激活时发现,VD患者存在嗅觉功能损害,嗅觉刺激的全脑激活体素较NC组也明显减低,激活减低区主要位于额叶皮质下的白质、额中回、额下回及颞上回、岛叶、边缘叶的扣带回等结构[18]。LI等[21]在对血管性认知损害患者基于Stroop任务的fMRI研究中发现,AD患者和VD患者在Stroop测试的刺激下产生同样的皮质活化脑功能区,包括双侧大脑皮质前额叶背外侧区(dorsolateral prefrontal cortex,DLPFC)、腹外侧前额叶(ventrolateral prefrontal cortex,VLPFC)、后顶叶、中央前回、扣带回和基底节区。相比NC组,VD患者这些区域的皮质激活明显减弱(见表1、2)[7,22]。皮层下缺血性血管性认知损害(subcortical ischemic vascular cognitive impairment,SIVCI)脑注意和执行功能区主要包括双侧VLPFC、DLPFC、后顶叶、中央前回、扣带回及基底节区。皮层下缺血性非痴呆血管性认知损害(subcortical ischemic vascular cognitive impairment no dementia,SIVCIND)存在补偿回路,双侧DLPFC、VLPFC脑区功能代偿性增加;SIVD脑功能区改变主要以右侧基底节区、双侧DLPFC、VLPFC、后顶叶脑功能区损害为主[23]。皮质下缺血性血管性认知损害非痴呆组(subcortical ischemic vascular cognitive impairment no dementia,SIVCIND)与NC组比较,虽认知能力减退,但相关脑区功能活化存在代偿性增加。
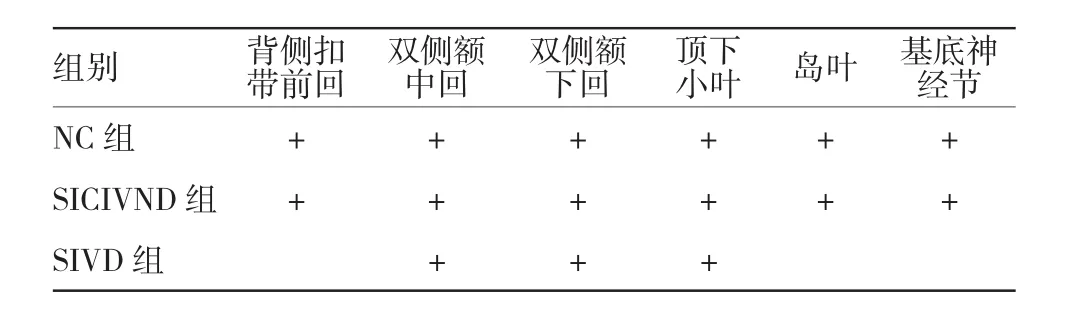
表1 3组大脑前额叶的不同活化脑区

表2 3组大脑前额叶的不同活化增强脑区皮质
3.2.2 静息态BOLD-fMRI应用于VD的研究及价值静息态BOLD-fMRI是指人体在静息状态下获取脑内部BOLD信号,从能量或脑功能区局部联系的角度来观察,反映神经元自发活动及神经功能连接作用;前者是运用局部脑活动分析法,后者是运用网络分析法来分析观察神经元的自发活动。功能连接及网络分析主要包括独立成分分析和感兴趣区分析,可以将大脑划分为不同脑区,对不同脑功能间的连接作用进行研究[24]。
默认网络(default mode network,DMN)是静息状态下的大脑系统,包括后扣带回/前楔叶、内侧前额叶、前颞叶、前顶叶、双侧角回、双侧外侧颞叶及双侧海马[25-27]。DMN与注意网络的活动相互拮抗[27]。
在联合体素形态学研究中,SUN等[28]在静息态fMRI的研究中发现,血管性认知损害非痴呆型患者左侧扣带前回/左侧额中回、右侧尾状核、右侧额中回和左侧额中回/中央前回的功能连接减弱,而在右侧颞前回、左侧中央前回和左侧优势半球顶叶各脑区功能连接减弱;与该研究不同的是,YI等[29]认为皮质下血管轻度认知损害患者在DMN的前区低频振幅减弱,而在默认网络后部增加。与其研究相似的是,周霞等[30]在研究VD各相关脑区的相互功能连接性中发现,额颞叶脑区网络内信息传递效率的降低可能导致脑区内和脑区间功能连接失常,影响额顶叶环路信息传递,导致认知功能损害。与NC组相比,SVCI患者的左侧杏仁核和右侧颞上回脑区的枢纽作用较正常组明显降低,而楔前叶和缘上回脑区的枢纽作用明显增加[30]。ZHU等[31]认为,认知功能轻度受损患者出现抑郁症状的主要原因可能与边缘系统-皮质-纹状体-苍白球-丘脑环路的连接减退有关,其环路是管理情绪的重要部分。
3.2.3 fMRI研究的不足基于任务态和静息态fMRI对VD的研究中,大多局限于局部脑区,对于VD、SVD及SIVD患者全脑功能网络的研究值得深入探讨。目前,静息状态fMRI在研究VD默认网络方面的研究数据仍十分有限。LI等[21]在Stroop任务表现中,正常老年人与认识受损程度不同SIVCNID患者比较,发现前额叶皮层有不同的活化特性。SIVD患者中有功能损害的区域,在SIVCNID患者中对应脑区中存在补偿。该研究可能对临床鉴别SIVCIND和SIVD有指导性意义。但是所有SIVCIND患者的MoCA评分极其相近,所以无法预计其与BOLD反应的相关性。在以后的研究中,应采用更大样本量和在认知能力上差异更大的痴呆患者进行研究,并可将MoCA评分表与SIVCI患者脑活化不同程度的相关性联系起来[21]。
4 fMRI用于VD诊断的展望
以往fMRI用于VD诊断方面仍存在一些不足:①两组病例数相对较少,入组年龄虽为>60岁老年人,但样本年龄跨度大,缺少大样本的研究,在今后的研究中,可采取大样本量入组研究,减少分析数据产生的偏倚。②目前资料显示,研究VD患者的正激活和负激活的大脑相关脑区未有一致的负相关。
尽管有以上缺点,传统的MRI技术与易操作的神经心理学测试可相互结合,描述脑白质在异常认知功能损害及痴呆患者的神经心理功能上的影响。笔者相信,fMRI这一简单而非创伤性的方法,将有利于研究和诊断VD,并可以用新方法对VD的亚型分型。随着中国老龄化比例逐渐上升,医疗环境及技术水平不断提高,痴呆老人的比例及数量也逐年增加,医疗费用和照料问题也给家庭及社会带来极大的经济及精神上的负担。目前,尚无能治愈VD的有效方法,因此早期的诊断与护理干预对延缓VD病情进展、降低医疗和照顾费用至关重要[32]。
[1]蒲凡,孟红旗.血管性痴呆的分类、临床与诊断进展[J].中国社区医师(医学专业),2012,14(21):201-202.
[2]CUNNINGHAM EL,MCGUINNESS B,HERRON B,et al.Dementia[J].Ulster Medical Journal,2015,84(2):79-87.
[3]曲艳吉,卓琳,王华丽,等.1980~2011年中国社区55岁及以上人群中血管性痴呆流行病学的Meta分析[J].中国卒中杂志,2013, 7:533-543.
[4]LARSON EB.Prospects for delaying the rising tide of worldwide,late-life dementias[J].Int Psychogeriatr,2010,22(8):1196-1202.
[5]DURON E,VIDAL JS,BOUNATIRO S,et al.Relationships between personality traits,medial temporal lobe atrophy,and white matter lesion in subjects suffering from mild cognitive impairment[J]. Front Aging Neurosci,2014,6:195.
[6]GLODZIK L,RUSINEK H,PIRRAGLIA E,et al.Blood pressure decrease correlates with tau pathology and memory decline in hypertensive elderly[J].Neurobiol Aging,2014,35(1):64-71.
[7]李传明.血管性和老年性认知损害患者基于Stroop任务的fMRI研究[D].重庆:第三军医大学,2009.
[8]AL-QAZZAZ NK,ALI SH,AHMAD SA,et al.Cognitive assessments for the early diagnosis of dementia after stroke[J].Neuropsychiatric Disease and Treatment,2014,10:1743-1751.
[9]BATTISTIN L,CAGNIN A.Vascular cognitive disorder.a biological and clinical overview[J].Neurochemical Research,2010, 35(12):1933-1938.
[10]ERKINJUNTTI T,HALTIA M,PALO J.Accuracy of the clinical diagnosis of vascular dementia:a prospective clinical and post-mortemneuropathologicalstudy[J].JournalofNeurology Neurosurgery and Psychiatry,1988,51(8):1037-1044.
[11]BERMINGHAM SL.The appropriate use of neuroimaging in the diagnostic work-up of dementia:an evidence-based analysis[J]. Ont Health Technol Assess Series,2014,14(1):1-67.
[12]WARDLAW JM,SMITH EE,BIESSELS GJ,et al.Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration[J].Lancet Neurol, 2013,12(8):822-838.
[13]SCHAEFER A,QUINQUE EM,KIPPING JA,et al.Early small vessel disease affects frontoparietal and cerebellar hubs in close correlation with clinical symptoms-a resting-state fMRI study[J]. Journal of Cerebral Blood Flow Metabolism,2014,34(7):1091-1095.
[14]VALKANOVA V,EBMEIER KP.Neuroimaging in dementia[J]. Maturitas,2014,79(2):202-208.
[15]DUFOUIL C,GODIN O,CHALMERS J,et al.Severe cerebral white matter hyperintensities predict severe cognitive decline in patients with cerebrovascular disease history[J].Stroke,2009,40(6): 2219-2221.
[16]THONG JY,HILAL S,WANG Y,et al.Association of silent lacunar infarct with brain atrophy and cognitive impairment[J]. The Journal of Neurol Neurosurg Psychiatry,2013,84(11):1219-1225.
[17]GORELICK PB,SCUTERI A,BLACK SE,et al.Vascular contributions to cognitive impairment and dementia:a statement for healthcare professionals from the american heart association/ American stroke association[J].Stroke,2011,42(9):2672-2713.
[18]纪东旭.阿尔茨海默病和血管性痴呆的嗅觉功能磁共振成像研究[D].天津:天津医科大学,2014.
[19]PANTONI L.Cerebral small vessel disease:from pathogenesis and clinical characteristics to therapeutic challenges[J].Lancet Neurol,2010,9(7):689-701.
[20]邱美慧,吴彦,彭代辉.抑郁症海马的结构及功能磁共振成像的研究进展[J].上海交通大学学报(医学版),2015,6:901-905.
[21]LI C,ZHENG J,WANG J.An fMRI study of prefrontal cortical function in subcortical ischemic vascular cognitive impair ment[J].American Journal of Alzheimer's Disease and Other Dementias,2012,27(7):490-495.
[22]VENKATRAMAN VK,AIZENSTEIN H,GURALNIK J,et al. Executive control function,brain activation and white matter hyperintensities in older adults[J].Neuroimage,2010,49(4): 3436-3442.
[23]LIC,ZHENGJ,WANGJ,etal.Comparisonbetween Alzheimer's disease and subcortical vascular dementia:attentional cortex study in functional magnetic resonance imaging[J].The Journal of International Medical Research,2011,39(4):1413-1419. [24]周治明,赵建农.轻微型肝性脑病BOLD-fMRI研究进展[J].国际医学放射学杂志,2013,2:114-117.
[25]HAFKEMEIJER A,VAN DER GROND J,ROMBOUTS SA. Imaging the default mode network in aging and dementia[J]. Biochim Biophys Acta,2012,1822(3):431-441.
[26]FOX MD,GREICIUS M.Clinical applications of resting state functional connectivity[J].Frontiers in Systems Neuroscience,2010, 4:19.
[27]李雨,舒华.默认网络的神经机制、功能假设及临床应用[J].心理科学进展,2014,2:234-249.
[28]SUN YW,QIN LD,ZHOU Y,et al.Abnormal functional connectivity in patients with vascular cognitive impairment,no dementia:a resting-state functional magnetic resonance imaging study[J].Behavioural Brain Research,2011,223(2):388-394.
[29]YI L,WANG J,JIA L,et al.Structural and functional changes in subcortical vascular mild cognitive impairment:a combined voxel-based morphometry and resting-state fMRI study[J].PLOS One,2012,7(9):DOI:10.1371/Journal.Pone.0044758.
[30]周霞.皮质下血管性认知功能损害患者脑小世界网络及动态功能分布[D].合肥:安徽医科大学,2014.
[31]ZHU Z,LU Q,MENG X,et al.Spatial patterns of intrinsic neural activity in depressed patients with vascular risk factors as revealed by the amplitude of low-frequency fluctuation[J]. Brain Research,2012,1483:82-88.
[32]BORSON S,FRANK L,BAYLEY PJ,et al.Improving dementia care:The role of screening and detection of cognitive impairment[J].Alzheimer's Dementia,2013,9(2):151-159.
(童颖丹 编辑)
R749.1;R445.2
B
1005-8982(2015)29-0101-05
2015-07-06
国家自然科学基金(No:81200838);湖南省科技厅项目(No:2014FJ3138);教育部留学回国人员科研启动基金[No:(2013)1972]

