水飞蓟素胶囊对早期糖尿病肾病微量白蛋白尿的影响
李莉,万青松,谢红萍,杨波
(1.湖南环境生物职业技术学院护理学院,湖南 衡阳 421005;2.南华大学附属第一医院肾内科,湖南 衡阳 421001)
·临床论著·
水飞蓟素胶囊对早期糖尿病肾病微量白蛋白尿的影响
李莉1,万青松2,谢红萍2,杨波2
(1.湖南环境生物职业技术学院护理学院,湖南 衡阳 421005;2.南华大学附属第一医院肾内科,湖南 衡阳 421001)
目的探讨水飞蓟素胶囊对早期糖尿病肾病(DN)微量白蛋白尿的影响及作用机制。方法早期DN患者随机分为水飞蓟素组和安慰剂组,每组30例,分别予以水飞蓟素胶囊和安慰剂治疗,实验前后测量患者血和尿丙二醛(MDA)、肿瘤坏死因子-α(TNF-α)、转化生长因子-β1(TGF-β1)、尿白蛋白排泄率(UAER)、血压及生化指标。结果12周后,两组患者血压及生化指标无明显变化;与安慰剂组比较,水飞蓟素组UAER显著下降,血和尿TNF-α、MDA显著降低,而血和尿TGF-β1比较差异无统计学意义。结论水飞蓟素胶囊可以通过抑制MDA、TNF-α,降低早期DN的UAER,是一种治疗早期DN的新药物。
水飞蓟素;糖尿病肾病;炎症;氧化应激;微量白蛋白尿
微量白蛋白尿是早期糖尿病肾病(diabetic nephropathy,DN)的主要特征之一。激活的肾素-血管紧张素系统(renin-angiotensin system,RAS)是早期DN的主要发病机制,RAS系统阻滞是当前早期DN的主要治疗方法。尽管RAS被抑制,但仍然有大量早期DN患者进展至临床蛋白尿,意味着除RAS系统外,还有早期DN的其他发病机制。氧化应激和炎症也被认为是早期DN的主要发病机制之一[1]。DN动物模型中,具有强大的抗氧化、抗炎及抗纤维化作用的水飞蓟素可以缓解蛋白尿和DN的进展[2]。目前水飞蓟素对早期DN患者微量白蛋白的影响鲜见报道,本实验研究水飞蓟素是否对早期DN患者微量白蛋白尿具有抑制作用,并探讨其机制。
1 资料与方法
1.1 一般资料
选取2013年10月-2014年10月在南华大学附属第一医院住院或定期门诊随访的DNⅢ期患者60例,尿白蛋白排泄率(urinary albumin excretion rate,UAER)持续20~200μg/min,血压、血糖及血脂控制理想。排除标准:①存在非DN的肾脏疾病依据;②正在使用RAS系统阻滞剂治疗;③难以控制的糖尿病,糖化血红蛋白(hemoglobin A1c,HbA1c)>10%;④难以控制的高血压,收缩压>160 mmHg,或舒张压>100 mmHg;⑤妊娠、吸烟及嗜酒;⑥使用其他抗氧化的药物,如维生素C、维生素E;⑦存在严重心脑血管疾病或其他严重疾病。本实验经本院伦理委员会通过,所有患者签署知情同意书。
1.2 方法
60例2型DN患者维持以前药物治疗不变,采用随机双盲安慰剂对照方法,计算机随机分为水飞蓟素组和安慰剂组,每组30例,两组患者年龄、性别、糖尿病病程、体重指数(body mass index,BMI)、血糖控制程度、高血压、血脂等方面比较,差异无统计学意义,有可比性。水飞蓟素组患者予以水飞蓟素胶囊140 mg,3次/d;安慰剂组患者接受同等剂量的安慰剂治疗。实验进行12周,在实验开始及结束时分别监测患者血压、血和尿丙二醛(Malondialdehyde,MDA)、血和尿肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、血和尿转化生长因子-β1(transforminggrowthfactorβ1,TGF-β1)、UAER及相关生化指标。
1.3 检测指标
空腹血糖(fasting plasma glucose,FPG)、低密度脂蛋白(low densith lipoprotein,LDL)、高密度脂蛋白(high density lipoprotein,HDL)及三酰甘油(triglyc eride,TG)用BECK全自动生化仪测定,HbA1c用高分辨层析柱法,尿白蛋白排泄率用化学发光法检测,血和尿TNF-α、TGF-β1用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测(美国R&D公司试剂盒),血和尿MDA按试剂盒说明书检测(购于南京建成生物工程研究所),标准袖带血压计测量患者清晨血压3次,取均值。
1.4 统计学方法
采用SPSS 13.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者实验前后的血糖、血脂、血压及BMI比较
所有患者未出现不良反应,均完成实验。实验前后,水飞蓟素组FPG、HbA1c、LDL、HDL、TG、收缩压、舒张压及BMI与安慰剂组比较,差异无统计学意义。实验前后,水飞蓟素组上述各项指标比较差异无统计学意义。实验前后,安慰剂组上述各项指标比较差异无统计学意义。见表1~3。
表1 两组患者实验前后的血糖比较(±s)
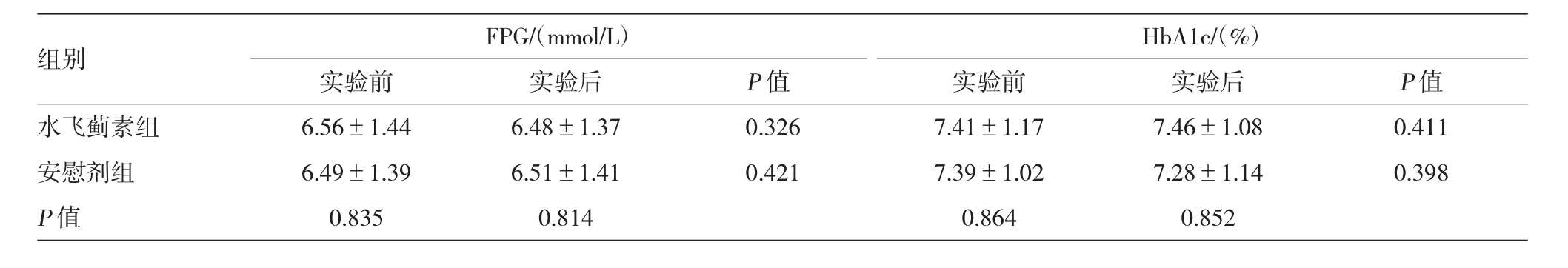
表1 两组患者实验前后的血糖比较(±s)
组别FPG/(mmol/L)HbA1c/(%)实验前实验后实验前实验后P值水飞蓟素组6.56±1.446.48±1.370.3267.41±1.1 77.46±1.080.411安慰剂组6.49±1.396.51±1.410.4217.39±1.027.28±1.1 40.398 P值0.8350.8140.8640.852 P值
2.2 两组患者实验前后的氧化应激、炎症、纤维化指标及UAER比较
实验前,两组血和尿MDA、血和尿TNF-α、血和尿TGF-β1及UAER比较,差异无统计学意义。实验后,水飞蓟素组血和尿MDA、血和尿TNF-α及UAER较实验前明显减少,血和尿TGF-β1较实验前减少,但差异无统计学意义;安慰剂组血和尿MDA、血和尿TNF-α、血和尿TGF-β1及UAER较实验前比较,差异无统计学意义。实验后水飞蓟素组与安慰剂组比较,血和尿MDA、血和尿TNF-α及UAER显著下降。见表4~6。
表2 两组患者实验前后的血脂比较(mmol/L±s)
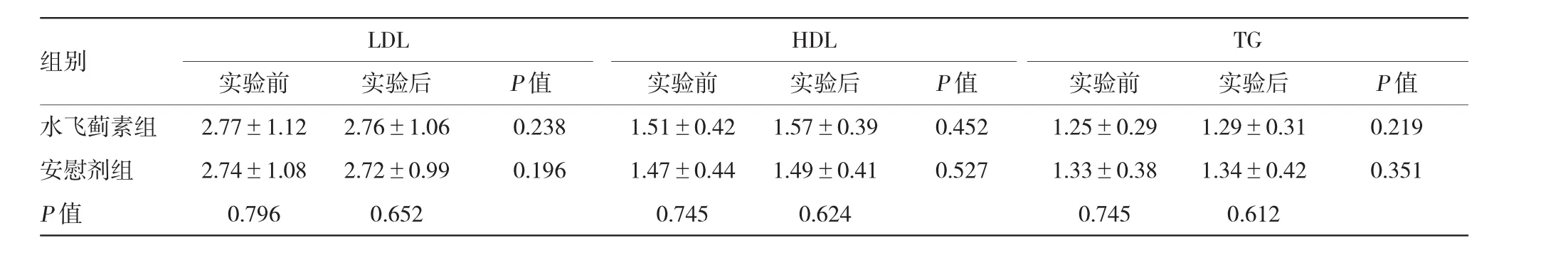
表2 两组患者实验前后的血脂比较(mmol/L±s)
组别LDLHDLTG实验前实验后实验前实验后实验前实验后P值水飞蓟素组2.77±1.1 22.76±1.060.2381.51±0.421.57±0.390.4521.25±0.291.29±0.310.219安慰剂组2.74±1.082.72±0.990.1961.47±0.441.49±0.410.5271.33±0.381.34±0.420.351 P值0.7960.6520.7450.6240.7450.612 P值P值
表3 两组患者实验前后的血压和BMI比较(±s)
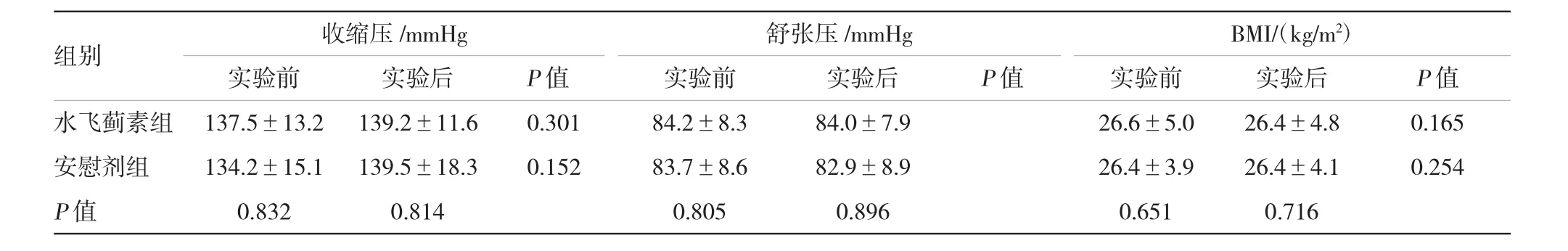
表3 两组患者实验前后的血压和BMI比较(±s)
组别收缩压/mmHg舒张压/mmHgBMI/(kg/m2)实验前实验后实验前实验后实验前实验后P值水飞蓟素组137.5±13.2139.2±11.60.30184.2±8.384.0±7.926.6±5.026.4±4.80.165安慰剂组134.2±15.1139.5±18.30.15283.7±8.682.9±8.926.4±3.926.4±4.10.254 P值0.8320.8140.8050.8960.6510.716 P值P值
表4 两组患者实验前后的氧化应激指标比较(±s)
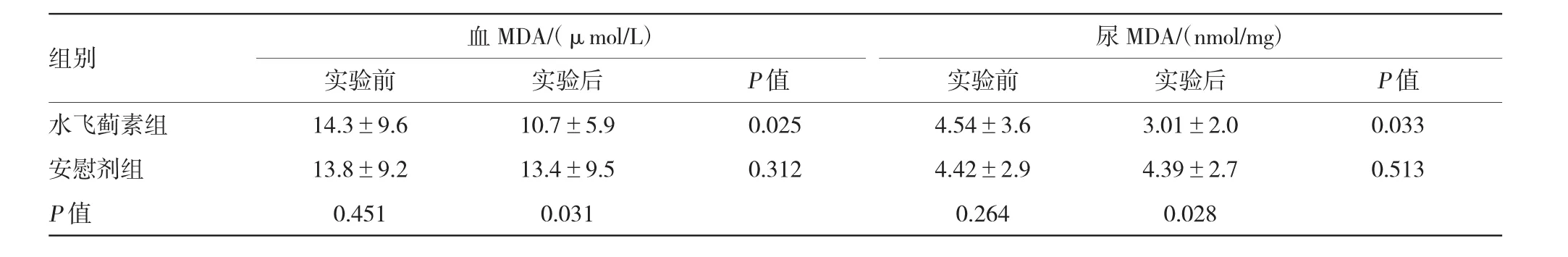
表4 两组患者实验前后的氧化应激指标比较(±s)
组别血MDA/(μmol/L)尿MDA/(nmol/mg)实验前实验后实验前实验后P值水飞蓟素组14.3±9.610.7±5.90.0254.54±3.63.01±2.00.033安慰剂组13.8±9.213.4±9.50.3124.42±2.94.39±2.70.513 P值0.4510.0310.2640.028 P值
表5 两组患者实验前后的炎症指标比较(pg/mgs)
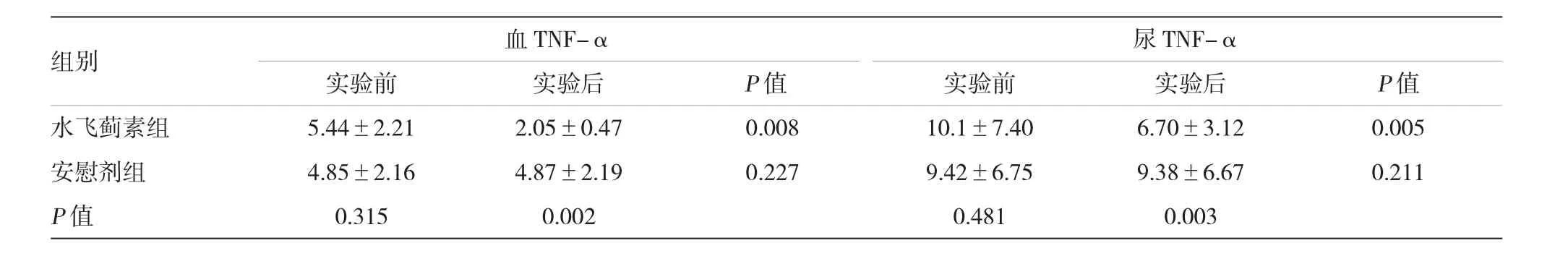
表5 两组患者实验前后的炎症指标比较(pg/mgs)
组别血TNF-α尿TNF-α实验前实验后实验前实验后P值水飞蓟素组5.44±2.212.05±0.470.00810.1±7.406.70±3.120.005安慰剂组4.85±2.1 64.87±2.1 90.2279.42±6.759.38±6.670.211 P值0.3150.0020.4810.003 P值
表6 两组患者实验前后的纤维化指标和UAER比较(±s)

表6 两组患者实验前后的纤维化指标和UAER比较(±s)
组别血TGF-β1/(ng/mL)尿TGF-β1/(pg/mg)UAER/(mg/24 h)实验前实验后实验前实验后实验前实验后P值水飞蓟素组19.8±7.719.2±7.10.08215.5±10.212.6±9.40.075138.14±67.1969.37±37.920.001安慰剂组18.7±6.719.3±7.20.31516.1±9.714.8±8.40.298132.81±65.24134.89±68.170.204 P值0.5370.6120.4610.3540.2830.002 P值P值
3 讨论
水飞蓟素是水飞蓟或奶蓟种子中的主要活性成分,是包含3种同分异构体(水飞蓟宾、异水飞蓟素和水飞蓟亭)的亲脂性提取物。其中水飞蓟宾活性最高,占水飞蓟素的50%~60%。从古代起,水飞蓟素就发挥其强大的抗氧化、抗炎及抗纤维化特性,并应用于一些疾病的治疗,尤其是肝病的治疗[3]。本研究中,实验前水飞蓟素组与安慰剂组FPG、HbA1c、LDL、HDL、TG、收缩压、舒张压及BMI比较,差异无统计学意义;实验前后两组患者上述指标组内比较,差异无统计学意义。水飞蓟素组与安慰剂组相比,UAER显著下降,表明其不是由更好的血流动力学及代谢控制。两组患者年龄、性别、糖尿病病程等指标比较,差异无统计学意义,可以排除该类因素对实验结果的影响。两组患者未使用维生素C、维生素E等抗氧化剂及RAS系统抑制剂,可以排除该药物对实验结果的干预。
DN的发病机制非常复杂,目前尚未完全阐明。血流动力学与代谢的紊乱,包括慢性高血糖、过多糖基化终产物诱导肾内反应性氧自由基及炎症介质产生,抑制抗氧化防御机制,造成肾损伤,最终肾纤维化[4]。TNF-α是介导DN发病机制中的重要炎症细胞因子之一[4]。已证实DN患者血和尿TNF-α水平较健康对照者或糖尿病非肾病患者明显升高,且DN患者血和尿TNF-α水平与蛋白尿水平及DN病程密切相关[5]。在动物和人的体外实验中,水飞蓟素可以抑制肾组织TNF-α的产生,并且该抑制作用是通过抑制NF-ΚB途径来实现[6]。本实验中,水飞蓟素组实验后血和尿TNF-α较实验前明显下降,实验后UAER较实验前明显降低,证明水飞蓟素胶囊通过抑制血和尿TNF-α降低UAER。
氧化应激被认为是DN的重要发病机制,氧化应激紊乱促进肾细胞凋亡、老化,钝化肾细胞再生能力,产生蛋白尿。大多数研究表明,抗氧化治疗可抑制DN患者的氧化应激作用而降低蛋白尿,改善肾功能[7]。DN动物模型中,各种氧化应激标志物明显升高,如DNA氧化破坏的标志物——8-羟脱氧鸟苷,脂质过氧化的标志物——MDA。据报道,DN患者的血和尿MDA较健康者或糖尿病非肾病患者明显升高,并且与DN患者肾小球硬化和蛋白尿程度关系密切,呈正相关[8]。对于糖尿病并肝硬化患者,水飞蓟素可以显著降低血MDA水平[9]。在糖尿病动物模型中,水飞蓟素可通过降低氧化应激标志物及恢复抗氧化酶的活性,阻止DN的进展[10],而且水飞蓟素可以抑制糖基化终产物在糖尿病大鼠肾脏的形成及沉积[6]。本实验发现,水飞蓟素胶囊显著地降低早期DN患者血和尿MDA水平并明显减少UAER,表明抑制氧化应激诱导的肾脏损害可能是水飞蓟素缓解早期DN患者蛋白尿的另一重要机制。
TGF-β1是细胞外基质的强力诱导者,通常被认为是DN发病机制中的中枢调节者,其主要介导肾小球硬化及肾间质纤维化[11]。有证据表明,DN患者血和尿TGF-β1水平明显升高与蛋白尿程度及DN病程呈正相关[12]。据报道,一些新的治疗降低DN患者蛋白尿水平的同时,也降低TGF-β1的水平[13],DN患者蛋白尿水平的下降幅度与TGF-β1降低程度呈正相关。本实验发现,水飞蓟素组血和尿TGF-β1水平较实验前降低,但差异无统计学意义。由于本实验样本量小,观察周期较短,水飞蓟素胶囊对于早期DN患者血和尿TGF-β1的影响还需大样本、较长周期的进一步研究。
[1]SINGH DK,WINOCOUR P,FARRINGTON K.Oxidative stress in early diabetic nephropathy:fueling the fire[J].Nat Rev Endocrinol,2011,7(3):176-184.
[2]KAUR G,ATHAR M,ALAM MS.Diatary supplementation of silymarin protects against chemically induced nephrotoxicity,inflammation and renal tumor promotion response[J].Invest New Drugs,2010,28(5):703-713.
[3]ABENAVOLI L,CAPASSO R,MILIC N,et al.Milk thistle in liver diseases:past,present,future[J].Phytother Res,2010,24(10): 1423-1432.
[4]NAVARRO-GONZALEZJF,MORA-FERNANDEZC,DE FUENTES MM,et al.Inflammatory molecules and pathways in the pathogenesis of diabetic nephropathy[J].Nat Rev Nephrol, 2011,7(6):327-340.
[5]FALLAHZADEN MK,DORMANESH B,SAQHEB MM,et al. Effect of addition of silymarin to renin-angiotens in system inhibitors on proteinuria in type 2 diabetic patients with overt nephropathy:a randomized,double-blind,placebo-controlled trial [J].Am J Kidney Dis,2012,60(6):896-903.
[6]WU CH,HUANG SM,YEN GC.Silymarin:a novel antioxidant with antiglycation and antiinflammatory properties in vitro and in vivo[J].Antioxid Redox Signal,2011,14(3):353-366.
[7]SMALL DM,COOMBES JS,BENNETT N,et al.Oxidative strss, anti-oxidant therapies and chronic kidney disease[J].Nephrology, 2012,17(4):311-321.
[8]RASHIDI A,NAKHJAVANI M,ESTEGHAMATI A,et al.Association between oxidant/antioxidantmarkers andproteinuria in type 2 diabetes:results in 142 patients[J].J Nephrol,2009,22(6): 733-738.
[9]FEHER P,UIHELVI Z,VECSERNYES M,et al.Hepatoprotective effects of a self-micro emulsifying drug delivery system containing Silybum marianum native seed oil against experimentally induced liver injury[J].Pharmazie,2015,70(4):231-238.
[10]SOTO C,PEREZ J,GARCIA V,et al.Effect of silymarin on kidney of rats suffering from alloxan-induced diabetes mellitus[J]. Phytomedicine,2010,17(14):1090-1094.
[11]TURGUT F,BOLTON WK.Potential new therapeutic agents for diabetic kidney disease[J].Am J Kidney Dis,2010,55(5):928-940.
[12]XIE S,LU K,ZHANG Y,et al.Effects of Jiangya xiaoke prescription on TGF-β1in diabetic nephropathy rats with hypertension and its mechanisms[J].Int J Clin Expmed,2015,8(4): 1519-1536.
[13]KHAJEHDEHI P,PAKFETRAT M,JAVIDNIA K,et al.Oral supplementation of turmeric attenuates proteinuria,transforming growth factor-β and interleukin-8 levels in patients with overt type 2 diabetic nephropathy:a randomized,double-blind and placebo-controlled study[J].Scand J Urol Nephrol,2011,45(5): 365-370.
(申海菊 编辑)
Effect of Silymarin capsules on microalbuminuria of early diabetic nephropathy
Li LI1,Qing-song WAN2,Hong-ping XIE2,Bo YANG2
(1.Department of Nursing,Hunan Environment-Biological Polytechnic,Hengyang,Hunan 421005,P.R.China;2.Department of Nephrology,the First Affiliated Hospital, University of South China,Hengyang,Hunan 421001,P.R.China)
【Objective】To investigate the effect of Silymarin capsules on microalbuminuria of early diabetic nephropathy and the mechanism.【Methods】Sixty early diabetic patients with nephropathy were randomly devided into Silymarin group and placebo group,which were treated with Silymarin capsules and matched placebo respectively.Serum and urinary levels of tumor necrosis factor-α(TNF-α),malondialdehyde (MDA),transforming growth factor-β1(TGF-β1),urinary albumin execretion rate(UAER),blood pressure and biochemical parameters were measured from baseline to the end of the treatment phase.【Results】After twelve weeks,there were no distinct changes in blood pressure or biochemical parameters in either group. UAER and serum and urinary levels of TNF-α and MDA significantly decreased in the Silymarin group compared with the placebo group;while there were no distinct differences in urinary and serum levels of TGF-β1between both groups.【Conclusion】Silymarin capsules reduce UAER by inhibiting MDA and TNF-α and may be considered as a novel drug in patients with early diabetic nephropathy.
Silymarin;diabetic nephropathy;inflammation;oxidative stress;microalbuminuria
R587.2
A
1005-8982(2015)29-0059-004
2015-05-04

