犬弓首蛔虫线粒体cox1基因的克隆及序列分析
梁 轩,刘 毅
(湖南农业大学动物医学院,湖南长沙 410128)
犬弓首蛔虫线粒体cox1基因的克隆及序列分析
梁 轩,刘 毅
(湖南农业大学动物医学院,湖南长沙 410128)
本研究旨在阐明我国犬弓首蛔虫(Toxocara canis)湖南分离株线粒体细胞色素c氧化酶第I亚基(cox1)基因部分序列(pcox1)的遗传变异情况,并用其与其它弓首蛔虫的pcox1序列构建进化关系。应用PCR扩增犬弓首蛔虫虫株的pcox1,将所获得的序列应用Mafft 7.122程序进行比对,然后用PhyML 3.1程序ML法绘制种系发育树。本实验扩增所获得的pcox1序列长度一致,均为394 bp,种内变异在0~2.5%之间,种间差异为8.2%~11.6%。种系发育分析结果表明,12个犬弓首蛔虫分离株位于同一分支。由于犬弓首蛔虫pcox1序列种内相对保守,种间差异较大,故可作为种间鉴定检测研究的遗传标记,本研究结果为犬弓首蛔虫的分类、鉴定和群体遗传结构奠定了基础。
犬弓首蛔虫;线粒体DNA;cox1基因;种系发育关系
犬弓首蛔虫是世界性分布的寄生虫线虫,主要感染犬和其他犬科动物,可引起犬弓首蛔虫病。据调查,国外犬弓首蛔虫感染率为5.5%~64.7%[1-2];我国中西部地区犬的感染率较高,而东部地区犬的感染率相对较低[3-4]。弓首蛔虫卵在感染非特异性宿主后(包括人),其幼虫可以长期在组织器官中移行,可引起内脏幼虫移行症(VLM)、眼睛幼虫移行症(OLM)和非化脓性脑膜脑炎等,导致严重的病理综合症[5-6]。因此,正确鉴定蛔虫种类,不仅具有重要学术价值,而且对预防和控制该病也具有重要意义。
一些研究表明:使用核糖体DNA(rDNA)内转录间隔区(ITS-1和ITS-2)序列作为分子标记可以准确鉴定犬弓首蛔虫、猫弓首蛔虫和狮弓首蛔虫[7-8]。但Blouin认为,利用线粒体DNA(mtDNA)
的线粒体cox1基因作为遗传标记来鉴定线虫种,尤其是隐藏种更为有效[9]。线粒体DNA 作为胞核外遗传物质具有分子量小、结构简单、进化速度快、母性遗传、无组织特异性等特点,是研究寄生虫分子分类、群体遗传、系统进化的一种很好的分子标记[10]。线粒体cox1基因作遗传标记对其他蛔虫(比如人、猪蛔虫)进行系统发生、群体遗传研究、虫种及虫株鉴定已有较多报道[11-13],但对弓首蛔虫的研究报道则相对较少[14]。
本研究以从湖南不同地区犬采集的犬弓首蛔虫作为研究对象,PCR扩增其线粒体线粒体细胞色素c氧化酶第I亚基(cox1)基因部分序列(pcox1)并进行分析,从而明确犬弓首蛔虫线粒体cox1基因部分序列能否成为理想的种间遗传标记,旨在为今后犬弓首蛔虫的分类、鉴别诊断及本病的防制等更深入的研究奠定基础。
1 材料与方法
1.1 虫体样品
本试验研究的11条犬弓首蛔虫样品采自湖南省益阳市,具体信息见表1。

表1 本试验所用犬弓首蛔虫样品
1.2 主要试剂
rTaq酶 及 PCR试 剂(Buffer、MgCl2、dNTPs)购自大连宝生物公司;蛋白酶K购自Merck公 司;TIANamp Genomic DNA Kit购 自Tiangen公司。
1.3 样品DNA的制备
从70%的酒精保存液中取单个虫体,用双蒸水反复吹打冲洗3次后,置于一新的1.5 mL Eppendorf管中,用灭菌的微型剪刀将虫体组织剪碎,加入200μL GA Buffer反复研磨,再加20μL蛋白酶K,混匀后,置60 ℃恒温水浴箱消化1~3 h(每30 min混匀一次)。消化好的虫体悬液按TIANamp Genomic DNA Kit使用说明进行虫体DNA提取,DNA样品分装后置-20 ℃冰箱保存备用。
1.4 PCR扩增
采 用 引 物JB3和JB4.5[15]来 扩 增 犬 弓首蛔虫线粒体pcox1,引物序列为JB3:'-TTTTTTGGGCATCCTGAGGTTTAT-3';JB4.5:'-TAAAGAAAGAACATAATGAAAATG-3', 引 物由海生工生物科技有限公司合成。扩增体系为25μL:双蒸水14.25μL、10×PCR Buffer 2.5μL、MgCl2(25 mmol/L)3μL、dNTPs(2.5 mmol/L)2μL、上下游引物(50 pmol/μL)各0.5μL、rTaq酶(5 U/μL)0.25μL、模板DNA 2μL。反应在BIO-RAD循环反应仪上进行,扩增条件为:94 ℃预变性5 min;94 ℃变性30 s,45 ℃退火30 s,72 ℃延伸1 min,共35个循环;最后72 ℃延伸5 min。取5μL PCR产物在1%TAE琼脂糖凝胶电泳,用Good View Nucleic Acid Stain染色,紫外投射仪下观察结果,凝胶成像系统摄像。
1.5 cox1部分基因序列测定及其在种系发育分析中的应用
将PCR产物送上海生工生物科技有限公司直接测序,测序结果用DNAStar 5.0软件进行分析。从GenBank检索现有弓首蛔虫cox1序列,然后与之进行相似性比对和种系发育分析,以猪蛔虫(Ascaris suum,NC_001327)作为外群,利用Mafft 7.122及Mega 5.0软件对获得的序列和Gen-Bank的弓首蛔虫cox1部分序列进行比对及计算遗传距离,然后用PhyML 3.1程序中的最大似然法(Maximum likelihood,ML)绘制种系发育树,采用MtArt+I+G模型进行分析。
2 结果与分析
2.1 PCR扩增结果
11个样品均成功地扩增出约450 bp的片段,与预期pcox1目的片段长度相符,且无非特异性条带,空白对照为阴性(图1)。
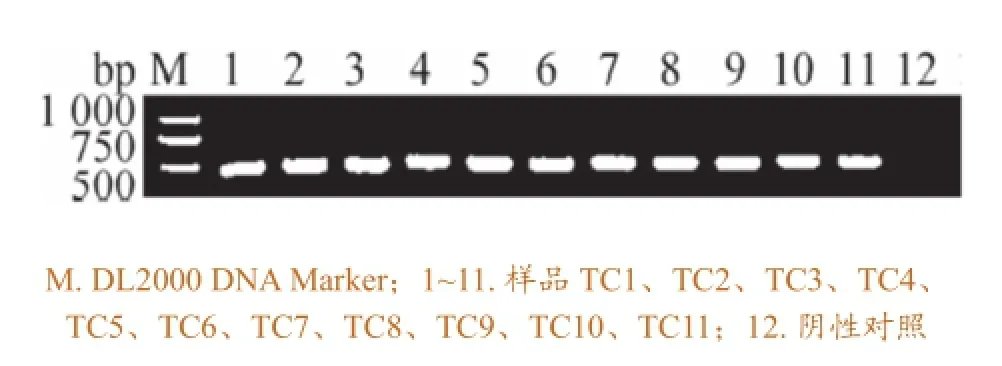
图1 犬弓首蛔虫线粒体pcox1 PCR扩增产物的琼脂糖电泳分析
2.2 测序结果及分析 11个样品pcox1碱基序列长度相同,均为460bp,剔除引物和不准确序列后,均得到394bp的序列。pcox1序列的A、G、T、C 碱基平均含量分别为41.5%、15.3%、28.4%和14.8%,A+T含量(69.9%)明显高于G+C含量(30.1%)。对犬弓首蛔虫11个不同个体的pcox1序列进行种内比较,结果显示,pcox1基因序列变异碱基数总共为10个,变异率在0~2.5%之间,其中第1位密码子变异2个,第2位密码子变异3个,第3位密码子变异5个。弓首蛔虫pcox1基因序列的种间分析显示,pcox1序列犬弓首蛔虫种间存在比较大的差异,差异率在8.2%~11.6%之间。
2.3 犬弓首蛔虫cox1基因序列系统发生树
采用ML法建树方法构建弓首蛔虫的系统发生树(图2),发现犬弓首蛔虫广东分离株具有高度同源性,位于同一大分枝,系统发生树中的Bootstrap值较高。犬弓首蛔虫广东分离株所属分枝与其他弓首蛔虫所属分枝相隔较远,得到了很好地鉴别。
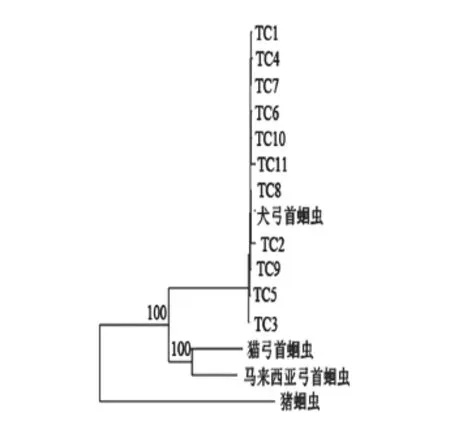
图2 基于pcox1基因序列以ML法所构建的弓首蛔虫系统进化树
3 讨论
在寄生虫的传统分类鉴定研究中常采用形态学鉴定方法,但这种方法有其局限性,比如难以区分由于自然、地理等生态环境因素引起的虫株遗传变化。将虫种DNA经过PCR扩增后,再进行序列分析是目前发展最快的一种分类鉴定寄生虫的分子生物学方法。线粒体DNA由于其进化速度快,母性遗传,基因间不发生重组,可以反映出母系的进化史等特点,非常适合作为分子标记进行种系发育研究。其中,cox1基因进化速率较快,适合用于遗传变异、分类和分子种系发生的研究。因此,在寄生虫的分类鉴定和群体遗传方面,许多学者研究认为cox1基因序列是理想的遗传标记[15-18]。
本研究对湖南省益阳市4个地区的犬弓首蛔虫的cox1基因序列进行遗传变异分析发现,种内变异没有区域性特点。研究结果显示,犬弓首蛔虫各湖南分离株之间cox1基因序列的相似性均在97%以上,湖南分离株与GenBank中其他蛔虫相应序列的相似度均低于92%。犬弓首蛔虫种间的差异(8.2%~11.6%)远远大于犬弓首蛔虫种内的变异(0~2.5%),说明pcox1能为种间的遗传变异研究提供遗传标记,可用于犬弓首蛔虫的种间鉴定检测,符合先前的研究[8,14]。此外,本研究采用ML法构建的进化树显示出犬弓首蛔虫湖南分离株位于同一大分枝,系统发生树中的Bootstrap值较高,犬弓首蛔虫湖南分离株所属分枝与其他弓首蛔虫所属分枝相隔较远,得到了很好的区别。本试验系首次研究了犬弓首蛔虫湖南分离株的pcox1序列变异,发现犬弓首蛔虫pcox1序列种内变异较小,种间差异很大,是较理想的犬弓首蛔虫种间鉴定检测标记。
[1] Habluetzel A,Traldi G,Ruggieri S,et al. An estimation of Toxocara canis prevalence in dogs,environmental egg contamination and risk of human infection in the Marche region of Italy[J]. Vet Parasitol,2003,113:243-252.
[2] Minnaar W N,Krecek R C,Fourie L J. Helminths in dogs from a peri-urban resource-limited community in Free State Province,South Africa[J]. Vet Parasitol,2002,107:343-349.
[3] 董婕,朱磊,陈前波,等. 上海地区家犬肠道线虫感染的调查[J]. 中国人兽共患病杂志,2001,17(1):113.
[4] 姜红. 安徽泗县犬寄生虫感染情况调查[J]. 中国兽医寄
生虫病,2003,11(1):59 -60.
[5] Ahmed M A,Levkut M,Revajová V,et al. Larval toxocarosis in sheep:the immunohistochemical characterization of lesions in some affected organs[J]. Vet Parasitol,2002,105:207 -214.
[6] Akao N,Tomoda I,Hayashi E,et al. Cerebellar ataxia due to Toxocara infection in Mongolian gerbils,Meriones unguiculatus[J]. Vet Parasitol,2003,113:229 -237.
[7] Jacobs D E,Zhu X Q,Gasser R B,et al. PCR-based methods for identification of potentially zoonotic ascaridoid parasites of the dog,fox and cat[J]. Acta Tropica,1997,68:191 -200.
[8] 周荣琼,夏庆友,黄汉成,等. 犬弓首蛔虫ITS1基因的克隆及序列分析[J]. 中国预防兽医学报,2010,32(10):818 -820.
[9] Blouin M S. Molecular prospecting for cryptic species of nematodes:Mitochondrial DNA versus internal transcribed spacer[J]. Int J Parasitol,2002,32(5):527 -531.
[10] McManus D P,Bowles J.Molecular genetics approaches to parasite identification:Their value in diagnostic parasitology and systematics[J]. Int J Parasitol,1996,26(7):687 -704.
[11] Cavallero S,Snabel V,Pacella F,et al. Phylogeographical studies of Ascaris spp. based on ribosomal and mitochondrial DNA sequences[J]. PLoS Negl Trop Dis. 2013,7(4):e2170.
[12] Iñiguez AM,Leles D,Jaeger LH,et al. Genetic characterisation and molecular epidemiology of Ascaris spp. from humans and pigs in Brazil[J]. Trans R Soc Trop Med Hyg,2012,106(10):604 -612.
[13] Li MW,Lin RQ,Song HQ,et al. Electrophoretic analysis of sequence variability in three mitochondrial DNA regions for ascaridoid parasites of human and animal health significance[J]. Electrophoresis,2008,29(13):2912 -2917.
[14] Zhou C,Li M,Yuan K,et al. Phylogeography of Ascaris lumbricoides and A. suum from China[J]. Parasitol Res. 2011,109(2):329 -338.
[15] 王燕,刘国华,李佳缘,等. 中华双腔吸虫线粒体cox1基因的克隆及序列分析[J]. 中国畜牧兽医,2012,39(5):118 -120.
[16] 李淼,蔡丝丝,姚明锐,等. 湖南省鸡蛔虫线粒体cox1基因序列的测定及分析[J]. 现代农业科技,2012,4:321 -325.
[17] 刘伟,刘毅,林瑞庆,等. 日本血吸虫线粒体cox1基因部分序列的多态性研究[J].中国寄生虫学与寄生虫病杂志,2008,4(26):152 -153.
[18] 伍慧兰. 猬裂头蚴线粒体cox1基因的克隆及序列分析[J].动物医学进展,2010,31(12):61 -63.
Analysis of Sequence Variation in Mitochondrial cox1 Gene of Toxocara canis Isolates in China
Liang Xuan,Liu Yi
(College of Veterinary Medicine,Hunan Agricultural University,Changsha,Hunan 410128)
The objective of the study was to analyze sequence variation in the cytochrome c oxidase subunit 1(cox1)gene among Toxocara canis isolates from Hunan province and to study its phylogenetic relationship with other roundworms using the cox1 gene sequencing. The partial cox1(pcox1)were amplifi ed from individual T. canis samples,and pcox1 sequences were aligned using the Mafft 7.122. Maximum likelihood(ML)trees were constructed using the software PhyML 3.1. The lengths of all pcox1 sequences were 394bp. Sequence variations in pcox1 sequences within T. canis were 0~2.5% which was signifi cantly lower than inter-species differences(8.2%~11.6%). Phylogenetic analyses showed that all T. canis isolates were clustered in the same clade. It was concluded that pcox1 sequence could be used as genetic marker for population genetic studies of T. canis,as well as genetic marker for the differentiation and identifi cation of different roundworms. The study provided foundation for further studies on molecular genetics and diagnosis of T. canis.
Toxocara canis;mitochondrial DNA;cox1 gene;phylogenetic relationship
S852.731
A
1005-944X(2015)03-0066-04
刘 毅

