致犊牛腹泻大肠杆菌的分离鉴定及药敏试验
马长宾,陈文武,王忠山,崔 蕾,郭 文,张子荣
(新疆建设兵团第六师五家渠市畜牧兽医工作站,新疆五家渠市 831300)
致犊牛腹泻大肠杆菌的分离鉴定及药敏试验
马长宾,陈文武,王忠山,崔 蕾,郭 文,张子荣
(新疆建设兵团第六师五家渠市畜牧兽医工作站,新疆五家渠市 831300)
[目的]了解新疆第六师规模奶牛场犊牛腹泻大肠杆菌致病性、血清型分布及药物敏感性。[方法]对从第六师部分奶牛场采集的296份腹泻犊牛肛拭样品,进行了鉴别培养、一系列生化试验、血清型鉴定、药敏试验等。[结果]分离到的192株埃希氏大肠杆菌中,表现β型溶血的83株;83株β型溶血大肠杆菌中,造成小鼠发病死亡的74株;对头孢他啶、阿奇霉素、诺氟沙星、恩诺沙星、氟苯尼考敏感性分别为100%、85.14%、70.27%、64.86%、63.51%;101团、103团、共青团农场、军户农场、奇台农场优势血清型分别为O101、O78、O141、O44、O15。[结论]该地区分离出的致病性大肠杆菌对头孢他啶、阿奇霉素、诺氟沙星、恩诺沙星、氟苯尼考有较大的敏感性,对其他抗生素均产生不同程度的耐药性,不同地区具有不同的优势血清型。
犊牛腹泻;大肠杆菌;生化鉴定;致病性;药物敏感性
近几年来,随着养牛业规模扩大和集约化生产程度的提高,犊牛腹泻的发病率和死亡率也呈上升趋势[1]。犊牛腹泻(又称为犊牛白痢)是犊牛常见的一种临床疾病,其中由致病性大肠杆菌引起的占90%[2]。新生犊牛多表现为暴发性腹泻,病程短、死亡率高,确诊困难,往往在一个时期内发病率可达80%,给养牛业带来较大的经济损失[3]。目前,对犊牛腹泻病的治疗,主要采用抗生素治疗并结合支持疗法,虽然具有较好疗效,但易产生耐药性及畜产品药物残留超标等,易引起食品安全和公共卫生问题[4],因此,迫切需要对犊牛腹泻大肠杆菌及其耐药情况进行检测。
当前,新疆牛源大肠杆菌分离鉴定及耐药情况
检测已陆续展开,喻华英等[5]研究报道,新疆部分地区引起犊牛腹泻大肠杆菌优势血清型均存在地域差异,夏利宁等[6]和南海辰等[7]对不同地区牛场大肠杆菌对临床常用抗菌药物的耐药情况进行检测,结果发现不同地域牛源大肠杆菌耐药情况有较大的差异,郝彦龙[8]等分离的致病性大肠杆菌,产生典型的β溶血的占分离株的60.29%,喻华英等、郝彦龙等和元振杰等[9]从大肠杆菌血清型、粘附素及肠毒素测定、对小鼠致病性等方面,研究了致犊牛腹泻大肠杆菌的致病性。而新疆生产建设兵团第六师规模化奶牛场犊牛腹泻大肠杆菌的致病性、血清型分布及耐药情况却鲜见报道,致病情况、耐药情况及优势血清型不明。本试验主要通过对临床上犊牛腹泻病例进行细菌分离鉴定及药物敏感试验,测定分析不同来源大肠杆菌致病性和常用抗菌素的敏感性以及血清型,掌握规模化奶牛场犊牛腹泻大肠杆菌的耐药情况及血清型分布,获取的耐药性数据及优势血清型可指导该地区养殖场临床合理用药及自家灭活苗的研制。
1 材料及方法
1.1 材料
1.1.1 病料采集。从新疆西部准格尔牧业、101团、奇台农场、军户农场、103团农场等地部分规模化牛场采集腹泻犊牛肛拭,共296份。
1.1.2 主要仪器设备。生物安全柜、恒温培养箱、显微镜、无菌操作台等。
1.1.3 主要药品和试剂。大肠埃希氏菌ATCC 25922标准菌株、 磷酸对硝基苯酚,盐酸二甲基对苯撑二胺,a-甲基-D葡萄糖甙,L-A-赖氨酸等均购自Sigma公司,其他试剂均为国产分析提纯;大肠杆菌科11种常规抗生素药敏纸片和生化微量发酵管均购自杭州天和微生物试剂有限公司;大肠杆菌标准抗“O”血清购自中国兽医药品监察所。
1.1.4 细菌分离及生化鉴定培养基。普通营养琼脂平板、普通营养肉汤、5%兔鲜血营养琼脂平板、麦康凯琼脂平板、伊红美蓝琼脂平板自行配制;氧化酶试验纸片、苯丙氨酸脱氨酶、赖氨酸脱羧酶培养基均参照文献[10]方法制备。
1.1.5 健康小白鼠购自新疆医科大学动物实验室,共300只,公母各半。
1.2 方法
1.2.1 受检菌株分离鉴定。将采集的犊牛肛拭,放入内含1mL灭菌营养肉汤的EP管中,37℃恒温培养18-24h,用接种环将菌液接种于麦康凯琼脂平板,37℃培养18-24h,再从麦康凯琼脂平板上挑取孤立的红色菌落,接种于伊红美兰平板,再从伊红美兰平板上挑取单个黑色金属光泽的菌落。疑似菌株经革兰氏染色及生化鉴定后,确定为大肠杆菌者保存备用。
1.2.2 溶血及动物致病性实验。将分离鉴定出来的埃希氏大肠杆菌单个菌落无菌接种于5%兔血平板,置于37℃温箱中培养18~24h后,观察并记录溶血情况;将溶血实验中呈现β型溶血的所有菌株分别接种普通斜面,37℃培养18 h,然后用PBS洗脱,并用麦氏比浊管确定菌液浓度为3×108个细菌/mL,腹腔接种于4只健康小白鼠(公母各半),每只接种0.5 mL,同时设1只健康小白鼠注射等量无菌PBS液作为对照。接种后观察并记录小鼠在72 h内的变化情况,如小鼠发生死亡,则从小鼠心、肝、脾等脏器分离回收细菌。
1.2.3 药物敏感性试验。将分离鉴定后确定为致病性大肠杆菌的菌落无菌接种于营养肉汤37℃摇床培养18h,用生理盐水校正至0.5麦氏单位标准比浊管相同,备用;在15 min内,用无菌棉拭子蘸取菌液涂布于烘干好的MH琼脂平板整个表面,反复涂布均匀。用灭菌的镊子贴药敏纸片,要求纸片之间中心距离不小于24 mm,纸片边距平皿边不小于15 mm[11],置37℃温箱,培养24h后测量抑菌环直径(单位为mm),结果按照NCCLS药敏试验国际标准(第8版)进行判定[12]。
1.2.4 血清型鉴定。对初步鉴定为致病性埃希氏大肠杆菌的菌株,培养处理制成凝集抗原,分别与O抗原定型血清进行试管凝集试验,并按规定标准判定其血清型。
2 结果及分析
2.1 受检菌株分离鉴定结果
根据病原菌的形态特性(图1)、生长特性(图2),确定所分离到的296株菌中有241株均为疑似大肠杆菌。 参照《常见细菌系统鉴定手册》及《伯杰细菌鉴定手册》要求[10,13],将241株红色菌落中的细菌,分别进行生化试验,有14株产H2S,9株VP试验为阳性,26株吲哚试验为阴性,予以剔除;其余菌株(192株)均能发酵乳糖,产酸,均不产生H2S,符合大肠杆菌的生化特性。(详见表1)
图1 大肠杆菌革兰氏染色的镜检形态(10×100)

图2 麦康凯平板上菌落形态
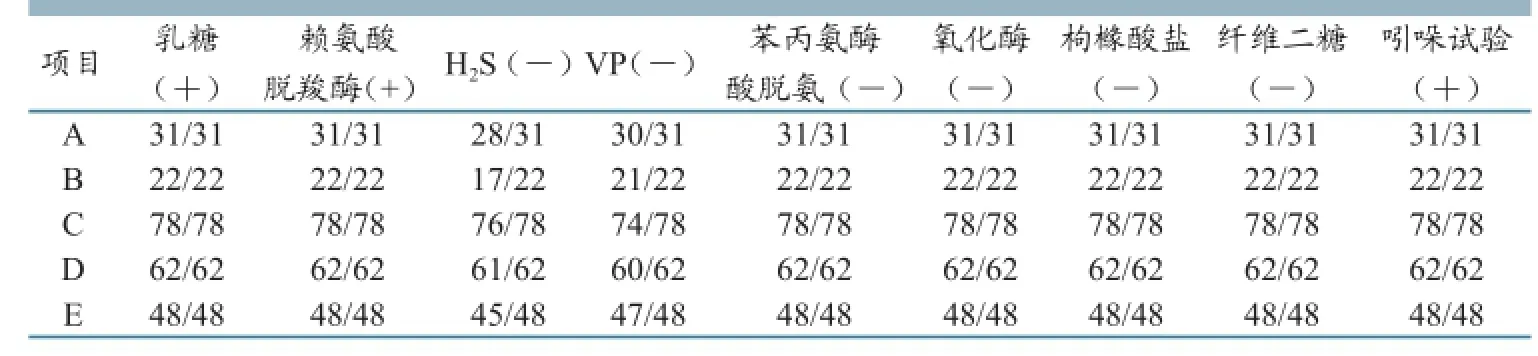
表1 受检疑似大肠杆菌生化试验结果
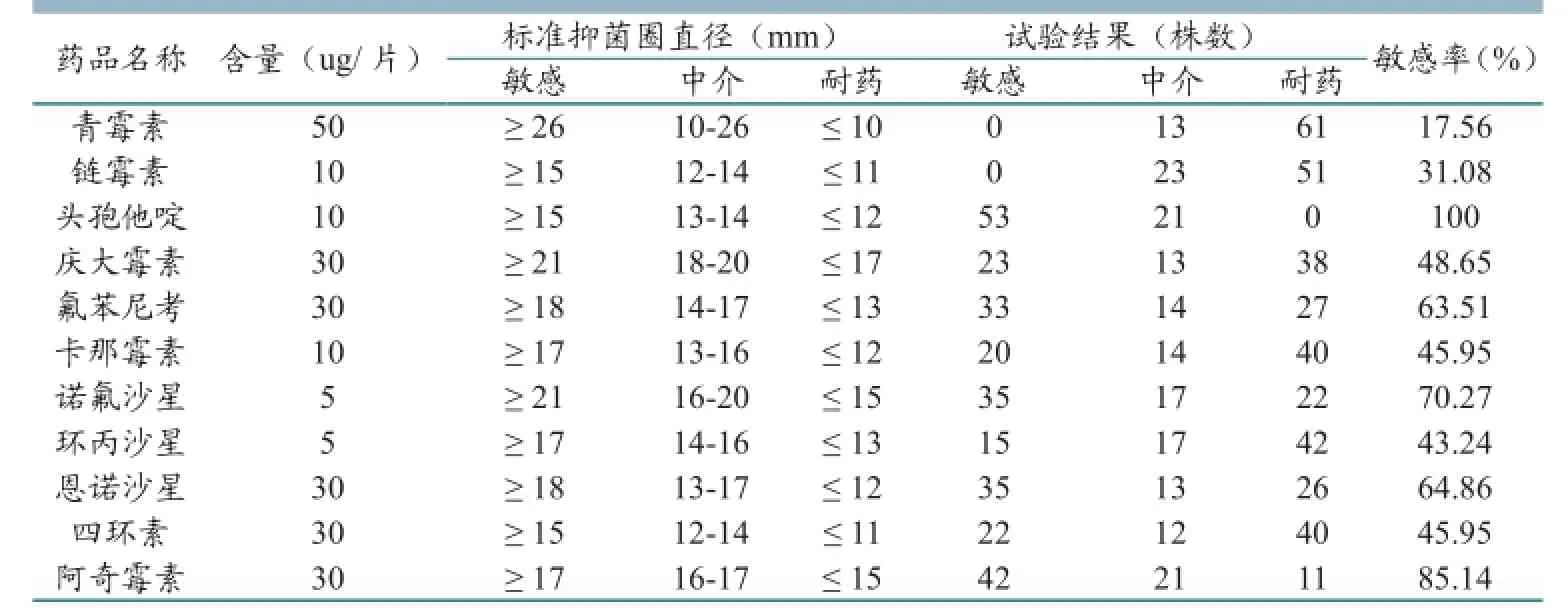
表2 致犊牛腹泻大肠杆菌药物敏感性试验结果
2.2 受检菌溶血特征及小鼠致病性试验结果
将生化鉴定的192株菌落接种于5%兔全血琼脂平板,进行提纯37℃培养24h后,观察到中等大小、凸起、边缘整齐、表面光滑、湿润的乳白色菌落,有83株菌表现为β型溶血,周围出现明显的透明溶菌环。选取83株有典型β型溶血的埃希氏大肠杆菌接种小白鼠,实验结果显示:有89.2%(74/83)的菌株能致各试验组健康小白鼠在18~72h全部死亡,剖检死亡小鼠,其肝脏或肠出现严重出血,脾有梗死,而对照组小鼠没有异常反应,健活。无菌取病变肝脏或肠管作细菌分离、鉴定,回收得到的细菌培养特性、形态、生化反应均符合大肠杆菌的特性。
2.3 药物敏感性试验结果
从鉴定出的192株大肠杆菌中,挑取74株致病性大肠杆菌做了药敏试验,所检测出来的大肠杆菌100%敏感的药物只有头孢他啶,敏感率≥50%的由高到低依次是头孢他啶(100%)、阿奇霉素(85.14%)、诺氟沙星(70.27%)、恩诺沙星(64.86%)、氟苯尼考(63.51%),其余的均有不同程度的耐药。(详见表2)
2.4 新疆第六师不同地区致犊牛腹泻大肠杆菌O抗原血清型
分离鉴定的74株致病性大肠杆菌,涵盖了18种病原性大肠杆菌O抗原血清型。各个地区致犊牛腹泻大肠杆菌O抗原血清型的种类较多,但基本都有主要的优势血清型,101团、103团、共青团农场、军户农场、奇台农场优势血清型分别为O101、O78、O141、O44、O15。(详见表3)
3 讨论与小结

表3 新疆第六师不同地区致犊牛腹泻大肠杆菌O抗原血清型分布表
3.1 致犊牛腹泻大肠杆菌对肠杆菌科11种常规抗生素药敏试验结果显示,头孢他啶敏感率为100%,这说明本实验分离的犊牛致病性大肠杆菌菌株,对头孢类药物无耐药性,这与元振杰等[9]报道一致,而与方光远等[2]报道相反,原因可能与奶牛场长期使用抗生素有关。Tadesse等[14]报道了人和各种畜禽大肠杆菌耐药性的产生与长期使用各种抗生素有关。本实验药敏试验结果还显示,11种临床常用抗菌素,除头孢他啶、阿奇霉素、诺氟沙星表现出较强的抑菌性,其余都有不同程度的耐药性,抑菌效果相对较弱。这些耐药性的产生可能与这些奶牛场近年来的预防和治疗用药习惯有关。因此,各个牛场,特别是规模奶牛场,应配备技术过硬的兽医技术人员,同时,还应增强合理用药、科学管理的意识,不断提高用药技能,避免病原菌耐药性的产生,才能从根本上解决问题,降低发病率,降低经济损失。
3.2 致病性大肠杆菌和非致病性大肠杆菌在培养特性和生化反应等方面相似,但致病性大肠杆菌具有特殊的血清型、肠毒素或毒力因子,其溶血性及对实验动物致病性也是其致病性特性。郝彦龙等[8]报道,大多数能表达F41和K99的致犊牛腹泻大肠杆菌能产生溶血,它们能在含有动物血的平板上于菌落周围呈现典型的β溶血环,尽管溶血性可用于肠毒素大肠埃希菌的初步筛选,但还有近10%的溶血大肠杆菌对小白鼠没有致病性。本实验中呈典型β溶血占分离大肠杆菌菌株的44%(83/192),同时发现有89.92%(74/83)分离株有明显的β溶血环,可致小鼠死亡[15-16]。本实验通过对分离大肠杆菌血清型、溶血性及对试验动物致病性,对致病性大肠杆菌进行了鉴定,但还需通过测定分离菌株黏附素及肠毒素基因片段,来进一步研究大肠杆菌致病性与溶血性的相关性。因此,致病性大肠杆菌的鉴定,应在常规培养和生化鉴定的基础上结合动物实验,有条件的情况下,还可以借助分子生物学方法,以减轻工作量和提高试验准确性。
3.3 由于犊牛腹泻大肠杆菌O抗原血清型存在一定的地区差异性,近几年来张艳英等[17]、罗甜甜等[18]、夏利宁等[6]在不同地区分离到各种血清型的犊牛腹泻大肠杆菌。本实验分离出的O15和O141病原性大肠杆菌血清型鲜见报道,而O101、O44和O78病原性大肠杆菌血清型与郝彦龙等[8]和喻华英等[5]报道的新疆不同地区犊牛腹泻大肠杆菌优势血清型(O101、O44、O78)相符合。本试验分离出的O15和O141血清型虽报道少,但同样可引起犊牛腹泻疾病。大量研究报道表明,病原性大肠杆菌血清型复杂多样,不同地区、不同牛场的血清型有较大差异且血清型在不断变化,这可能是商品疫苗不能提供稳定有效免疫力的主要原因。因此,通过本试验掌握了新疆第六师不同团(场)致犊牛腹泻大肠杆菌优势血清型分布,可为该地区犊牛腹泻病自家苗的研制奠定基础。
[1] 高 睿. 陕西省犊牛大肠杆菌性腹泻的流行病学调查及初步免疫试验[D].西北农林科技大学硕士学位论文,2008,4.
[2] 方光远,张莉,陆宇超,等. 犊牛腹泻大肠杆菌的分离鉴定和耐药性检测[J].中国畜牧兽医,2014,41(9):273-277.
[3] 肖定汉.奶牛疾病[M].北京:中国农业大学出版社,2002.
[4] 陈杖榴,丁焕中.动物性食品中的兽药残留及兽药和添加剂的应用[J].中国家禽,2002,24(17):5-7.
[5] 喻华英,杨晓华.新疆部分地区犊牛腹泻病大肠杆菌的分离、鉴定与血清型分析[J].新疆农业科学,2011,48(9):1752-1756.
[6] 夏利宁,向发,郭庆勇,等.新疆不同地区牛源大肠杆菌耐药性分析[J].中国畜牧兽医,2014,41(2):203-207.
[7] 南海辰,郭庆勇,夏利宁,等.新疆伊犁某牛场大肠杆菌耐药性调查[J].中国畜牧兽医,2014,41(8):232-236.
[8] 郝彦龙,剡根强,王静梅,等.新疆北疆地区致犊牛腹泻大肠杆菌的分离鉴定及部分生物学特性[J].中国兽医学报,2012,32(6):848-851.
[9] 元振杰,马勋,王燕,等.致犊牛腹泻大肠杆菌对小鼠致病性及药物敏感性试验,家畜生态学报,2011,5:60-64.
[10] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[11] 中华人民共和国卫生部.WS/T 125-1999纸片法抗菌药物敏感试验标准[S].北京:中国标准出版社,2000.
[12] NCCLS. M100-S14 M2-A8 Performance standards for an-timicrobial susceptibility testing,fourteenth informational supplement[S]. Wayne,Pennsylvania:NCCLS,2004.
[13] 布坎南R E,吉本斯N E.伯杰细菌鉴定手册[M].中国科学院微生物研究所,译.北京:科学出版社,1984.
[14] Tadesse D A,Zhao S,Tong E,et al. Antimicrobial drug resistance in Escherichia coli from humans and food animals,United States,1950-2002[J].Emerging Infectious Diseases,2012,18(5):741-749.
[15] Harnett N M,Gles C L.Enterotoxin plasminds in bovine and porcine Enterotoxigenic Escheerichia coli of O group 9,20,64and101[J].Can J Comp Med,1985,49(1):79-97.
[16] Maini J G.F.Bex.Prevalence of four enterotoxin(StaP,StaH,STb and LT)and four adhesion subunit(K99,K88,987P,and F41) genes among Escherichiacoli isolates from cattle[J].Am J Vet Res,1990,51(1):187-190.
[17] 张艳英,高桂生,史秋梅,等.动物性食品源大肠杆菌O血清型鉴定及其K88菌毛基因检测[J].中国畜牧兽医,2013,40(3):185-188.
[18] 罗甜甜,王仲兵,雷宇平,等.山西省北部地区舍饲犊牛大肠杆菌病主要病原的分离和耐药性调查研究[J].中国动物检疫,2012,29(3):42-44.
Isolation,Identifi cation and Drug susceptibility Test of E.coli strains Isolated from Calves with Diarrhea
Ma Changbin,Chen Wenwu,Wang Zhongshan,Cui Lei,Guo Wen,Zhang Zirong
(Sixth Agricultural Division Wujiaqu City Animal husbandry andVeterinary Station,Wujiaqu ,Xinjiang 831300)
In order to understand pathogenicity,serotype distribution and drug sensitivity of E.coli strains isolated from calves with diarrhea in scale dairy farms in the sixth division of Xinjiang Construction Corps,296 anal swab samples were taken from calves with diarrhea in part scale dairy farms in the sixth division of Xinjiang Construction Corps for differential cultivation,biochemical test,serotyping,and drug sensitivity test. The results showed 241 E. coli strains were isolated with 83 strains as beta hemolytic type and 74 out of 83 beta hemolytic Escherichia coli strains caused mice sick and dead. The sensitivities of the isolated strains to ceftazidime,azithromycin,norfloxacin,enrofloxacin and fluorine benzene nicol were 100%,85.14%,70.27%,64.86%,and 63.51% respectively;the dominant serotypes were O101,O78,O141,O44 and O15 respectively in Regiment 101,Regiment 103,the Communist Youth League Farm,Junhu Farm and Qitai Farm. It was concluded that the pathogenic Escherichia coli strains isolated in the region were relatively sensitive to cephalosporin,azithromycin,norfloxacin,enrofloxacin and fluorine benzene nicol,but showed different degrees of resistance to other antibiotics. Different regions had different dominant serotypes.
calf diarrhea;E. coli;biochemical identification;pathogenicity;drug sensitivity
S858.23
B 章编号:1005-944X(2015)03-0078-05
兵团青年科技创新资金专项(2014CB021)

