基于糖酵解途径的乳腺癌治疗研究进展*
李阳 综述 张瑾 审校
·综 述·
基于糖酵解途径的乳腺癌治疗研究进展*
李阳 综述 张瑾 审校
细胞所需的能量主要由葡萄糖的氧化供应,乳腺癌细胞的葡萄糖氧化途径与正常的乳腺细胞有较大差异,这种差异集中表现在乳腺癌细胞糖酵解显著增强,并以此作为供能的主要途径,是乳腺癌向恶性进展的重要特征之一。造成癌细胞糖酵解效应增强的主要原因是细胞中糖酵解酶及糖酵解途径调节因子活性的增强,通过对这些酶及调节因子的活性靶向抑制,可以抑制癌细胞糖酵解的进行,促使癌细胞死亡。本文主要综述近些年以糖酵解途径调节因子和关键酶为靶点的乳腺癌治疗研究进展。
乳腺癌 糖酵解 糖酵解酶 治疗 抑制剂
细胞所需的能量主要由葡萄糖的氧化供应,与大多数癌细胞相似,乳腺癌细胞的糖代谢较相应的正常细胞有很大的差异,其表现的主要特征是糖酵解显著增强。乳腺癌细胞更加依赖糖酵解途径产生的ATP供能,这为研发通过抑制糖酵解途径来优先杀死乳腺癌细胞的药物提供了生化基础,也使得以糖酵解途径中代谢酶为靶点开发抗肿瘤药物成为一种可行策略。本文对抑制乳腺癌糖酵解途径中关键酶及该途径调节因子的靶向药物进行综述。
1 乳腺癌细胞的能量代谢研究
癌细胞主要依靠葡萄糖氧化供能,其糖代谢与正常组织来源的细胞有较大差异,即使在氧供充足的条件下,也主要通过糖酵解途径获得能量,这一现象被称为“Warburg效应”[1]。糖酵解途径是指细胞在细胞质中通过一系列酶催化将葡萄糖降解成丙酮酸的过程(图1)[2]。细胞质中的葡萄糖首先通过己糖激酶(hexokinase,HK)磷酸化为葡萄糖-6-磷酸(glu⁃cose-6-phosphate,G-6-P),G-6-P又通过磷酸果糖激酶(phosphofructokinase,PFK)、丙酮酸激酶(pyru⁃vate kinase,PK)等酶的作用转化为丙酮酸。糖酵解途径产生的丙酮酸可直接进入三羧酸循环途径或者由乳酸脱氢酶(lactate dehydrogenase,LDH)转化为乳酸。在葡萄糖经糖酵解途径生成乳酸的过程中,HK、PFK、PK和LDH等关键代谢酶与肿瘤有关,且受到致癌因子信号转导通路中转录因子如乏氧诱导因子-1α(hypoxia induciblefactor-1α,HIF-1α)等的调控。
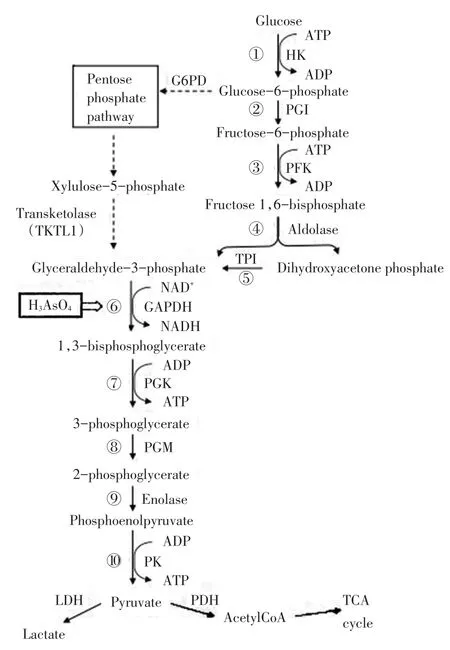
图1 糖酵解途径示意图Figure 1 Illustration of glycolytic pathway
研究表明,乳腺癌细胞的细胞骨架重组及运动转移所需的能量主要来自糖酵解而非氧化磷酸化[3]。生物化学和分子学研究表明活跃的糖酵解途径参与乳腺癌细胞增殖的几个可能代谢途径:线粒体损伤和功能障碍,对缺氧微环境的适应,肿瘤信号转导以及代谢酶的异常表达。此外应用免疫荧光技术在PET-CT下测量全身病灶糖酵解总量,还可以作为转移性乳腺癌患者的一项独立预后因素[4]。
2 乳腺癌糖酵解途径靶点及其靶向治疗
2.1 抑制HIF-1α
HIF是哺乳动物细胞内一类介导缺氧适应性反应的转录因子,在介导缺氧适应性反应和促进糖酵解的过程中起到重要作用。HIF-1α表达可降低线粒体的合成,致使细胞耗氧量减少;HIF-1α启动的特殊转录程序可触发癌细胞的糖酵解,使处于缺氧状态下的癌细胞仍能不断增殖、浸润;HIF-1α还可直接抑制三羧酸循环和氧化磷酸化。HER-2/neu信号通路可上调HIF-1α,增强细胞糖酵解。
HIF-1α的上述作用为靶点治疗乳腺癌提供了理论依据。PX-478抑制癌细胞HIF-1α的翻译,也可降低HIF-1α的mRNA、蛋白水平的转录活性;PX-478在动物实验中已取得较好的抗癌疗效,该药目前处于临床Ⅰ期试验阶段[5]。另外,木蝴蝶素A还可以促进SIRT-3介导的HIF-1α去稳态,抑制糖酵解[6]。
2.2 抑制HK
HK是糖酵解途径的第一个限速酶,与线粒体外膜结合,催化葡萄糖磷酸化生成G-6-P。选择性抑制HK活性,可抑制G-6-P的产生,从而阻断癌细胞的糖酵解。
2-脱氧葡萄糖(2-deoxyglucose,2-DG)是一种葡萄糖类似物,能够竞争性抑制HK2活性。研究表明,2-DG可通过抑制乳腺微球体形成,抑制乳腺癌干细胞糖酵解[7]。2-DG联合阿霉素可增高细胞内的活性氧水平,并可降低乳腺癌干细胞对阿霉素的化疗耐药性,并还可以提升曲妥单抗耐药性乳腺癌细胞对曲妥单抗的敏感性,表明联合用药可能是一种有效的乳腺癌治疗策略[8]。2-DG目前正处于临床Ⅰ~Ⅱ期试验阶段,其耐受性较佳且毒性较小。
3-溴丙酮酸(3-BrPA)是一种乳糖类似物,能够将HK2中巯基烷基化而直接抑制HK2活性,阻止ATP产生,诱导癌细胞大量凋亡[9]。3-BrPA在高浓度下有较高的糖酵解抑制作用,虽然3-BrPA不是一个高选择性的HK2抑制剂,但可单独使用。动物实验表明其单独使用即可对乳腺癌细胞生长发挥抑制作用,联合阿霉素可进一步增强其诱导乳腺癌细胞的凋亡作用,3-BrPA是一种处于临床开发中有潜力的抗癌药物[10]。
氯尼达明是一种选择性HK2抑制剂。在体外环境中,氯尼达明可抑制HK2与线粒体结合,从而抑制糖酵解,导致癌细胞死亡。该药目前已进入临床前研究阶段,氯尼达明单独使用时抑瘤效果不明显。但研究显示,在人乳腺癌MCF-7细胞系中,氯尼达明可提高顺铂、4-氢过氧化环磷酰胺、马法兰以及卡莫司汀等烷基化药物的细胞毒性[11],联合表柔比星使用可缓解乳腺癌对表柔比星的耐药性。说明氯尼达明可提高其他抗肿瘤药物的活性,与其他药物联合治疗乳腺癌。
2.3 抑制PFK
PFK1是糖酵解途径3个限速酶中最重要的1个。研究表明PFK-L亚型为PFK的活性亚型,PFK的浓度可以影响其寡聚化反应,低浓度时PFK多以二聚体形式存在,活性低、稳定性差;高浓度时则以四聚体形式存在,活性高、稳定性好,此时药物对其抑制作用减弱[12]。
白藜芦醇是植物中提取的一种多元酚,目前已广泛用于食品、保健品、医药等领域,其为一种PFK抑制剂,可抑制PFK1活性,促进该酶从四聚体形式解离为二聚体形式,并降低乳腺癌细胞的生存能力,减少细胞的耗糖量以及降低细胞内ATP水平。
克霉唑是一种广谱抗真菌药,作为一种可逆性PKF1抑制剂,可降低ATP和催化底物6-磷酸果糖在该酶分解位点的亲和力,提高ATP在该酶抑制位点的亲和力,抑制细胞糖酵解。另外,克霉唑还可使PFK1与肌动蛋白丝解离,从而抑制人乳腺癌组织细胞的糖酵解,并且不对正常组织产生影响[13]。研究表明,乳腺癌细胞系的侵袭性越强,克霉唑的有效率越高[14]。
2.4 抑制PK
PK是糖酵解途径的最后1个关键酶。所有癌细胞均表达PKM2亚型。同PFK相似,PKM2也分为高活性的四聚体形式和低活性的二聚体形式[15]。癌细胞中PKM2主要以二聚体形式存在。
PK是糖酵解途径中另外一个有可能成为靶点的具有亚型选择性的糖酵解酶。研究发现,将针对PKM2的小干扰RNA联合阿霉素用于三阴性乳腺癌时,阿霉素的治疗效果明显增强[16]。一些多肽配体能够选择性抑制PKM2,并促使其转化成低活性PK,从而导致能量应激和培养的癌细胞死亡[17]。TT-232是一种生长激素抑制剂类似物,可靶向抑制PKM2,有较好的抑瘤效果。
2.5 抑制LDH
LDH能催化丙酮酸转化成乳酸。LDH分为A、B、C亚型,LDHA亚型在很多癌细胞中均有表达,但LDHA基因缺乏者在正常情况下却基本无任何症状。提示LDHA有可能成为肿瘤治疗中一个有效靶点。研究表明,HER-2阳性乳腺癌患者的糖酵解效应增强,部分原因是HER-2通过热休克因子1(HSF1)使LDHA表达上调[18]。抑制LDHA有望成为改善乳腺癌患者曲妥珠单抗抵抗的方法之一。
盖洛黄素是一种新型LDH抑制剂,可介导非侵袭性乳腺癌细胞的凋亡及侵袭性乳腺癌细胞的坏死。其半数抑制浓度(half maximal inhibitory concen⁃tration,IC50)平均为125 μM,远高于常用化疗药物的有效剂量[19]。目前,鉴于能够作用于LDH的药物相对匮乏,盖洛黄素仍是一个具有潜力的药物。
LDHA活化区域高度极化、不易触及,因此目前以LDHA为靶点,通过抑制其活性治疗乳腺癌仍处于理论阶段。另外有研究表明,在糖酵解的逆向反应中,正常组织中LDH对底物的亲和力高于癌组织中LDH,从酶的动力学角度提示,提高LDH的亲和力、促进乳酸转化为丙酮酸,可抑制依赖乳酸的癌细胞增殖、传代[20]。
3 结语
乳腺癌细胞中糖酵解酶的活性受肿瘤微环境的影响而产生变化,仅抑制该过程中某一个靶点可能不足以抑制肿瘤增殖,甚至可能引起癌细胞耐药,因此,以多个糖酵解酶为靶点的联合治疗策略值得关注。细胞的能量供应减少至一定水平才能诱发细胞凋亡及坏死。由于乳腺癌细胞中因线粒体仍然存在,糖酵解途径受抑后,细胞仍可通过氧化磷酸化途径产生ATP[21],这一代偿途径将会削弱糖酵解抑制剂对乳腺癌的治疗效果。将多种机制不同的抑制ATP产生的药物联合使用可能成为治疗乳腺癌的新途径。一些正常组织如脑、视网膜、睾丸等均以糖酵解途径为主要的能量来源,应用糖酵解抑制剂治疗乳腺癌有可能对这些正常组织产生影响,因此研发更加特异、稳定、高效、安全的药物成为靶向糖酵解途径治疗乳腺癌的重要研究方向。联合抑制糖酵解、戊糖循环及硫氧还原蛋白可增强细胞对氧应激的敏感性,导致乳腺癌细胞死亡率增加[22],且部分糖酵解途径抑制剂可降低癌细胞的化疗耐药、放疗抵抗。因此,以糖酵解酶为靶点的抑制剂联合放、化疗有望成为乳腺癌治疗的新方向。
[1] Warburg O.On the origin of cancer cells[J].Science,1956,123 (3191):309-314.
[2] Pelicano H,Martin DS,Xu RH,et al.Glycolysis inhibition for an ticancer treatment[J].Oncogene,2006,25(34):4633-4646.
[3] Shiraishi T,Verdone JE,Huang J,et al.Glycolysis is the primary bioenergetic pathway for cell motility and cytoskeletal remodeling in human prostate and breast cancer cells[J].Oncotarget,2015,6 (1):130-143.
[4] Satoh Y,Nambu A,Ichikawa T,et al.Whole-body total lesion glycolysis measured on fluorodeoxyglucose positron emission to mography/computed tomography as a prognostic variable in met astatic breast cancer[J].BMC cancer,2014,14:525.
[5] Lee K,Kim HM.A novel approach to cancer therapy using PX-478 as a HIF-1α inhibitor[J].Arch Pharm Res,2011,34(10):1583-1585.
[6] Wei L,Zhou Y,Qiao C,et al.Oroxylin A inhibits glycolysis-de pendent proliferation of human breast cancer via promoting SIRT3-mediated SOD2 transcription and HIF-1α destabilization[J]. Cell Death Dis,2015,6:e1714.
[7] Ciavardelli D,Rossi C,Barcaroli D,et al.Breast cancer stem cells rely on fermentative glycolysis and are sensitive to 2-deoxy glucose treatment[J].Cell Death Dis,2014,5:e1336.
[8] Zhao Y,Butler EB,Tan M.Targeting cellular metabolism to im prove cancer therapeutics[J].Cell Death Dis,2013,4:e532.
[9] Cardaci S,Desideri E,Ciriolo MR.Targeting aerobic glycolysis: 3-bromopyruvate as a promising anticancer drug[J].J Bioenerg Biomembr,2012,44(1):17-29.
[10]Ko YH,Verhoeven HA,Lee MJ,et al.A translational study "case report"on the small molecule"energy blocker"3-bromopy ruvate(3BP)as a potent anticancer agent:from bench side to bed side[J].J Bioenerg Biomembr,2012,44(1):163-170.
[11]Rosbe KW,Brann TW,Holden SA,et al.Effect of lonidamine on the cytotoxicity of four alkylating agents in vitro[J].Cancer Chemother Pharmacol,1989,25(1):32-36.
[12]Gomez LS,Zancan P,Marcondes MC,et al.Resveratrol decreases breast cancer cell viability and glucose metabolism by inhibiting 6-phosphofructo-1-kinase[J].Biochimie,2013,95(6):1336-1343.
[13]Coelho RG,Calaca Ide C,Celestrini Dde M,et al.Clotrimazole disrupts glycolysis in human breast cancer without affecting non-tumoral tissues[J].Mol Genet Metab,2011,103(4):394-398.
[14]Furtado CM,Marcondes MC,Sola-Penna M,et al.Clotrima zole preferentially inhibits human breast cancer cell proliferation, viability and glycolysis[J].PloS One,2012,7(2):e30462.
[15]Christofk HR,Vander Heiden MG,Wu N,et al.Pyruvate ki nase M2 is a phosphotyrosine-binding protein[J].Nature,2008, 452(7184):181-186.
[16]Wang F,Yang Y.Inhibition of PKM2 sensitizes triple-negative breast cancer cells to doxorubicin[J].Biochem Biophys Res Com mun,2014,454(3):465-470.
[17]Christofk HR,Vander Heiden MG,Harris MH,et al.The M2 splice isoform of pyruvate kinase is important for cancer metabo lism and tumour growth[J].Nature,2008,452(7184):230-233.
[18]Zhao YH,Zhou M,Liu H,et al.Upregulation of lactate dehydro genase a by ErbB2 through heat shock factor 1 promotes breast cancer cell glycolysis and growth[J].Oncogene,2009,28(42):3689-3701.
[19]Farabegoli F,Vettraino M,Manerba M,et al.Galloflavin,a new lactate dehydrogenase inhibitor,induces the death of human breast cancer cells with different glycolytic attitude by affecting distinct signaling pathways[J].Eur J Pharm Sci,2012,47(4):729-738.
[20]Talaiezadeh A,Shahriari A,Tabandeh MR,et al.Kinetic charac terization of lactate dehydrogenase in normal and malignant hu man breast tissues[J].Cancer Cell Int,2015,15:19.
[21]Lu CL,Qin L,Liu HC,et al.Tumor cells switch to mitochondrial oxidative phosphorylation under radiation via mTOR-mediated hexokinaseⅡinhibition-a Warburg-reversing effect[J].PloS One,2015,10(3):e0121046.
[22]Li L,Fath MA,Scarbrough PM,et al.Combined inhibition of gly colysis,the pentose cycle,and thioredoxin metabolism selectively increases cytotoxicity and oxidative stress in human breast and prostate cancer[J].Redox Biol,2015,4:127-135.
(2015-06-24收稿)
(2015-08-18修回)
Research progress in breast cancer treatment based on glycolytic pathway
Yang LI,Jin ZHANG
The Third Department of Breast Cancer,Tianjin Medical University Cancer Institute and Hospital;National Clinical Research Center for Cancer,Tianjin Key Laboratory of Cancer Prevention and Therapy;Tianjin Key Laboratory of Breast Cancer Prevention and Therapy,Ministry of Education,Tianjin 300060,China.
This work was supported by the National Key Technology Research and Development Program of the Ministry of Science and Technology of China(No.2015BAI12B15)and the Tianjin Municipal Key Project of Scientific Planning(No.12ZCDZSY15700).
Breast cancer cells are largely different in terms of energy metabolism,which refers to energy transformation from mitochondrial oxidative phosphorylation to glycolysis.However,energy supply of breast cancer cells is practically the same as that of normal breast cells.The metabolic pathway is used to generate ATP as a main source of energy supply.This phenomenon is one of the most fundamental metabolic alterations during malignant transformation.This phenomenon mainly contributes to the over-activity of the key enzymes and some regulatory factors involved in the process,the targeting treatment of which provides a potential way to inhibit glycolysis and leads to cell death consequently.This review mainly summarizes the reported modulators and the key enzymes of glycolysis in breast cancer treatment over the past few years.
breast cancer,glycolysis,glycolytic enzymes,treatment,inhibitor

10.3969/j.issn.1000-8179.2015.21.674
天津医科大学肿瘤医院乳腺肿瘤三科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,乳腺癌防治教育部重点实验室(天津市300060)
*本文课题受天津市科技计划项目(编号:12ZCDZSY15700)资助
张瑾 zhangjin@tjmuch.com
李阳 专业方向为乳腺肿瘤外科。
E-mail:xiaoliyang_1991@163.com

