新疆革蜱源性牛无浆体的PCR检测
孟 元,张玉婷,吴 敏,郭庆勇,张 杨,巴音查汗
(1.浙江大学生命科学学院,浙江 杭州 310058;2.新疆农业大学动医学院,新疆 乌鲁木齐 830052)
新疆革蜱源性牛无浆体的PCR检测
孟 元1,张玉婷2,吴 敏1,郭庆勇2,张 杨2,巴音查汗2
(1.浙江大学生命科学学院,浙江 杭州 310058;2.新疆农业大学动医学院,新疆 乌鲁木齐 830052)
为了解新疆部分地区优势媒介革蜱类传播牛无浆体的状况,随机采集了吐鲁番、巴州等牛场和放牧牛身上寄生的革蜱(N=140只),以16S rRNA基因为靶标分别设计了无浆体属通用引物(EE1/EE2)和牛无浆体特异性引物(AB1f/AB1r),运用嵌套式PCR方法扩增其全基因组DNA。试验结果显示,在140只革蜱全基因组DNA中,扩增出阳性条带的13只,其牛无浆体的阳性率为9.3%(13/140),这结果被阳性革蜱同一个群的革蜱动物传播试验所验证。经阳性病原DNA的克隆测序、比对后,发现该牛无浆体病原DNA序列与数据库中的西藏株(AF414399)和福建株(DQ324547)相似,其同源性均为99%。试验表明,新疆牛无浆体可能被当地的优势媒介革蜱所携带和传播,该参数可为地方蜱传无浆体病的综合防治提供科学依据。
革蜱源性;牛无浆体;PCR;检测
无浆体病(Anaplasmosis)也称边虫病,是由无浆体(Anaplasma)经蜱传播而引起牛、羊、鹿等家畜的一种传染性血液原虫病[1-3]。1910年在北非首次发现了由边缘无浆体(Anaplasma marginale)引起牛无浆体病,后来发现该病广泛分布于世界各地[4]。该病引起宿主动物体重下降,流产,产奶量下降,严重者可以致死,牛死亡率可达80%,造成严重的经济损失[5]。据报道,牛无浆体病是蜱传播中严重阻碍养牛业发展的、分布最广的一种[6],鉴于此,世界动物卫生组织(OIE)将其列为必须通报的疫病[7]。在新疆境内分布的媒介蜱虫种类多、分布广,草地资源丰富,宿主动物-牛几乎放牧为主,故宿主牛很容易遭受被媒介蜱的侵袭,发生蜱传牛无浆体病。目前,对于无浆体病的诊断,可以根据流行病学和临床症状来做出初步判断,然后通过姬姆萨染色血涂片法发现无浆体来进行确诊。但血涂片染色法在感染率很低或在感染早期时很难在显微镜下检查出病原,而且操作熟练程度将直接影响诊断结果的准确性,因此,需要分子生物学的方法来快速、准确的诊断无浆体病。本研究运用嵌套式PCR方法检测
革蜱唾液腺内携带的牛无浆体病原,为新疆草原牛无浆体病的流行病学调查和综合防治提供科学支撑。
1 材料与方法
1.1 主要试剂与仪器 Premix Ex Taq、DNAMarker 2 000、pMD18-T载体,均购自TaKaRa公司;全血基因组提取试剂盒,购自上海赛百盛基因技术有限公司;胶回收试剂盒,购自Axygen公司;DH5α,购自北京全式金生物技术有限公司。DNA C1000 Thermal Cycler PCR扩增仪Bio-Rad公司产品,DYY-Ⅱ型电泳仪为北京六一仪器厂产品,JS-680全自动凝胶成像分析仪为上海培清科技有限公司产品。
1.2 扩增引物 第1轮扩增引物EE1/EE2[8]可扩增无浆体16S rRNA基因,具有属特异性,预扩增的目的片段为1 430 bp,上游引物EE1:5′-TCCT⁃GGCTCAGAACGAACGCTGGC-3′,下游引物EE2:5′-AGTCACTGACCCAACCTTAAATGGCTG-3′;第2轮扩增引物AB1f/AB1r[9]可以特异性扩增牛无浆体16S rRNA基因,预扩增的目的片段长度为551 bp,序列如下:上游引物AB1f:5′-CTCGTAGCTT⁃GCTATGAGAAC-3′,下游引物AB1r:5′-TCTCCCG⁃GACTCCAGTCTG-3′。引物由英潍捷基(上海)贸易有限公司合成。
1.3 蜱虫携带无浆体基因组DNA的提取 蜱虫样品有新疆农业大学合作项目团队采集于吐鲁番、巴州等地养殖牛场和放牧牛体表,经鉴定到革蜱属(N=140只,包括银盾革蜱和草原革蜱,鉴定结果省略)后,按规定运输送来浙大生科院实验室待检。将单个蜱虫样品置于大平皿中用蒸馏水刷洗干净后,在研钵中研磨充分后,加入200μL PBS(1×)缓冲液,20μL Proteinase K消化液,混匀,与56℃恒温水浴锅消化30min后,用DNA提取试剂盒进行革蜱DNA,DNA分装后-20℃保存备用。
1.4 蜱源性牛无浆体的PCR检测 根据Liu等[10]使用的PCR的方法对上述蜱虫样品进行检测。巢式PCR的第一轮反应体系为20μL:Premix Ex Taq 10 μL,EE1(10μmol/L)2.0μL,EE2(10μmol/L)2.0μL,DNA模板2.0μL,ddH2O 4.0μL。反应条件为94℃3min;94℃30 s,55℃30 s,72℃90 s,35个循环;72℃10min。将第1轮扩增产物作为第2轮反应的模板,PCR反应体系为20μL:Premix Ex Taq10μL,AB1f(10μmol/L)2.0μL,AB1r(10μmol/L)2.0μL,第1轮扩增产物1.0μL,ddH2O 5.0μL。反应条件为94℃3min;94℃30 s,55℃30 s,72℃40 s,35个循环;72℃5min。扩增产物通过1%琼脂糖凝胶电泳检测后,根据电泳后PCR产物的位置确定是否为所扩增的目的片段。
1.5 PCR产物的连接、克隆及测序鉴定 为鉴定该检测方法的准确性,随机选取PCR阳性产物,利用DNA凝胶回收试剂盒回收纯化的条带,然后进行连接。连接反应体系为10μL,包括:纯化的产物4μL,SolutionⅠ5μL,pMD18-TVector 1μL,充分混匀后16℃水浴连接过夜。取连接产物转化到E.coli DH5-α细胞中,经菌液PCR鉴定后送英骏(上海)贸易有限公司进行测序。
1.6 16S rRNA基因序列同源性分析 将获得的序列提交至NCBI数据库,使用Genetyx(version7)和BLAST在线服务分析基因的同源性分析。从NCBI网站GenBank数据库中下载相关物种的16S rRNA基因序列。
2 试验结果
2.1 蜱虫基因组的提取 将提取的蜱虫DNA 5 μL进行琼脂糖凝胶电泳,均得到清晰的电泳条带,由此验证蜱DNA提取成功。
2.2 蜱源性牛无浆体PCR检测结果 以提取的蜱虫基因组DNA为模板,采用巢式PCR方法进行检测,第1轮EE1/EE2扩增结果在1 500 bp附近有特异性的阳性条带(见图1),第2轮AB1f/AB1r扩增结果在500 bp附近有特异性的阳性条带(见图2),与预测的目的的片段大小一致。试验表明,新疆吐鲁番和巴州部分地区分布的革蜱类携带牛无浆体,其感染率为9.3%(13/140)。该结果被同一类革蜱的动物传播试验验证(该文省略此结果)。
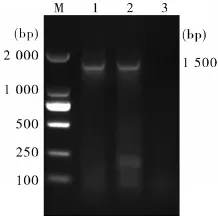
图1 无浆体属通用引物EE1/EE2PCR检测M:DNA分子质量标准;1~2:吐鲁番样品的疑似样品PCR产物;3:阴性对照

图2 牛无浆体特异性引物AB1f/AB1rPCR检测M:DNA分子质量标准;1~7:吐鲁番部分样品的PCR产物;8:阴性对照
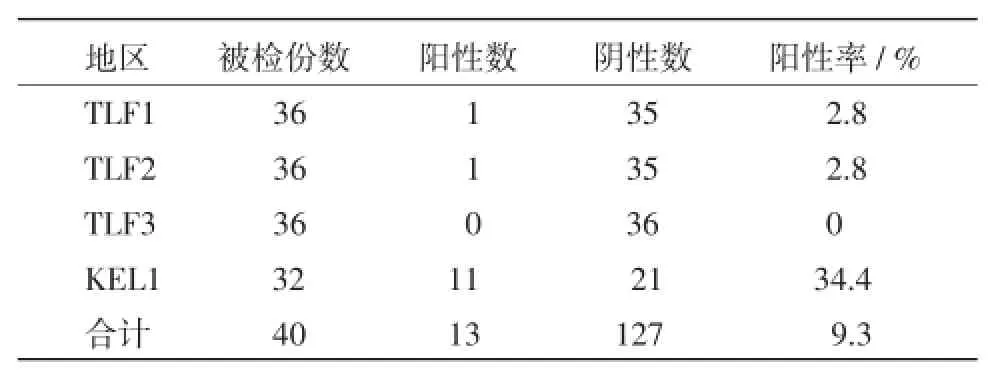
表1 不同地区牛体表革蜱携带牛无浆体的感染率
2.3 16S rRNA基因的克隆、测序 在巢式PCR所检测出的13份阳性样品进行16S rRNA基因的克隆和测序,将PCR鉴定为阳性的菌液送往英骏(上海)贸易有限公司进行测序,使用NCBI网站的BLAST将测序序列与核酸数据库中的序列进行比对,结果显示,与西藏[11]株(基因登录号:AF414399)和福建株(基因登录号:DQ324547)的无浆体相比,同源性均为99%。通过牛无浆体特异性引物检测,结果显示也为阳性,即采自吐鲁番等地的部分革蜱携带牛无浆体病原,表明该巢式PCR的检测结果准确可靠。
3 讨论与小结
牛无浆体主要感染动物的单核细胞,可通过长角血蜱(Haemaphysalis longicornis)和巨刺血蜱(H. megaspinosa)进行传播[12-14]。我国对于牛无浆体的流行病学资料稀少,目前仅有周作勇等[15]从分子水平上证实了重庆市存在牛无浆体及上海兽医研究所Liu等[10]对浙江、湖北、河南、贵州四省山羊中无浆体的流行状况进行了调查,迟庆安[7]运用分子生物学的方法对四川、重庆、云南、贵州、广西、湖南、广东等南方地区牛无浆体病的流行情况进行了调查。有关新疆牛无浆体病的流行病学资料几乎空白,为弥补我国西域区域牛无浆体流行病学资料,笔者结合浙大-新疆农大合作项目,对新疆吐鲁番、巴州等地区的蜱源性牛无浆体病原进行了检测。结合之前的有关蜱传病研究表明,牛无浆体常常与牛梨形虫(俗称牛焦虫)混合感染,在我国新疆部分地区广泛流行,应引起相关部门的高度重视。
本试验结果表明,采自新疆吐鲁番的部分革蜱(包括银盾革蜱和草原革蜱)携带牛无浆体,其阳性率达2.8%,而巴州地区的部分革蜱携带牛无浆体的阳性率可达34.4%。这可能由于巴州牧业县的牛群自然放牧为主,与革蜱接触频繁有关,导致牛无浆体的感染率偏高,建议加强防范。有关地方媒介蜱携带病原种类及其生物学特性与宿主动物关系等待进一步研究,这次试验研究为当地的蜱传疾病的综合防治奠定基础。
[1]蒋金书.动物原虫学[M].北京:中国农业大学出版社,2000:116-119.
[2]党志胜,蒋锡仕,黄孝纷.我国牛羊边虫及边虫病的研究现状[J].青海畜牧兽医杂志,2003,4(33):39-41.
[3]吴鉴三.牛边缘无浆体病的研究进展[J].动物检疫,1992,2(9):23-25.
[4]Aubry P,Geale DW.A review of bovine anaplasmosis[J].Trans⁃bound Emerg Dis,2011,58(1):1-30.
[5]Kocan KM,Blouin E F,Barbet A F.Anaplasmosis control:Past,present,and future[J].Ann N Y Acad Sci,2000,916:501-509.
[6]徐梅倩,陈克喜,张北民.斑点免疫金渗虑法检测边虫病的研究[J].中国兽医寄生虫病,1996,4(3):102-111.
[7]Reinbold J B,Coetzee J F,Sirigreddy K R,et al.Detection of Anaplasmamarginale and A.phagocytophilum in bovine peripher⁃al blood samples by duplex real-time reverse transcriptase PCR assay[J].JClin Microbiol,2010,48(7):2424-2432.
[8]Barlough JE,Madigan JE,Derock E,et al.Nested polymerase chain reaction for detection of Ehrlichia equi genomic DNA in horses and ticks(Ixodes pacificus)[J].Vet Parasitol,1996,63(3-4):319-329.
[9]Kawaha M,Rikihisa Y,LIN Q,et al.Novel genetic variants of Anaplasma phagocytophilum,Anaplasma bovis,Anaplasma central,and a novel Ehrlichia sp.In wild deer and ticks on twomajor islands in Japan[J].Appl Environ Microbiol,2006,72(2):1102-1109.
[10]Liu Z,Ma M,Wang Z,etal.Molecular survey and genetic identi⁃fication of Anaplasma species in goats from central and southern China[J].Appl Environ Microbiol,2012,78(2):464-470.
[11]BohaiWen,Rui Jian,Youzhi Zhang,et al.Simultaneous Detec⁃tion of Anaplasma marginale and a New Ehrlichia Species Closely Related to Ehrlichia chaffeensis by Sequence Analyses of 16SRi⁃bosomal DNA in Boophilusmicroplus Ticks from Tibet[J].Journal of Clinical Microbiology,Sept.2002,p.3286-3290.
[12]Yoshimotok,Mat suyama Y,Mat Sudah,et al.Detection of Ana⁃plasma bovis and Anaplasma phagocytophilum DNA from Haema⁃physalismegaspinosa in Hokkaido,Japan[J].Vet Parasitol,2010,168(1-2):17-172.
[13]Leem J,Chae J S.Molecular detection of Ehrlichiach affeensis and Anaplasma bovis in the salivary glands from ticks[J].Vector Borne Zoonotic Dis.2010,10(4):411-413.
[14]Kim C M,Kim M S,Park M S,et al.Identification of Ehrlichia chaffeensis,and A.bovis in Haemaphysalis longicornis and Ixo⁃des persulcatus ticks from Korea[J].Vector Borne Zoonotic Dis,2003,3(1):17-26.
[15]周作勇,聂奎,唐成,等.牛无浆体16S rRNA基因的克隆测序及分析[J].畜牧兽医学报,2010,41(10):1359-1363.
PCR Detection of Dermacentor-borne Anaplasma bovis in Xinjiang
MENG Yuan1,ZHANG Yu-ting2,WUMin1,GUOQing-yong2,ZHANG Yang2,Bayinchahan2
(1.College of life Sciences,Zhejiang University,Hangzhou 310058,China;2.College of VeterinaryMedicine,Xinjiang Agricultural University,Urumqi830052,China)
In order to investigate whether Anaplasma bovis was spread mainly by Dermacentor in parts of Xinjiang,one hun⁃dred and forty ticks from cattleswere collected in Turpan,Bazhou,and other epidem ic areas.The universal primers(EE1/EE2)and gene specific primers(AB1f/AB1r)were designed to target the 16S rRNA of Anaplasma bovis and nested PCR was applied to am⁃plify its full genomic DNA.The results showed that 13 positive bandswere observed in 140 genome DNA samples from Dermacen⁃tor,and the positive rate of Anaplasma bovis was 9.3%(13/140),which were verified by Dermacentor spread pathogenic on animals of experiments from the same group of positive Dermacentor.DNA-positive pathogens were cloned and sequenced.The results showed that the DNA sequence of Anaplasma bovis was similarwith Tibet strain(AF414399)and Fujian strain(DQ324547)in the database,and their homology were 99%.The study suggestes that Anaplasma bovis is inmainly in Dermacentor and transmissed by Dermacentor in Xinjiang,our data provides the basis for the prevention of tick-borne Anaplasma in Xinjiang.
Dermacentor-borne;Anaplasma bovis;PCR;detection
Bayinchahan
S852.74+6
A
0529-6005(2015)11-0036-03
2015-04-26
新疆维吾尔自治区科技支疆项目(2013911061)
孟元(1991-),女,博士生,从事生物化学与分子生物学研究,E-mail:673177231@qq.com
巴音查汗,E-mail:bynch@hotmail.com

