3-甲基-4-硝基酚对大鼠肾脏氧化损伤作用的研究
岳 卓,常玲玲,许方倩伟,佘锐萍
(1.北京天坛生物制品股份有限公司,北京 朝阳 100024;2.中国农业大学动物医学院,北京 海淀 100193;3.西北农林科技大学,陕西 杨凌 712100;4.中国生物技术股份有限公司科研与国际合作部,北京 朝阳 100029)
3-甲基-4-硝基酚对大鼠肾脏氧化损伤作用的研究
岳 卓1,2,常玲玲2,3,许方倩伟4,佘锐萍2
(1.北京天坛生物制品股份有限公司,北京 朝阳 100024;2.中国农业大学动物医学院,北京 海淀 100193;3.西北农林科技大学,陕西 杨凌 712100;4.中国生物技术股份有限公司科研与国际合作部,北京 朝阳 100029)
为了探讨3-甲基-4-硝基酚(PNMC)对大鼠肾脏的氧化损伤作用,选择SPF级雄性SD大鼠,随机分为4组(每组10只),设立3个染毒组和1个对照组。染毒组采用皮下注射的途径分别给予每天剂量为1mg/kg体重、10mg/kg体重和100mg/kg体重的PNMC,连续5 d。对照组采用同样的途径给予溶剂(PBS+0.05%tween80),最后一次染毒后第24小时剖检取材。称量体重和器官重量,观察肾脏组织病理学变化,检测血清中肌酐和尿素氮的含量,以及超氧化物歧化酶、谷胱甘肽过氧化物酶、总抗氧化能力及丙二醛等抗氧化指标的含量。结果显示,染毒组大鼠体重和日增重出现不同程度的下降;各剂量组大鼠肾脏均有不同程度的病理损伤;100mg/kg体重组大鼠肌酐浓度显著升高,所有染毒组大鼠超氧化物歧化酶的含量均显著下降,10mg/kg体重染毒组大鼠总抗氧化能力也显著低于对照组。综上所述,PNMC染毒后血清中超氧化物歧化酶的活性降低,同时伴有总抗氧化能力下降,提示大鼠体内抗氧化系统遭到破坏,导致过多的过氧化物在体内蓄积,从而对大鼠肾脏造成氧化损伤。
3-甲基-4-硝基酚;SD大鼠;肾脏;氧化损伤
3-甲基-4-硝基酚(PNMC)是柴油机尾气的重要组织成分,也是杀虫剂杀螟松在生物体内的主要降解产物。研究表明,随着柴油机尾气的大量排放和农药的广泛使用,PNMC不断地在环境中蓄积,通过呼吸道、消化道、皮肤等途径进入人及动物体内,严重威胁动植物乃至人类的健康[1-2]。
现有研究已经证实,氧化应激(OS)是外源性物质产生毒性作用最基本的分子机制[3-4]。它主要是由活性氧和脂质过氧化物介导生物大分子和脂膜产生自由基,引起氧化损伤和细胞死亡[5]。有报道表明,PNMC可以引起鸡胚精原细胞产生OS[6],而且当暴露于柴油机尾气中时可引起OS[7],这些结果提示,OS可能是PNMC产生毒性作用的重要发病机制。我们前期研究证明,PNMC可损伤大鼠肾脏的形态结构[8],本研究中,我们拟探讨PNMC诱导肾脏损伤与OS之间的关系,为揭示PNMC诱导的肾脏损伤的发病机制提供理论依据。
1 材料与方法
1.1 实验动物及饲养 体重160~180 g SPF级 SD雄性大鼠40只,购自中国人民解放军军事医学科学院实验动物中心,分笼饲养(2~3只/笼),自由饮食。饲养环境:室温21℃~24℃,相对湿度:30%~40%,每两天更换1次垫料。大鼠对饲养环境适应1周后进行染毒试验。大鼠随机均分为4组,3个染毒组和1个对照组。其中染毒组分别是1mg/kg体重、10mg/kg体重和100mg/kg体重剂量组,每天采用皮下注射的途径进行染毒,连续进行5 d,对照组皮下注射等量的溶剂(PBS+ 0.05%tween80)。每天观察大鼠的活动情况并称重。最后1次染毒后第24小时,无痛处死大鼠,采血并分离血清备用,摘取两侧的肾脏,称量器官湿重并计算其脏器系数(肾脏湿重/体重),右侧肾脏液氮冷冻备用,左侧肾脏用2.5%多聚甲醛-戊二醛固定液充分固定备用。
1.2 组织病理学观察 肾脏组织块经固定液充分固定后,按常规方法进行脱水、透明和石蜡包埋,制作成厚度为4μm的连续切片,进行苏木素-伊红(H.E.)染色,OLYMPUS显微镜进行观察,拍照。
1.3 血清中肌酐和尿素氮水平的测定 为了评价肾脏功能,利用肌酐(Cre)测试盒和尿素氮(BUN)测试盒(均购自南京建成生物工程研究所)检测血清中的Cre和BUN的水平变化。具体
方法按照试剂盒说明书进行操作。
1.4 血清和组织中抗氧化水平的测定 为评价机体抗氧化能力,利用超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、总抗氧化能力(TAOC)和丙二醛(MDA)等试剂盒(均购自南京建成生物工程研究所)分别检测了血清和肾脏组织中SOD、GSH-Px、T-AOC及MDA等抗氧化指标的活性。具体方法按照试剂盒说明书进行操作。
1.5 数据处理和统计 数据处理采用SPSS12.0软件进行方差分析和显著性差异检验。数据表达方式以“平均值±标准差”表示,P<0.05表示与对照组相比差异显著。
2 结果
2.1 PNMC对大鼠体重和肾脏重量的影响 由表1可知,SD大鼠经PNMC染毒5 d后,各剂量组大鼠体重及日增重均显著低于对照组(P<0.05),但是肾脏的相对重量与对照组相比并无显著性差异(P>0.05)。
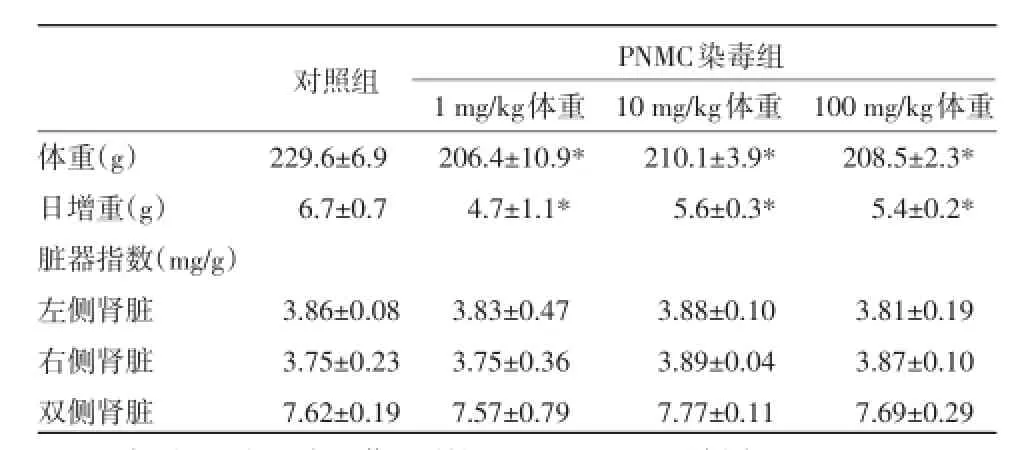
表1 PNMC对大鼠体重及肾脏重量的影响
2.2 PNMC对大鼠肾脏组织形态结构的影响 组织病理学观察结果(见中插彩版图1)显示,对照组大鼠肾脏肾小管上皮细胞排列紧密、有序,刷状缘清晰、致密(见中插彩版图1A),而PNMC染毒组大鼠肾脏均出现了不同程度的损伤:经1mg/kg体重和10mg/kg体重剂量的PNMC处理的大鼠肾脏近曲小管的刷状缘溶解消失(见中插彩版图1B、图1C),经10mg/kg体重和100mg/kg体重剂量的PNMC处理的大鼠肾脏皮质和髓质的肾小管上皮细胞出现不同程度的坏死,细胞核固缩凝聚,且髓质部的坏死程度较皮质部严重(见中插彩版图1C、图1D)。肾小管上皮细胞死亡的特点与我们以前研究所描述的坏死损伤特点基本一致[8]。
2.3 PNMC对大鼠血清中肌酐和尿素氮水平的影响 血清学分析结果(图2)显示,与对照组相比,经PNMC染毒后,大鼠血清BUN水平并没有明显变化,大鼠血清Cre水平在1mg/kg体重和10mg/ kg体重PNMC剂量组也只是略有升高,但是在100mg/kg体重PNMC剂量组大鼠血清肌酐的浓度却显著升高(P<0.05)。
2.4 PNMC对SOD、GSH-Px、T-AOC和MDA活性的影响 血清中抗氧化指标检测结果(见表2)显示,染毒组大鼠血清中SOD浓度与对照组比较均显著下降(P<0.05);血清中T-AOC的含量在10mg/kg体重PNMC染毒组也显著低于对照组(P<0.05);染毒组大鼠血清GSH-Px浓度略有降低,MDA浓度略有升高,但与对照组比较差异不显著(P>0.05)。
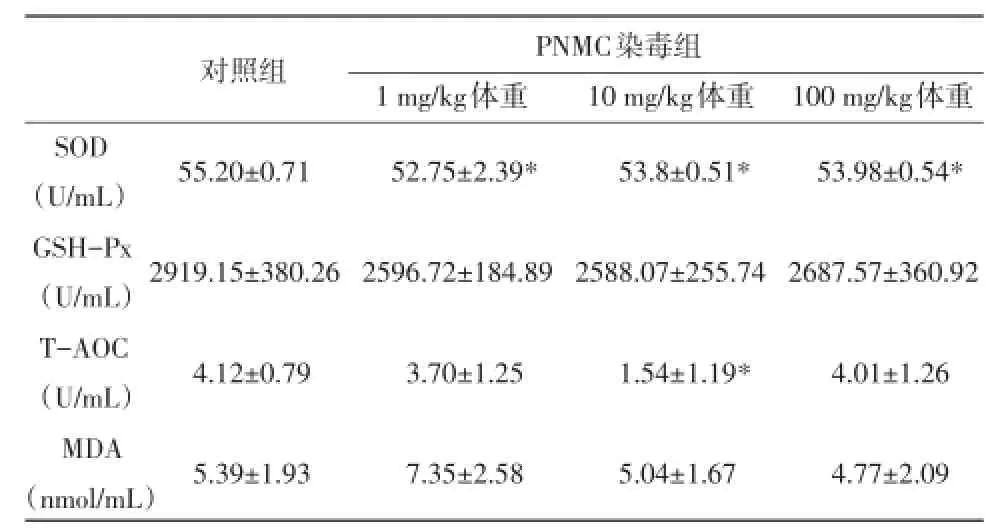
表2 PNMC对大鼠血清SOD、GSH-Px、T-AOC和MDA活性的影响
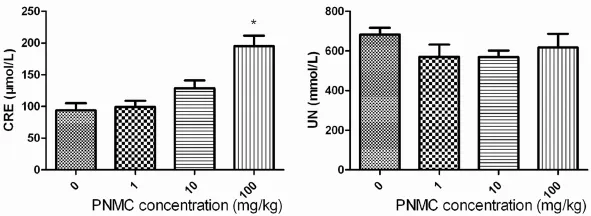
图2 PNMC对大鼠血清肌酐和尿素氮水平的影响注:大鼠经PNMC染毒后,与对照组相比,100mg/kg体重剂量组血清中肌酐水平显著升高,各剂量组尿毒氮水平与对照组相比未见有明显差异P>0.05;*:与对照组相比有显著差异性,P<0.05,n=10
肾脏组织中抗氧化指标检测结果见表3,与血清检测结果不同,PNMC染毒后大鼠肾脏组织中的SOD、GSH-Px和T-AOC的浓度与对照组比较稍有下降,但差异不显著;同样,PNMC染毒后大鼠肾脏组织中MDA的含量与对照组比较稍有升高,但差异也不显著(P>0.05)。
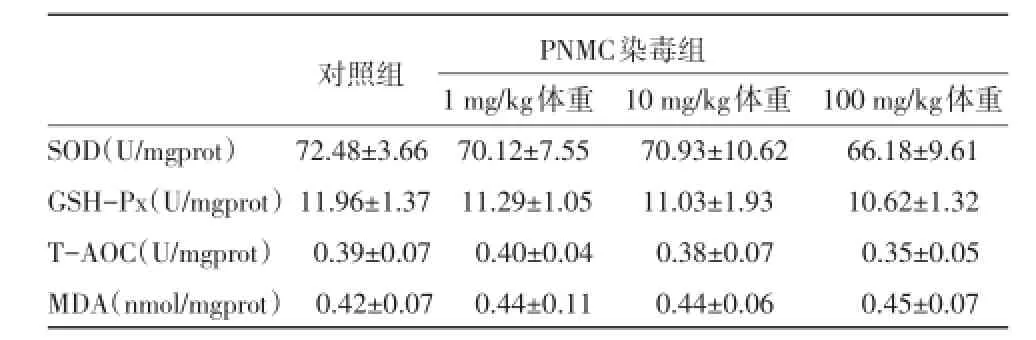
表3 PNMC对大鼠肾脏组织中SOD、GSH-Px、T-AOC和MDA活性的影响
3 讨论
PNMC可通过呼吸道、消化道及皮肤进入动物机体,因此本研究选用皮下注射的方式对大鼠进行染毒。已有研究表明,经PNMC染毒的大鼠增重及器官重量均下降[9]。在本研究中,PNMC染毒后大鼠的体重和平均日增重也显著下降。然而,Li等[10]采用同样的染毒方式未发现PNMC对大鼠体重有明显的影响,这可能归因于选用了不同品系的大鼠,而本研究结果提示SD大鼠对PNMC更为敏感。
剖检结果显示,PNMC染毒组小鼠没有出现明显的大体病变,但是,在100 mg/kg体重PNMC组发现血清中Cre浓度显著升高。血清中Cre浓度是评价肾脏功能的一个常用指标,其浓度升高意味着肾脏功能出现损伤。因此,本研究结果表明,PNMC可以损伤肾脏功能。病理组织学观察结果进一步证明了PNMC对肾脏形态结构的破坏作用。染毒组大鼠肾小管上皮细胞发生坏死,主要位于肾脏的皮髓交界处和髓质部,而且随着染毒剂量的增加,坏死细胞数量也增加,呈现明显的剂量相关性。研究表明,PNMC具有扩张血管的作用[11-12],可造成大鼠肾脏缺血应激,而且肾脏髓质血流量少于皮质,所以髓质区肾小管上皮细胞的病变程度高于皮质区。以上结果表明,PNMC对大鼠肾脏具有毒性作用。
在正常情况下,机体产生的活性氧簇(ROS)的清除有赖于抗氧化酶系统(SOD、GSH-Px和/或过氧化氢酶)和非酶类抗氧化剂(如:谷胱甘肽、维生素E)[13-15]。当这个系统的平衡被破坏,即自由基产生过多和(或)抗氧化防御能力下降,就会造成氧化损伤,自由基可以直接和脂质、蛋白以及DNA反应造成不可逆的损伤,最终导致细胞死亡[16-17]。另外,自由基还可以与存在于细胞膜上的很对不饱和脂肪酸以及胆固醇反应,随后引起细胞凋亡[18]。Donaldson等[19]的研究表明,DEP可以引起小鼠肺脏产生ROS,造成蛋白质氧化、脂质氧化和DNA损伤。在本研究中,大鼠连续5 d皮下注射不同浓度的PNMC后,血清中SOD的含量显著下降,这一结果与PNMC在鸡胚精原细胞的试验结果一致[6];而且血清中T-AOC的含量在10mg/kg体重PNMC染毒组也显著低于对照组,这些结果表明血清中抗氧化酶的活性降低。然而,肾脏组织中的SOD、GSH-Px和T-AOC的含量稍有下降,但与对照组比较差异不显著,同样,MDA的含量也没有明显变化,表明肾脏组织中的抗氧化酶的活性并未受到影响。综上,PNMC染毒后血清中SOD活性降低同时伴有T-AOC的下降,提示大鼠体内氧化系统遭到破坏,生成的活性氧自由基不能被及时清除,导致过多的过氧化物在体内蓄积,对大鼠肾脏造成氧化损伤。
综上所述,本研究揭示了PNMC对大鼠肾脏的损伤作用主要是通过氧化应激引起的,即PNMC通过抑制抗氧化酶的活性引起大鼠肾脏氧化损伤,但这些过程之间的相互作用及调控机制还有待进一步研究。
[1]Tsukue N,Toda N,Tsubone H,et al.Diesel exhaust(DE)affects the regulation of testicular function inmale Fischer 344 rats[J].J Toxicol Environ Health A,2001,63(2):115-26.
[2]Zayed SM,Mahdy F.Decomposition of 14C-fenitrothion under the in fluence of UV and sunlight under tropical and subtropical conditions[J].Chemosphere,2008,70:1653-1659.
[3]Simon-Giavarotti K A,Giavarotti L,Gomes L F,et al.Enhance⁃ment of lindane-induced liver oxidative stress and hepatotoxicity by thyroid hormone is reduced by gadolinium chloride[J].JFree Radic Res,2002,36:1033-1039.
[4]Favier A.Le stress oxidant:Intérêt conceptuel et expérimental dans la compréhension desmécanismes desmaladies et potentiel thérapeutique[J].JL’actualitéChim,2003,108-115.
[5]Papas A M.Determinants of antioxidant status in humans[J].J Lipids,1996,31:S77-S82.
[6]Mi Y,Zhang C,Li C M,et al.Quercetin protects embryonic chicken spermatogonial cells from oxidative damage intoxicated with 3-methyl-4-nitrophenol in primary culture[J].Toxicology Letters,2009,190,61-65
[7]Pan C J,Schmitz D A,Cho A K,et al.Inherent redox properties of diesel exhaust particles:catalysis of the generation of reactive oxygen species by biological reductants[J].ToxicolSci,2004,81,225-232.
[8]Yue Z,She R P,Bao H H,etal.Necrosis and Apoptosis of Renal Tubular Epithelial Cells in Rats Exposed to 3-Methyl-4-Nitro⁃phenol[J].Environmental Toxicology,2012,11(27):653-661.
[9]LiC,Takahashi S,Taneda S,etal.Impairment of testicular func⁃tion in adultmale Japanese quail(Coturnix japonica)after a sin⁃gle administration of 3-methyl-4-nitrophenol in diesel exhaust particles[J].JEndocrinol,2006,189(3):555-564.
[10]Li C M,Taneda S,Suzuki A K,et al.Effects of 3-methyl-4-ni⁃trophenol in diesel exhaust particles on the regulation of testicular function in immaturemale rats[J].Journal of Andrology,2007,28(2):252-258.
[11]Mori Y,Kamta K,Toda N,et al.Isolation of nitrophenols from diesel exhaust particles(DEP)as vasodilatation compounds[J].Bi⁃ol Pharm Bull,2003,26:394-395.
[12]Taneda S,Kamata K,HayashiH,etal.Investigation of vasodilato⁃ry substances in diesel exhaust particles(DEP):Isolation and identification of nitrophenol derivatives[J].JHealth Sci,2004,50:133-141.
[13]NeradilováM,HurbáF,NovákováV,et al.Investigations of the relationship between thyroid function and a-tocopherol concentra⁃tion of serumand in some organs of the rat[J].Int J Vitam Nutr Res,1973,43:283-290.
[14]Benzie IF.Lipid peroxidation:a review of causes,consequences, measurement and dietary influences[J].Int J Food Sci Nutr,1996,47:233-261.
[15]SubudhiU,Dasa K,Paital B,etal.Alleviation of enhanced oxida⁃tive stress and oxygen consumption of L-thyroxine induced hyper⁃thyroid rat liver mitochondria by vitamin E and curcumin[J].J Chem Biol Interact,2008,173:105-114.
[16]BealM F.Mitochondrial dysfunction in neurodegenerative diseas⁃es[J].JBiochim Biophys Acta,1998,1366:211-223.
[17]Beal M F.Mitochondria take centre stage in aging and neurode⁃generation[J].JAnn Neurol,2005,58:495-505.
[18]Mikhailov V,Mikhailova M,Degenhardt K,et al.Association of Bax and Bak homo-oligomers in mitochondria.Bax requirement for Bak reorganization and cytochrome c release[J].Biol Chem,2003,278:5367-5376.
[19]Donaldson K,Stone V,Borm P J,etal.Oxidative stress and calci⁃um signaling in the adverse effects of environmental particles[PM(10)][J].Free Radic BiolMed,2003,34:1369-1382.
S865.1+2
B
0529-6005(2015)11-0087-03
2014-06-13
岳卓(1982-),女,博士,研究方向为动物毒理病理学和生物制品学,E-mail:w16154149@163.com
佘锐萍,E-mail:sheruiping@126.com

