2014-2015年红岛地区水貂阿留申病的流行病学调查研究
戚永娜 杨瑞梅* (青岛农业大学动物科技学院 山东 青岛 266109)
调查报告
2014-2015年红岛地区水貂阿留申病的流行病学调查研究
戚永娜 杨瑞梅* (青岛农业大学动物科技学院 山东 青岛 266109)
为了解2014~2015年山东省青岛市红岛地区水貂阿留申病的流行情况和发病率,对红岛地区某水貂养殖场里的部分水貂采用剪脚趾的方法进行了血清取样,并分别采用碘凝集和对流免疫电泳两种试验方法进行血清学检测,进而总结红岛地区水貂阿留申病的发病率与流行状况。结果显示,红岛地区阿留申病的阳性检出率为63.33%以上,表明红岛地区水貂阿留申病的流行情况较为严重。
水貂阿留申病(Aleutian mink disease,AMD)是由细小病毒科,细小病毒属的阿留申病毒引起的一种慢性进行性传染病[1]。不同年龄阶段的水貂患阿留申病可表现出不同的病症,成年水貂感染阿留申病毒后,表现出典型的水貂阿留申病,以体内浆细胞增多,产生大量的γ球蛋白,持续性的毒血症及由免疫复合物沉积引发的严重肾小球炎等为主要症状[2],临床上主要表现为冬季消瘦、产仔量降低、死胎、流产。而新生幼貂感染该病后病毒大量繁殖于病貂体内的肺泡Ⅱ型细胞,临床症状会出现急性致死性的间质性肺炎。不同的急、慢病症在有些水貂中的表现轻微或某些水貂感染阿留申病毒后不出现明显感染症状的情况[3]。针对水貂阿留申病而言,目前还没有研制出有效的疫苗,所以该病主要依赖于严格检疫、淘汰病貂、断绝疫源来实现貂场净化。
1 材料与方法
1.1 材料
(1)45日龄左右幼貂的待检血清样品30个。(2)试剂:碘试剂、10.3g巴比妥、1.84g巴比妥钠、水貂阿留申病毒抗原和标准阳性血清、1000ml蒸馏水、1.0g琼脂糖粉(3)仪器:载玻片、100ml锥形瓶、玻璃棒、高速离心机、电泳仪、100ml量筒、微量可调加样器、加样头、记号笔、打孔器、针头、打孔样纸、离心管、纱布、电子天平、电热炉、1000ml的烧杯、500ml的量筒、恒温水浴锅
1.2 方法
1.2.1 水貂血样的采集 对红岛地区某水貂养殖场的水貂采用剪脚趾的方法进行取血,将采取的血样滴到离心管中并做上标记,放置于离心管架上。分别在室温和4℃环境中,静止放置2h,使血样自然分层。
1.2.2 血样离心 将分层的血样在4000r/min下离心5min,取出离心管,将其上层血清用微量可调加样器吸出,放入新的离心管中,做上相应的标记。若有未离心好的血清,则再进行一次离心。
1.2.3 碘凝集试验 取一张擦拭干净的载玻片,用微量可调加样器吸取一定量离心好的血清,滴到载玻片上,再滴加等量的碘试剂,用枪头混匀。然后,观察试验结果。对30个血样结果进行统计。
1.2.4 对流免疫电泳试验 (1)巴比妥缓冲液的制备:提前将恒温水浴锅调到80℃左右,用电子天平称取巴比妥10.3g,巴比妥钠1.84g,用量筒量取1000ml的蒸馏水置烧杯中,然后依次加入巴比妥、巴比妥钠,再将烧杯放到水浴锅中,并用玻璃棒不断地搅拌,直至其全部溶解。测其pH值至8.6左右即可。(2)琼脂凝胶的制备:用电子天平称取1.0g的琼脂糖粉,再用量筒量取100ml刚制备好的巴比妥缓冲液,将称取好的琼脂糖粉加入到量取好的巴比妥缓冲液中,放到电热炉上加热至琼脂糖粉溶解完全即可。(3)倒板:用微量可调加样器吸取刚制备好的琼脂糖粉溶液滴到水平放置擦拭干净的载玻片上,滴加到厚度大约为3mm左右,静置一段时间,待溶液凝固,形成琼脂凝胶版。(4)打孔:将倒好的琼脂凝胶板放在打孔模板上进行打孔,每孔间距3~4mm,将打完孔的琼脂凝胶板进行封底,将琼脂凝胶板放在酒精灯火焰的上方来回的移动,待其温度放在手背上稍微有点烫即可停止,冷却至室温便可加样。(5)加样:对打完孔的琼脂凝胶板编号,并标上正负极,左边为正极,右边为负极,按编排好的序号从左边依次加样,正极加待检血清和标准阳性血清,负极加水貂阿留申病毒抗原,均为15μl。每块凝胶板均设标准阴性和阳性血清作对照。(6)电泳:将两侧的电泳槽内加入适量的巴比妥缓冲液,把凝胶板放在中间,用纱布作为连接电流的导体,将纱布放在巴比妥缓冲液中浸湿后,一侧浸在电泳槽的缓冲液中,一侧与凝胶板连接。两个电泳槽均是这样。将电泳仪的电压调至90V,时间40min左右。最后,关闭电源,取出凝胶板,面向阳光或日光灯观察沉淀线,进行结果判定。
2 结果
2.1 碘凝集试验结果
结果判断标准:阳性:两液混合后,出现明显片状或颗粒沉淀物为阳性(包括++++,+++,++,+)。出现大的凝集块、液体完全透明,即100%凝集,用“++++”表示;有明显凝集块、液体几乎完全透明,即75%凝集,用“+++”表示;有可见凝集片、液体不甚透明,即50%凝集,用“++”表示;液体混浊、有小的颗粒状物,即25%凝集,用“+”表示;液体均匀混浊、无凝集物,用“-”表示[4]。对待检血清进行碘凝集后的试验结果:30个样品血清均为“-”。
2.2 对流免疫电泳试验结果
见附表。
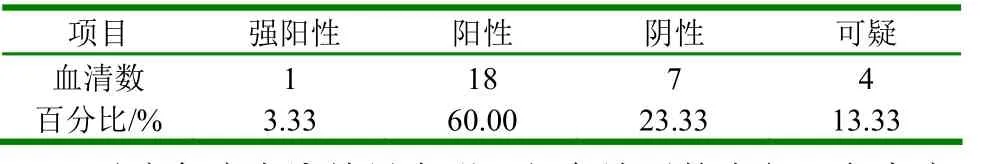
附表 30个血清对流免疫电泳结果
对流免疫电泳结果表明:红岛地区的水貂阿留申病的阳性率为63.33%,该地区的水貂阿留申病感染率达50%以上。
3 讨论
3.1 碘凝集试验与对流免疫电泳结果比较
本次试验中,碘凝集试验的结果是待检血清全部为阴性,而对流免疫电泳试验的结果是待检血清的阳性率为63.33%,二者差异悬殊,其原因有:(1)碘凝集是针对血清中的免疫球蛋白进行凝集,此次调查的是45日龄左右的幼貂,体内抗体含量低,因此结果不明显;(2)对流免疫电泳具有较强的特异性和敏感性,因此出现了大量阳性。(3)另外也表明虽然碘凝集试验简便易行,对试验条件的要求低,但与对流免疫电泳试验相比,其在诊断水貂阿留申病中由于特异性和敏感性都要低于对流免疫电泳试验,所以碘凝集的试验结果不如对流免疫电泳的试验结果准确。
3.2 水貂阿留申病的流行现状
AMD广泛流行于世界各养貂国家,我国各地水貂饲养场也普遍流行。本病主要传染源是病貂和潜伏期病貂。其潜伏期平均为2~3个月,长的可达7~9个月甚至1年以上[5]。现今情况下,水貂阿留申病还未能引起养殖户的足够重视,对水貂的检疫力度不够,对阳性貂没有及时的淘汰,致使病毒通过体液和排泄物传到体外,污染了貂场的环境,导致貂群整体的感染率逐年升高,从而引起该病大面积的流行[6]。流行病学调查显示,我国主要养貂地区有70%以上的饲养场不同程度地感染该病,感染率约在10%~60%不等[7]。2009~2010年,张彦龙等[8]从我国3个独立的貂场共收集18654份水貂血清样本。结果显示总体阳性率分别为为94.59%和68.67%,表明我国水貂养殖业的阿留申病毒感染率仍然居高不下。本次调查结果显示水貂阿留申病的阳性率为63.33%,则表明红岛地区的水貂阿留申病较为严重。
3.3 水貂阿留申病的防治措施
目前还未研制出有效的疫苗,所以最根本而有效的清除阿留申病的方法只能靠准确的诊断和即时扑杀病貂,在打皮时扑杀阳性(病)貂[9]。如条件限制不能杀死全部的病貂时,可先扑杀患重病的貂,将病轻和阴性(健康)的貂,分群隔离饲养,逐步淘汰,条件允许时再打皮,就可达到逐步净化貂群的目的,使貂场变成无阿留申病的貂场[10]。故控制本病仅能依赖于严格检疫、淘汰病貂、断绝疫源来实现貂场净化。
[1] 冯贵娟. 水貂阿留申病流行特点及防治技术[J]. 山东畜牧兽医, 2012, 8: 71.
[2] 徐凤宇, 王树志. 水貂阿留申病概述[J]. 经济动物学报, 2006, 2: 106-111.
[3] 黄永凯, 周煜, 孔德军. 水貂阿留申病[J]. 云南畜牧兽医, 2006, 5: 41.
[4] 姚彬, 杜杰, 刘倩宏. 水貂阿留申病碘凝集反应与对流免疫电泳对比试验[J]. 吉林农业科技学院学报, 2014, 2: 14-16.
[5] 周春凤, 张志亭. 水貂阿留申病的诊治[J]. 养殖技术顾问, 2008, 2: 50.
[6] 陈超然, 温建新. 威海某地区水貂阿留申病的诊断与调查[J]. 天津农业科学, 2014, 4: 17-20.
[7] 张春艳, 林明敏, 宫彦超. 水貂的阿留申病及其防控[J]. 山东畜牧兽医, 2013, 7: 62-63.
[8] 桑宇. 水貂阿留申病流行病学调查[D]. 东北林业大学, 2012.
[9] 李玉梅. 水貂阿留申病的诊断与防治[J]. 吉林畜牧兽医, 2007, 4: 48-49.
[10] 宋月峰, 宋晓东, 王晓龙. 水貂阿留申病的防治[J]. 中国动物保健, 2013, 4: 69-70.
S858.92
A
1007-1733(2015)12-0042-02
2015–10–09)
*通讯作者

