马立克氏病病毒分子生物学研究进展
李晓青 (河北省任丘市畜牧水产局 062550)
马立克氏病病毒分子生物学研究进展
李晓青 (河北省任丘市畜牧水产局 062550)
马立克氏病(Marek´s disease, MD)是由鸡的马立克氏病病毒(Marek´s disease virus, MDV)引起的鸡的一种肿瘤性疾病,以淋巴细胞增生和肿瘤的形成为主要特征,以外周神经、生殖腺、脏器、免疫器官中单核细胞浸润以及由于外周神经肿瘤细胞的集聚而引起的半瘫痪或完全瘫痪为典型特征。匈牙利著名的兽医病理学家马立克在1907年首先报道了该病,英国科学家Biggs在1961年倡导开始使用马立克氏病这一名称[1]。上世纪二、三十年代,随着商品鸡的死亡数目的明显增加,人们开始逐步关注马立克氏病。1967年,Churchill等首次报道从接种病鸡细胞的培养物中分离到了疱疹病毒[2]。1970年,Calnek等发现MDV可以以一种具有感染性的游离细胞形式从羽毛囊排出[3],由于马立克氏病毒在鸡舍环境中能够相对稳定存在,易感鸡呼吸系统接触到空气中带有病毒的灰尘或羽屑,都可以引起MD的自然传播。
直到上世纪80年代,对MD肿瘤细胞的T细胞特性,肿瘤诱导的成淋巴细胞样细胞系的建立,疾病的溶细胞期和免疫抑制期的确定等研究取得了重大的科研成果。CVI988与SB-1等疫苗株的分离鉴定以及广泛使用,更使得MD成为第一个可以用疫苗免疫的肿瘤性疾病。随着MDV不断的遗传变异,毒力不断的增强,越来越多的疫苗也随之被研制应用。近年来发现在MDV的疫苗免疫后仍有很高肿瘤发病率的鸡群中,依然能分离到MDV,并且大多数病例是MDV和REV的共感染,即在肿瘤病鸡同时存在着这两种病毒的病毒血症[4]。同时大量的试验已经证实MDV和REV以及其它反转录病毒可以进行病毒的基因重组。2000年以来,随着生物学技术的发展,对MDV的研究更是突飞猛进,目前已绘制出了MDV强毒标准株GA株的全基因组结构图[5]。Schumacher、Reddy分别构建了含有MDV全基因组的感染性克隆,对进一步研究MDV基因功能以及全基因组测序提供了更可靠的途径。
1. MDV基因组结构
通过全基因组测序证实,三种血清型的MDV基因组相似,由线性的双股DNA组成,长约175kb,分别由末端长重复序列(TRL)、长独特区(UL)、内部长重复序列(IRL)、内部短重复序列(IRS)、短独特区(US)和末端短重复序列(TRS)组成,其中TRL、IRL、IRS、TRS为倒置重复序列。MDV基因组结构模式为TRL-UL-IRL-IRS-USTRS见图1。
2000年,Lee等首次绘制了I型MDV GA株的全基因组图谱(图2),为今后MDV全基因组分析提供了可参考的依据。通过比较超强毒Md5与GA株基因组,发现I型MDV结构差异很小,GA的基因组比Md5稍微小一点,主要是由于Md5基因组中的TRL和IRL区域内直接重复序列拷贝数的增加以及IRS和TRS区域长度的增加。
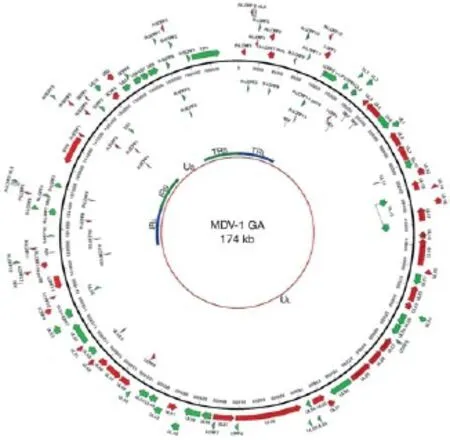
图2 I型MDV GA株的全基因组结构图
2 MDV结构蛋白及相关基因
I型MDV编码一百多个蛋白质,虽然已经对MDV基因组上的70~80个特异的基因或区域的生物学功能进行相关研究,但至今通过对MDV感染细胞的提取物进行免疫沉淀试验得到鉴定仅有46个MDV特异性的多肽[6]。其中仅有为数不多的几个基因在MDV抗原和功能上是有重要作用的。因此将MDV基因根据在抗原和功能上的作用分为三大类即:(1)与致肿瘤相关基因:meq、pp38/pp24、v-IL8、和1.8Kb基因家族等[7];(2)糖蛋白基因:gB、gC、gD、gE、gM、gI、gK、gL;(3)其它基因。
2.1 与致肿瘤相关基因 (1)meq:I型MDV的基因组中含有两个拷贝的meq基因,meq基因由339个氨基酸组成,在其N末端含有一个与jun/fos致癌基因家族相似的亮氨酸拉链(bZIP)结构域,而在C末端富含与WT-1肿瘤抑制基因相似的脯氨酸的重复区域[8]。Meq蛋白在淋巴瘤细胞和肿瘤细胞系的细胞核中恒有表达[9],在S期的细胞浆中也有表达。Meq蛋白在大鼠细胞中过量表达可以引起大鼠细胞凋亡抑制[10],并且与细胞调控因子CDK2的相互作用[11,36],证实meq基因与MDV致肿瘤性密切相关。与致病型的I型MDV不同,MDV疫苗CVI988/Rispens中有一段178bp的插入序列,导致C末端编码富含脯氨酸结构域的阅读框架发生移位[12]。大量的试验都已证实MDV基因组中的meq基因与其致瘤作用密切相关[13]。Reddy等人利用粘粒作为载体,构建了Md5株的感染性克隆[14],Lupiani等人在此基础上利用同源重组的方法敲除掉Md5感染性克隆中的两个meq基因,构建的重组病毒完全丧失了原始毒株的致肿瘤作用[15],而且敲除了meq基因的重组病毒rMd5∆meq可以作为疫苗有效的预防超强毒甚至特超强毒的攻击[16]。(2)pp38/pp24:MDV磷酸化蛋白复合物,通常称之为pp38/pp24,由位于TRL和UL区域的pp24基因和位于IRL和UL区域的pp38基因编码[17],是MD肿瘤细胞及细胞系中唯一能检出的的一种MDV特异性抗原[18]。试验表明,pp38基因能够引起鸡的免疫抑制[19],在MDV感染的早期就能检测到其表达[20]。Reddy研究表明,pp38基因对MDV的复制有非常重要的作用,但是并不影响肿瘤的形成[21]。研究表明pp38/pp24对其上游的双向启动子的活性有调控作用[22],可以调控pp38/pp24和1.8kb基因家族的转录。(3)v-IL8:致肿瘤毒株(RB1B、Md5)的vIL-8基因的缺失证实vIL-8并不影响MDV的转化和潜伏期,但是与早期的裂解性复制和靶细胞的吸引有关[23]。v-IL8基因缺失突变株能显著降低感染鸡的肿瘤率[24]。(4)1.8kb基因家族:几个极早期转录子起源于1.8kb基因家族(又称1.8kb mRNA)。1.8kb mRNA包含3个外显子,位于MDV基因组的UL和IRL连接区。虽然1.8kb基因家族能转录不同的mRNA,但是仅在MDV强毒株中表现出很强的转录活性。1.8kb mRNA对其上游双向启动子活性具有增强作用,其开放阅读框A和C对鸡的致瘤性有一定的影响。1.8kb mRNA转录方向与pp38基因相反,转录起始位点位于相对pp38起始位点的-670到-680处[25]。试验研究证实,随着MDV的连续传代,其基因组中的132bp串联重复序列拷贝数增加,导致1.8kb mRNA基因家族会发生扩增。随着MDV的连续传代,导致1.8kb mRNA转录产物丢失,病毒致病性也会逐渐减弱。由于具有致瘤性的MDV强毒株中只有2~3个拷贝的132bp重复序列,而在非致瘤毒株中这一132bp重复序列的拷贝数不等[26],同时敲除掉致病性MDV 基因组中2个拷贝的132bp串联重复序列后,其致肿瘤性以及MDV早期的复制能力均没有变化,连续传代后,MDV毒力也能够致弱,这说明病毒的致弱机制与132bp串联重复序列是无关的[27],也进一步表明1.8kb基因家族的转录产物或者它们编码的蛋白质与MDV的致瘤性密切相关。
2.2 糖蛋白基因 MDV的糖蛋白B是一种重要的MDV中和性抗原,能够诱导鸡体产生中和抗体,与保护性免疫应答相关,对于细胞吸附和MDV进入很重要。糖蛋白B不具有分泌特性,仅存在于细胞的胞浆中。(1)gB基因:MDV的糖蛋白B是一种重要的MDV中和性抗原,能够诱导鸡体产生中和抗体,与保护性免疫应答相关,对于细胞吸附和MDV进入很重要。糖蛋白B不具有分泌特性,仅存在于细胞的胞浆中。(2)gC基因:MDV糖蛋白gC由UL44编码,同时被称为MDV的“A抗原”[28]。虽然糖蛋白gC也涉及到细胞对病毒的吸附,但是其同时具有干扰其他糖蛋白的功能。MDV在CEF细胞上经过连续的传代培养,病毒毒力减弱,糖蛋白C的表达水平明显降低。尽管糖蛋白gC的表达和毒力有明显的联系,但是在某些弱毒中糖蛋白gC的表达量却维持在一个较高的水平,因此至今没有证实gC涉及到MDV的毒力[29]。(3)gD基因:gD是由US6编码的,对于它的功能至今不明确。试验研究表明gD在体外不能很好的表达甚至完全不表达。(4)gE、gI、gK、gL、gM:试验证实gEgI复合物和gMUL49.5复合物对于MDV的排出有关。如果缺失MDV基因组中的gE或gI基因,重组病毒不能够在鸡的成纤维细胞间传播,不再形成MDV特有的细胞病变。因此gE基因和gI基因是MDV在细胞与细胞之间传播所必需的。2.3 其它基因 近年来,随着各种生物学技术的发展,越来越多的MDV基因功能被人们所认识,但是还有一些基因的功能不能确定,只是根据其它疱疹病毒的同源物推断得出。如:UL36、UL45、UL46、UL47、UL48、UL49、及US1、US2、US10等衣壳蛋白类基因;UL12、UL13、UL23、UL30等具有调控活性或者酶活性的蛋白质基因。
[1] Biggs P. M.. A discussion on the classification of the avian leucosis complex and fowl paralysis. B. Ve. J., 1961, 117: 326-334.
[2] Churchill A. E. and Biggs P. M.. Agent of Marek’s disease in tissue Culture. Nature, 1967, 215: 528-530.
[3] Calnek B. W., Adldinger H. K., Kahn D. E.. Feather follicle epithelium: a source of enveloped and infectious cell-free herpesvirus from Marek's disease. Avian Dis., 1970, 14(2): 219-233.
[4] 金文杰, 崔治中, 刘岳龙等. 传染性法氏囊病病料中MDV、CAV、REV的共感染检测[J]. 中国兽医学报, 2001, 1: 6-9.
[5] Lee L. F., Wu P., Sui D., Ren D., Kamil J., Kung H. J., Witter R. L.. The complete unique long sequence and the overall genomic organization of the GA strain of Marek's disease virus. Proc. Natl. Acad. Sci. USA, 2000, 97(11): 6091-6096.
[6] Ikuta K., Nishi Y., Kato S., Hirai K.. Immunoprecipitation of Marek's disease virus-specific polypeptides with chicken antibodies purified by affinity chromatography. Virology, 1981, 114(1): 277-281.
[7] Osterrieder N., Kamil J. P., Schumacher D., Tischer B. K., Trapp S..Marek's disease virus: from miasma to model. Nat. Rev. Microbiol., 2006, 4(4): 283-94.
[8] Jones D., Lee L., Liu J. L., Kung H. J., Tillotson J. K.. Marek disease virus encodes a basic-leucine zipper gene resembling the fos/jun oncogenes that is highly expressed in lymphoblastoid tumors. Proc. Natl. Acad. Sci. USA, 1992, 89(9): 4042-4046.
[9] Qian Z., Brunovskis P., Rauscher F. 3rd., Lee L., Kung H. J.. Transactivation activity of Meq, a Marek's disease herpesvirus bZIP protein persistently expressed in latently infected transformed T cells. J. Virol., 1995, 69(7): 4037-4044.
[10] Liu J. L., Ye Y., Lee L. F., Kung H. J.. Transforming potential of the herpesvirus oncoprotein MEQ. Morphological transformation, serumindependent growth, and inhibition of apoptosis. J. Virol., 1998,72(1):388-395.
[11] Liu J. L., Lin S. F., Brunovskis P., Li D., Davidson I., Lee L. F,. Kung H. J.. MEQ and v-IL8: cellular genes in disguise? Acta. Virol., 1999, 43(2-3):94-101.
[12] Lee S. I., Takagi M., Ohashi K., Sugimoto C., Onuma M.. Difference in the meq gene between oncogenic and attenuated strains of Marek's disease virus serotype 1. J. Vet. Med. Sci., 2000, 62(3): 287-292.
[13] Brown A. C., Baigent S. J., Smith L. P., Chattoo J. P., Petherbridge L. J., Hawes P., Allday M. J., Nair V.. Interaction of MEQ protein and C-terminal-binding protein is critical for induction of lymphomas by Marek′s disease virus. Proc. Natl. Acad. Sci., 2006, 103: 1687-1692.
[14] Reddy S. M., Lupiani B., Gimeno I. M., Silva R. F., Lee L. F., Witter R. L.. Rescue of a pathogenic Marek's disease virus with overlapping cosmid DNAs: use of a pp38 mutant to validate the technology for the study of gene function. Proc. Natl. Acad. Sci. USA, 2002, 99(10): 7054-7059.
[15] Lupiani B., Lee L. F., Cui X., Gimeno I., Anderson A., Morgan R. W., Silva R.F., Witter R. L., Kung H. J., Reddy S. M.. Marek′s disease virusencoded Meq gene is involved in transformation of lymphocytes but is dispensable for replication.. Proc. Natl. Acad. Sci. USA, 2004, 101: 11815-11820.
[16] Lee L. F., Lupiani B., Silva R. F., Kung H. J., Reddy S. M.. Recombinant Marek's disease virus (MDV) lacking the Meq oncogene confers protection against challenge with a very virulent plus strain of MDV. Vaccine, 2008, 26(15): 1887-1892.
[17] Zhu G. S., Iwata A., Gong M., Ueda S. and Hirai K.. Marek's disease virus type 1-specific phosphorylated proteins pp38 and pp24 with common amino acid termini are encoded from the opposite junction regions between the long unique and inverted repeat sequences of viral genome. Virology, 1994, 200(2): 816-820.
[18] Nakajima K., Ikuta K., Naito M., Ueda S., Kato S., Hirai K.. Analysis of Marek's disease virus serotype 1-specific phosphorylated polypeptides in virus-infected cells and Marek's disease lymphoblastoid cells. J. Gen. Virol., 1987, 68(Pt 5): 1379-1389.
[19] Pratt W. D., Cantello J., Morgan R. W., Schat K. A.. Enhanced expression of the Marek's disease virus-specific phosphoproteins after stable transfection of MSB-1 cells with the Marek's disease virus homologue of ICP4. Virology, 1994, 201(1): 132-136.
[20] Parcells M. S., Dienglewicz R. L., Anderson A. S., Morgan R. W.. Recombinant Marek's disease virus (MDV)-derived lymphoblastoid cell lines: regulation of a marker gene within the context of the MDV genome. J. Virol., 1999, 73(2): 1362-1373.
[21] Reddy S. M., Witter R. L. Gimeno I.. Development of a quantitativecompetitive polymerase chain reaction assay for serotype 1 Marek's disease virus. Avian Dis., 2000, 44(4): 770-775.
[22] Ding J., Cui Z., Lee L. F., Cui X., Reddy S. M.. The role of pp38 in regulation of Marek’s disease virus bi-directional promoter between pp38 and 1.8-kb mRNA. Virus Genes, 2006, 32: 193-201.
[23] Parcells M. S., Lin S. F., Dienglewicz R. L., Majerciak V., Robinson D. R., Chen H. C., Wu Z., Dubyak G. R., Brunovskis P., Hunt H. D., Lee L. F., Kung H. J.. Marek's disease virus (MDV) encodes an interleukin-8 homolog (vIL-8): characterization of the vIL-8 protein and a vIL-8 deletion mutant MDV. J. Virol., 2001, 75(11): 5159-5173.
[23] Cui X., Lee L. F., Reed W. M., Kung H. J., Reddy S. M.. Marek's disease virus-encoded vIL-8 gene is involved in early cytolytic infection but dispensable for establishment of latency. J. Virol., 2004, 78(9): 4753-4760.
[24] Kawamura M., Hayashi M., Furuichi T., Nonoyama M., Isogai E., Namioka S.. The inhibitory effects of oligonucleotides, complementary to Marek's disease virus mRNA transcribed from the BamHI-H region, on the proliferation of transformed lymphoblastoid cells, MDCC-MSB1. J. Gen. Virol., 1991, 72 (5): 1105-1011.
[25] Maotani K., Kanamori A., Ikuta K., Ueda S., Kato S., Hirai K.. Amplification of a tandem direct repeat within inverted repeats of the Marek’s disease virus DNA during serial in vitro passage. J. Virol., 1986, 58: 657-659.
[26] Silva R. F., Gimeno I.. Oncogenic Marek's disease viruses lacking the 132 base pair repeats can still be attenuated by serial in vitro cell culture passages. Virus Genes, 2007, 34(1): 87-90.
[27] Binns M. M., Ross N. L.. Nucleotide sequence of the Marek's disease virus (MDV) RB-1B A antigen gene and the identification of the MDV A antigen as the herpes simplex virus-1 glycoprotein C homologue. Virus Res., 1989, 12(4): 371-381.
[28] Osterrieder N. Construction and characterization of an equine herpesvirus 1 glycoprotein C negative mutant. Virus Res., 1999, 59(2): 165-177.
[29] Schumacher D., Tischer B. K., Reddy S. M., Osterrieder N.. Glycoproteins E and I of Marek’s disease virus serotype 1 are essential for virus growth in cultured cells. J. Virol., 2001, 75: 11307-11318.
S852.62+92
A
1007-1733(2015)12-0058-03
2015–09–07)

