不同西兰花品种中硫代葡萄糖苷的组分与含量分析
丁云花,何洪巨,宋曙辉,简元才,赵学志,王文琪
(北京市农林科学院蔬菜研究中心,100097)
硫代葡萄糖苷(Glucosinolates,简称硫苷)是西兰花及其他十字花科蔬菜作物中一类重要的次生代谢物,在内源黑芥子酶(Myrosinase)的水解作用下,可产生异硫氰酸盐和硫氰酸盐等一系列重要的生物活性物质[1]。许多研究表明,这类活性物质具有抵抗细菌、真菌、病毒和蚜虫等功效[2~6],同时还具有抗氧化、延缓衰老、防癌抗癌等作用,对人类身体健康具有重要的作用,如由4-甲基硫氧丁基硫苷(Glucoraphanin,RAA)水解产生的萝卜硫素和由3-甲基吲哚基硫苷(GBC)水解产生的3-吲哚-甲醇被研究证实具有抗癌功效[7~10]。由于西兰花中含有的莱菔硫烷和异硫代氰酸盐具有很强的防癌抗癌功能[11~15],西兰花的营养保健价值受到越来越多科研人员的关注。
西兰花不同品种之间硫苷含量存在明显的差异,Vallej等[14]研究发现,生长条件一致的12个西兰花品种中,最高的硫苷含量为28.3 μmoL/g(干质量,下同),最低的仅3.0 μmoL/g。因此,在西兰花品质育种中,硫苷组分与含量是一个值得关注的重要指标。本研究对24个综合表现优良的候选品种和5个市场上流通品种的硫苷组分和含量进行了测定与分析,以期为选育高硫苷含量的西兰花品种提供科学依据。
1 材料与方法
1.1 试验材料
供试的29个西兰花品种由北京市农林科学院蔬菜研究中心提供。所有品种于2012年春季种植于露地,田间常规管理,花球长至直径12~13 cm时采收。品种名称及来源详见表1。
1.2 试验方法
①硫苷的提取 取新鲜西兰花的花球,分割成小块,真空冷冻干燥。称取冷冻干样0.2 g,放入15 mL塑料管中。加入内标TRO(苯甲基硫苷)0.25 mL,迅速加入100%预热的甲醇,在80℃下水浴20 min,每隔4~5 min涡旋1次。3 000 r/min下离心10 min,取上清液倒入15 mL塑料管中,放在冰盆中。继续用70%的甲醇提取2次沉淀物,同上述处理,合并上清液,即为样品液。取一次性注射器,加入玻璃棉,塞紧,放在试管上。加入DEAE胶溶液2 mL,用2 mL双蒸水洗涤,然后加入样品液2 mL。待样品液不再滴下时,加入0.02 mol/L的NaAc溶液。待不再有液体滴下,将注射器转移到另一试管上,并加入75 μL硫酸酯酶溶液,封口过夜。将过夜的注射器,用双蒸水洗涤3次,每次0.5mL。用注射头挤压注射器,使液体尽可能转移到试管中。将试管中液体通过0.45 μm的滤膜转移到小玻璃瓶中,冷冻保存,待测。
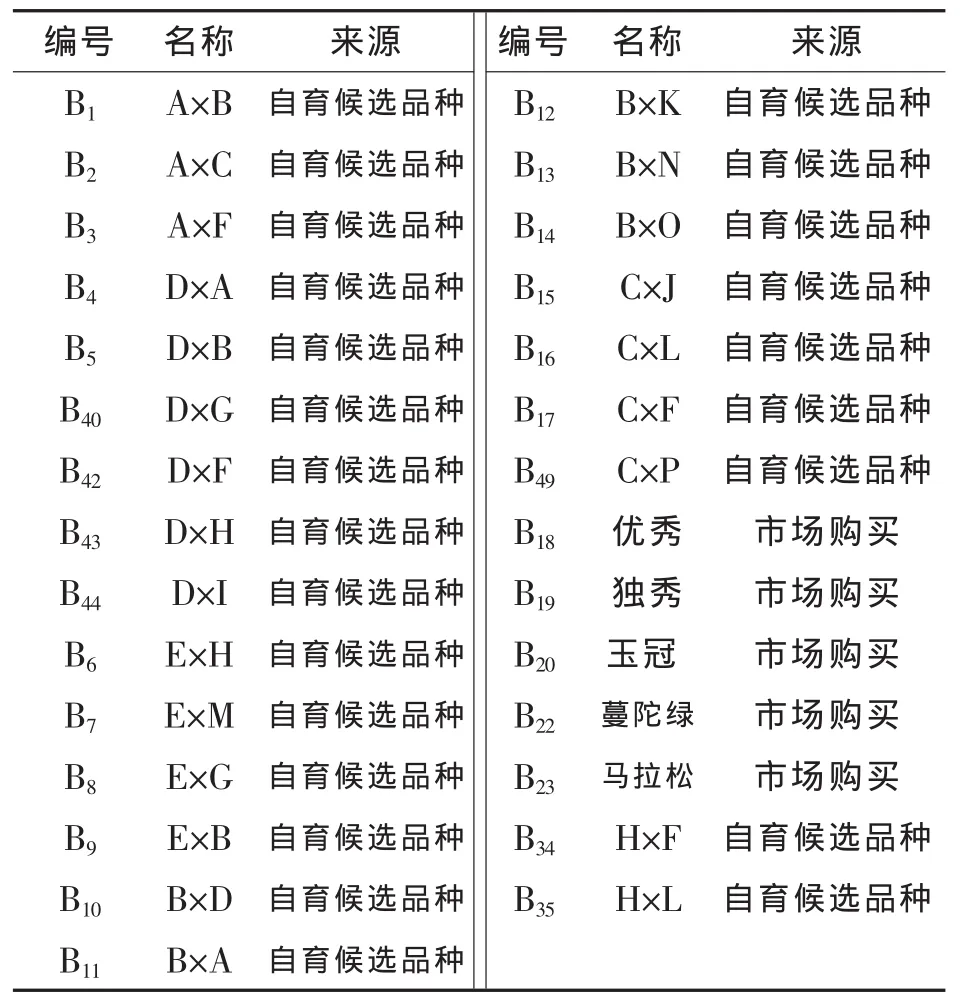
表1 29个西兰花品种及来源
②硫苷的分析 HPLC分析条件:Waters C18色谱柱,3.9mm×150 mm,5μm;检测波长229nm;柱温25℃;进样量10μL;流动相流速为1.0 mL/min,梯度洗脱条件见表2。
流动相 A:1 g四甲基氯化铵(TMACl)溶于2.0 L双蒸水中,混匀,抽滤。
流动相 B:1 g 四甲基氯化铵(TMACl)溶于1.6 L双蒸水中,加入400 mL色谱纯乙腈,混匀,抽滤。
采用苯甲基硫苷作为内标,根据保留时间和峰面积对硫苷组分定量测定。利用内标和响应因子来计算硫苷的含量,以μmoL/g为单位。
2 结果与分析
2.1 西兰花硫代葡萄糖苷的组分与分布
采用HPLC法检测,以苯甲基硫苷(Glucotropaeolin,TRO)为内标,根据保留时间及特征峰形面积对西兰花硫苷组分进行定性和定量测定。结果可以检测到8种硫苷:3-甲基硫氧烯丙基硫苷(Glucoiberin,IBE)、 2-羟基-3-丁烯基硫苷(Progoitrin,PRO)、4-甲基硫氧丁基硫苷(Glucoraphanin,RAA)、3-丁烯基硫苷(Gluconapin,NAP)、4-羟基吲哚基-3-甲基硫苷 (4-Hydroxyglucobrassicin,4OH)、3-甲基吲哚基硫苷(Glucobrassicin,GBC)、4-甲氧基吲哚基-3-甲基硫苷(4-Methoxyglucobrassicin,4ME)、 1-甲氧基吲哚基-3-甲基硫苷(Neoglucobrassicin,NEO)。根据侧链R基团的不同,前4种属于脂肪族硫代葡萄糖苷,后4种属于吲哚族硫代葡萄糖苷。29个西兰花品种所含8种硫苷的含量见表3。
表3表明,29个西兰花品种中8种硫苷的总含量均值为11.27 μmol/g,其中吲哚族硫苷含量与脂肪族硫苷相比,总体略高,各占53.06%和46.94%。在各组分中,RAA含量最高,占总硫苷含量的34.78%;其次是 GBC,占 25.02%;第 3是 NEO,占 23.25%(表4)。说明RAA、GBC和NEO是西兰花中3种主要的硫苷成分。
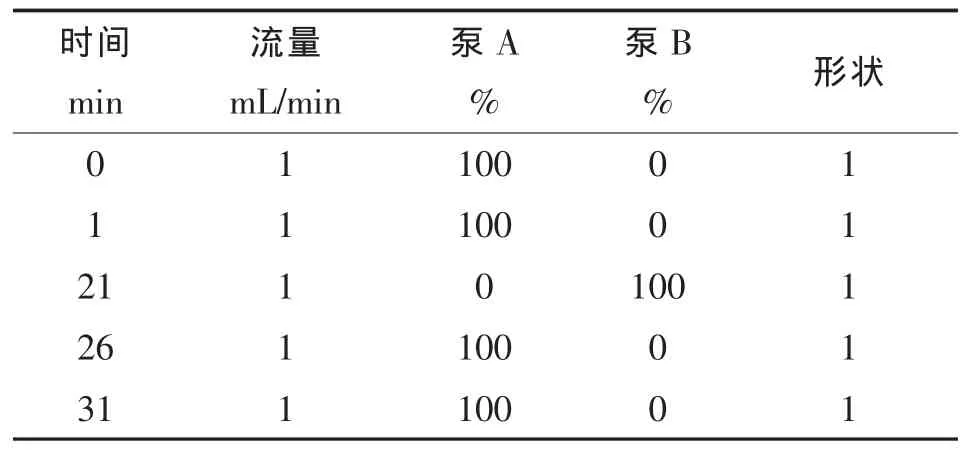
表2 脱硫硫苷的HPLC梯度洗脱条件

表3 西兰花不同品种的硫代葡萄糖苷组成及含量 μmoL/g
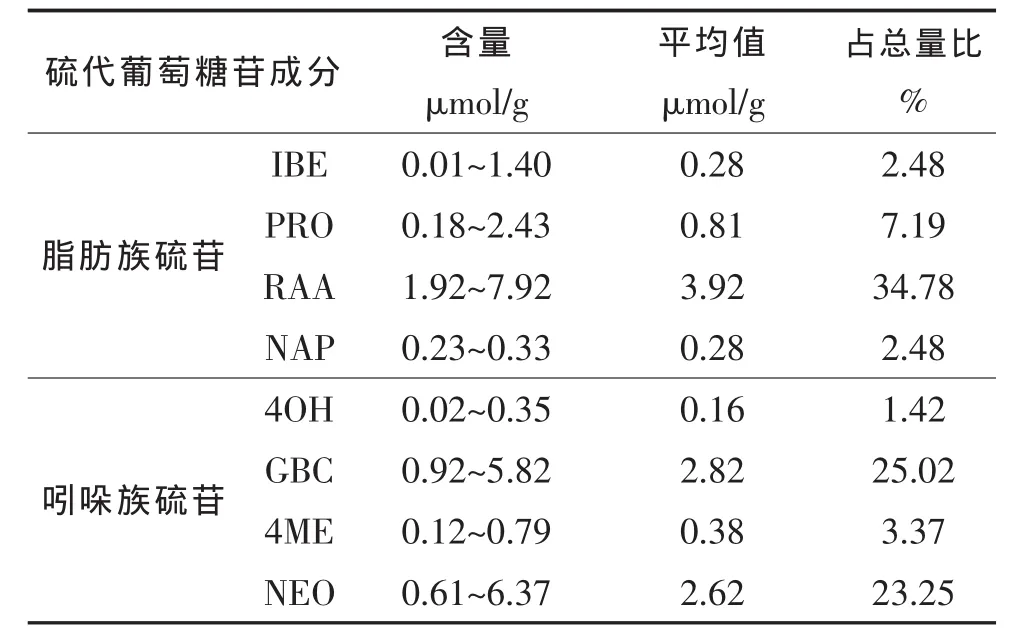
表4 西兰花硫代葡萄糖苷成分与分布
2.2 不同西兰花品种总硫代葡萄糖苷含量
图1显示,29个西兰花品种的总硫苷含量存在较大差异,最高含量是最低的3倍。其中B20和B15的总硫苷含量较高;其次是B19、B9、B35;最低的是B7。以 2 μmol/g为单位分级,从 4~18 μmol/g区间,每级的品种数目分别是 1、3、5、9、7、2、2 个,说明大多数品种的总硫苷含量都分布在中间值附近,高含量和低含量的品种占少数。
2.3 不同西兰花品种脂肪族硫代葡萄糖苷含量
由表3可知,29个西兰花品种均检测出IBE、PRO、RAA和NAP 4种脂肪族硫苷。该4种脂肪族硫苷的总含量在不同品种之间存在差异 (图2),其中含量最高的是B15,达11.01 μmol/g,其次是 B9,最低的是 B4,仅2.81 μmol/g,约为 B15的1/4。其余 26 个品种的脂肪族硫苷含量为 2.85~7.03 μmol/g。在脂肪族硫苷含量中贡献最大的硫苷成分是RAA,它占4种脂肪族硫苷总量的74.10%;而IBE、PRO和NAP的含量分别仅占脂肪族硫苷总量的5.29%、15.31%和5.29%。而RAA的含量以B9最高,其次是B1,最低的是B4。
2.4 不同西兰花品种吲哚族硫代葡萄糖苷含量
4 种 吲 哚 族 硫 苷 4OH、GBC、4ME 和NEO在29个西兰花品种中均有检出,总含量在不同品种之间也存在较大差异 (图3),变异范围在 2.75~10.91 μmol/g,B35、B20、B42和B19的吲哚族硫苷含量较高,均在9.0 μmol/g以上。在吲哚族硫苷含量中贡献最大的为GBC和NEO两种硫苷成分,它们分别占4种吲哚族硫苷总量的47.16%和43.81%;4OH和4ME的含量很少,仅占吲哚族硫苷总量的2.68%和6.35%。GBC含量较高的品种有 B20、B19、B40、B22、B49和 B42,均高于 4.0 μmol/g;NEO含量较高的品种有 B35、B42、B16等,均高于 4.4 μmol/g。
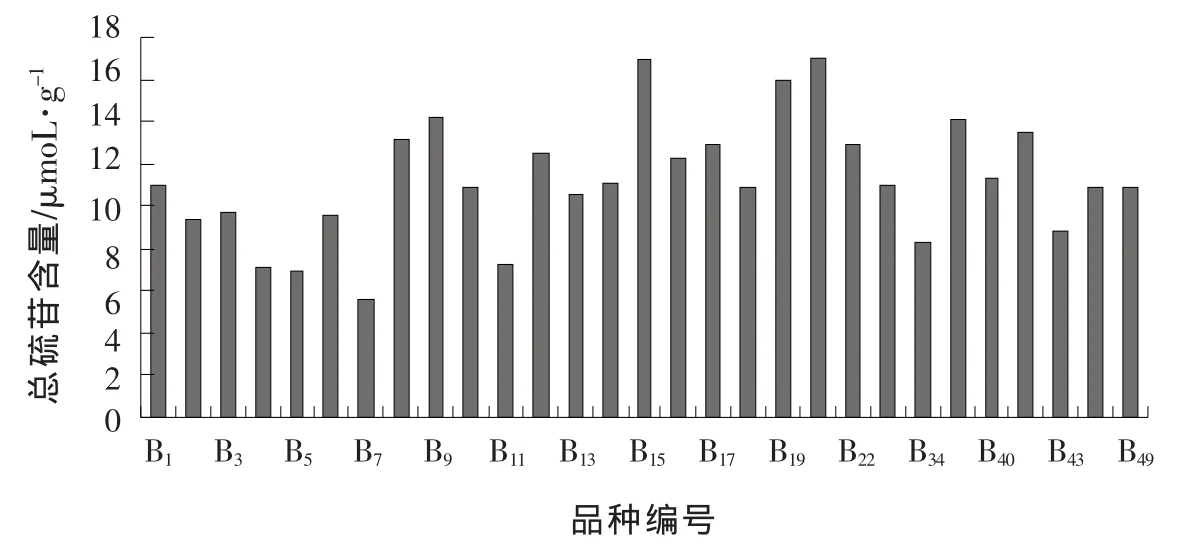
图1 不同西兰花品种总硫代葡萄糖苷含量
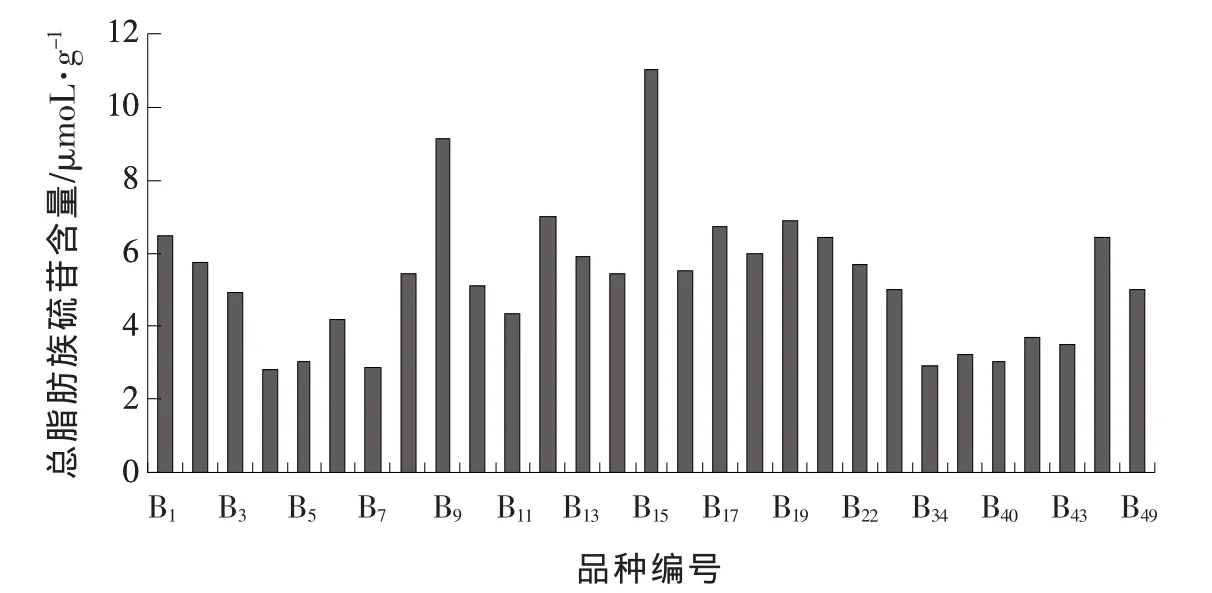
图2 不同西兰花品种总脂肪族硫代葡萄糖苷含量

图3 不同西兰花品种总吲哚族硫代葡萄糖苷含量
3 讨论与结论
本研究的29个品种中,B18~B23为市场上流通的品种,总硫苷含量 10.99~17.04 μmol/g;其他品种均为商品性优良的候选品种,其中B1~B3来自同一个母本,总硫苷含量 9.34~11.00 μmol/g;B4、B5、B34、B40~B43来自同一个母本,总硫苷含量 6.93~13.50 μmol/g;B6~B9来自同一个母本,总硫苷含量5.60~14.19 μmol/g;B10~B14来自同一个母本,总硫苷含量7.22~12.50 μmol/g;B15~B17、B35、B44、B49来自同一个母本,总硫苷含量 10.90~16.96 μmol/g。由此可见,不同亲本来源的品种总硫苷含量都存在较大的变异范围,但 B15~B17、B35、B44、B49这 组 品 种 的 总 硫 苷 含 量 与B18~B23这组市场上流通的商品种基本接近,都处于比较高的水平。前人研究证明,不同品种间由于基因型不同硫苷种类与含量存在差异[16],本研究也说明不同基因型的品种硫苷含量存在差异,而B15这组品种的亲本在西兰花富硫苷的品质育种上或许更有利用价值。
硫苷在同一植物不同器官中含量也存在明显差异,快速生长的幼嫩部位硫苷含量要高于成熟或衰老组织,如种子和幼芽中的硫苷总量为70~100 mmol/g(鲜质量),而同一品种在营养生长后期,总硫苷含量一般只有1~4 mmol/g(鲜质量)[17,18]。本研究从蔬菜育种角度考虑,西兰花的商品器官是成熟的花球,因此考量的是西兰花商品球的硫苷成分与含量,至于花球中硫苷含量高的品种,其种子和幼芽及其他组织器官的硫苷含量是否也高还有待进一步的研究。
[1]Oginsky E L,Stein A E,Greer M A.Myrosinase activity in bacteria as demonstrated by the conversion of progoitrin to goitrin[J].Exp Biol Med,1965,119(2):360-364.
[2]Kliebenstein D,Pedersen D,Barker B,et al.Comparative analysis of quantitative trait loci controlling glucosinolates,myrisubase and insect resistance inArabidopsis thaliana[J].Genetics,2002,161(1):325-332.
[3]Kliebenstein D,Pedersen D,Barker B,et al.Chemical defenses of crucifers:elicitation and metabolism of phytoalexins and indole-3-acetonitrile in brown mustard and turnip[J].Phytochemistry,2002,59(16):611-625.
[4]Hashem F A,Saleh M M.Antimicrobial components of some cruciferae plants (Diplotaxis harraForsk.andErucariamicrocarpaBoiss.)[J]. Phytotherapy Research,1999,13(4):329-332.
[5]Lin C M,Kim J,Du W X,et al.Bactericidal activity of isothiocyanate against pathogens on fresh produce[J].Journal of Food Protection,2000,63:25-30.
[6]Siemens D H,Mitchell-Olds T.Glucosinolates and herbivory by specialists (Coleoptera:Chrysomelidae,Lepidoptera:Plutellidae):consequences of concentration and induced resistance[J].Environ.Entomol,1996,25(16):1 344-1 353.
[7]Tawfiq N,Heaney R K,Plumb J,et al.Dietary glucosinolates as blocking agents against carecinogenesis:glucosinolate breakdown products assessed by induction of quinine reductase activity in murine Hepa-1c1c7 cells[J].Carcinogenesis,1995,16(5):1 191-1 194.
[8]Zhang Y,Kensler T W,Chao C G,et al.Anticarcinogenic activities of sulforaphane and structurally related synthetic norbornyl isothiocyanates[J].Proc Natl Acad Sci USA.,1994,91:3 147-3 150.
[9]Bradfield C A,Bjeldanes L F.Effect of dietary indole-3-carbinol on intestinal and hepatic monooxygenase,glutathione S-transferase and epoxide hydrolase activities in the rat[J].Food Chem Toxicol,1984,22(12):977-982.
[10]Guo Z,Smith T,Wang E,et al.Effects of phenethyl isothiocya-nate,a carcinogenesis inhibitor,on xenobiotic-metabolizing enzymes and nitrosamine metabolism in rats[J].Carcinogenesis,1992,13(12):2 205-2 210.
[11]季宇彬,池文杰,邹翔,等.西兰花中异硫氰酸盐诱导人肝癌细胞HepG-2凋亡作用及其机制的研究[J].中国中药杂志,2007,32(7):612-615.
[12]邹翔,郎朗,武晓丹,等.西兰花中葡萄糖异硫氰酸盐诱导人胃腺癌SGC—7901细胞凋亡的初步研究[J].中草药,2007,38(2):228-231.
[13]邹翔,季宇彬,武晓丹,等.西兰花中葡萄糖异硫氰酸盐对S180小鼠抗氧化功能的影响[J].中国天然药物,2007,5(2):134-136.
[14]Zhang Y,T alalay P,Cho C G,et al.A major inducer of anticarcinogenic protective enzymes from broccoli:isolation and elucidation of structure[J].Proc Natl Acad Sci,1994,89(16):2 399-2 403.
[15]Fahey J W,Talalay P.Antioxidant functions of sulforaphane a potent inducer of phase II detoxication enzymes[J].Food and Chemical Toxicology,1999,37:973-979.
[16]Vallejo F,Barberan F A T,Viguera C G.Potential bioactive compounds in health promotion from broccoli cultivars grown in Spain[J].Journal of the Science of Food and A-griculture,2002,82(11):1 293-1 297.
[17]Famham M W,Stephenson K K,Fahey J W.Capacity of broccoli to induce a mamammalian chemoprotective enzyme varies among inbred lines[J].Journal of the Americian Society for Horticultural Science,2000,125(4): 482-488.
[18]Fahey J W,Zhang Y,Talalay P.Broccoli sprouts:an exceptionally rich source of inducers of enzymes that protect against chemical carcinogens[J].Proc Natl Acad Sci U S A,1997,94(19):10 367-10 372.

