二甲双胍对人食管癌KYSE450细胞系增殖和凋亡的影响*
王 涛,王 峰,何 炜,单争争,樊青霞
郑州大学第一附属医院肿瘤科 郑州450052
食管癌是世界上常见的恶性肿瘤之一,在我国发病率和病死率均位居第1 位,发病世标率位于第6 位,死亡世标率位于第12 位[1]。早期食管癌症状轻微,当出现临床表现而就医时,大部分已处于中晚期,失去了手术治疗的机会,而化疗则成为治疗中晚期食管癌的重要手段之一;但目前所用的化疗药物不良反应较大,患者耐受性差,且容易产生抗药性[2-3]。研究[4-6]显示,二甲双胍能抑制结肠癌、乳癌、肝癌以及神经胶质瘤等多种肿瘤细胞的生长。Kobayashi 等[7]的研究显示,二甲双胍可以抑制TT、KYSE30 及KYSE70 3种食管癌细胞系细胞的增殖。有研究报道:mTOR 通路下游靶蛋白4EBP1 和S6K1在肿瘤的细胞周期、增殖、血管生成及凋亡调控中发挥巨大的作用[8],4EBP1 高表达是子宫内膜癌的不良预后因素[9],S6K1 低表达对食管癌细胞有抑制作用[10]。作者用不同浓度二甲双胍作用于食管癌KYSE450 细胞系,观察其对食管癌细胞增殖的抑制作用,探讨其可能的作用机制。
1 材料与方法
1.1 主要试剂 人食管癌KYSE450 细胞系为中国医学科学院肿瘤医院赠送,胎牛血清购自杭州四季青生物工程有限公司,RPMI 1640 培养基购自Gibco公司,二甲双胍购自Sigma 公司,MTT 和Annexin VFITC/PI 凋亡检测试剂盒购自南京凯基生物科技发展有限公司,4EBP1 和S6K1 引物由上海生工生物工程技术服务有限公司设计和合成,鼠抗人4EBP1和S6K1 单克隆抗体购自CST 公司,辣根过氧化物酶标记的二抗购自Abcam 有限公司。
1.2 细胞培养 KYSE450 细胞在37℃、体积分数5%CO2条件下培养于含体积分数10%胎牛血清、100 U/mL 青霉素和100 mg/L 链霉素的RPMI 1640培养液中。
1.3 不同浓度二甲双胍对KYSE450 细胞增殖的影响 取对数生长期的KYSE450 细胞,胰蛋白酶消化处理后按5 000个/孔接种于96 孔板中培养过夜,24 h 后分为空白对照组和不同浓度二甲双胍用药组(终浓度分别为5、10、20 和40 mmol/L 的二甲双胍),每组设5个复孔,继续培养24、48 和72 h后,各孔分别加入5 g/L 的MTT 20 μL,37℃孵育4 h 后弃上清,加入DMSO 150 μL,室温振荡摇匀,于酶标仪490 nm 波长处测定吸光度(A)值,计算药物对细胞的增殖抑制率。增殖抑制率=(A空白对照组-A实验组)/A实验组×100%。
1.4 不同浓度二甲双胍对KYSE450 细胞凋亡的影响 取对数生长期的KYSE450 细胞,胰蛋白酶消化处理后,1.5 ×105个/孔接种于6 孔板中,贴壁后无血清培养24 h,用含不同浓度[0(对照)、5、10 和20 mmol/L]二甲双胍的培养液作用48 h 后,按Annexin V-FITC/PI 凋亡检测试剂盒说明书进行操作,收集细胞,流式细胞仪检测细胞凋亡率。
1.5 KYSE450 细胞中4EBP1 和S6K1 mRNA 表达的RT-PCR 检测 取对数生长期的KYSE450 细胞,按3 ×105个/孔接种于6 孔板中,贴壁后无血清培养24 h。①用含不同浓度[0(对照)、5、10 和20 mmol/L]二甲双胍的培养液作用48 h 后,收集细胞。②用含20 mmol/L 二甲双胍的培养液培养0(对照)、24、48 或72 h 后,收集细胞。Trizol 法提取细胞总RNA,用紫外分光光度法检测总RNA 的纯度及浓度。按逆转录反应试剂盒说明书进行逆转录获得cDNA,以cDNA 为模板进行PCR。PCR 反应体系:cDNA 模板1 μL,Taq PCR Master Mix 25 μL,上、下游引物(10 μmol/L)各2 μL,用无RNA 酶水补足反应体系50 μL。4EBP1 上游引物序列5'-AAGCACCAGCCATCGTGT-3',下游引物序列5'-CTTTCCCAAGCACATCAACC-3',扩增产物大小为371 bp;S6K1 上游引物序列5'-ATTTGCCTCCCTAC CTCACAC-3',下游引物序列5'-AACCCAGAAAGAC CTGATTGG-3',扩增产物大小为300 bp;GAPDH 上游引物序列5'-TGATTCCACCCATGGCAAATTCC-3',下游引物序列5'-ACAGCCTTGGCAGCGCCAGTAGA-3',扩增产物大小为504 bp。PCR 反应条件:94℃预变性5 min;94℃变性30 s,56/54℃(4EBP1/S6K1)退火30 s,72℃延伸30 s,30个循环;最后72℃延伸5 min。取5 μL PCR 反应产物进行20 g/L琼脂糖凝胶电泳,在紫外线投射仪下观察电泳条带,用D-140 图像记录分析系统进行分析,结果取目的基因条带和GAPDH 条带灰度值的比值。实验均设3个复孔。
1.6 KYSE450 细胞中4EBP1 和S6K1 蛋白表达的Western blot 检测 细胞培养及分组同1.5。按照蛋白提取试剂盒提取细胞总蛋白,并进行BCA 蛋白定量及SDS-PAGE 凝胶电泳,半干法转膜,加一抗(按1∶1 000 稀释)室温下孵育2 h 后,TBST 洗膜,加入二抗(按1∶2 000 稀释),孵育后ECL 显色。用Quantity One 定量分析软件分析结果,目的蛋白相对表达量=目的条带灰度值/GAPDH 条带灰度值。实验均设3个复孔。
1.7 统计学处理 采用SPSS 17.0 进行分析,应用4 ×3 析因设计的方差分析比较不同浓度二甲双胍培养不同时间对KYSE450 细胞的增殖抑制率,应用单因素方差分析比较不同浓度二甲双胍对KYSE450 细胞中4EBP1、S6K1 mRNA 和蛋白表达的影响以及20 mmol/L 二甲双胍作用不同时间对KYSE450 细胞中4EBP1、S6K1 mRNA 和蛋白表达的影响,两两比较用LSD-t 检验,检验水准α=0.05。
2 结果
2.1 不同浓度二甲双胍对KYSE450 细胞增殖的抑制作用 见表1。MTT 法检测结果显示,不同浓度二甲双胍对食管癌KYSE450 细胞的增殖均有抑制作用,并且随着药物浓度的增加和作用时间的延长,抑制作用逐渐增强。

表1 不同浓度二甲双胍对KYSE450 细胞的增殖抑制率(n=5) %
2.2 不同浓度二甲双胍对KYSE450 细胞凋亡的影响 5、10 和20 mmol/L 的二甲双胍作用于KYSE450 细胞48 h 后,细胞凋亡率分别为(20.8 ±1.4)%、(30.1 ±1.6)%和(39.7 ±1.4)%,而对照组细胞凋亡率为(5.8 ±1.9)% 。结果表明,随着二甲双胍浓度的增加,KYSE450 细胞的凋亡率也逐渐上升,差异有统计学意义(F=282.076,P<0.001)。
2.3 不同浓度二甲双胍对KYSE450 细胞4EBP1、S6K1 mRNA 和蛋白表达的影响 见图1、2 和表2。结果显示,与对照组比较,不同浓度二甲双胍作用后4EBP1、S6K1 mRNA 及蛋白的表达水平明显下降,并且与二甲双胍的药物浓度相关。
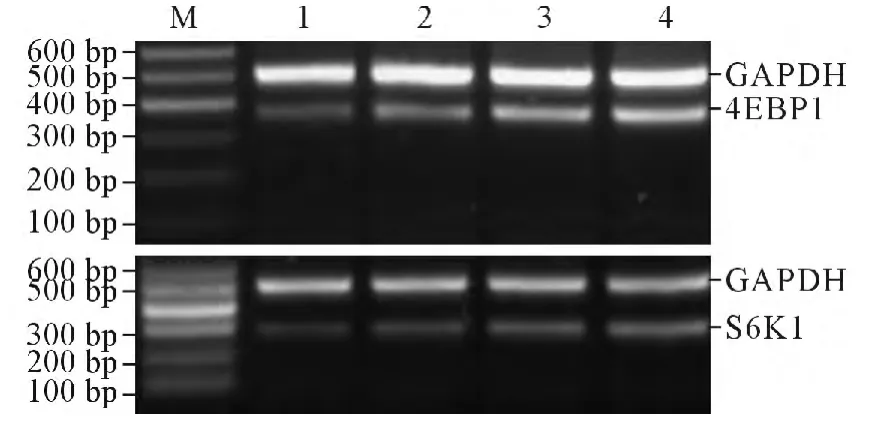
图1 不同浓度二甲双胍对KYSE450 细胞4EBP1、S6K1 mRNA 表达的影响

图2 不同浓度二甲双胍对KYSE450 细胞4EBP1、S6K1 蛋白表达的影响
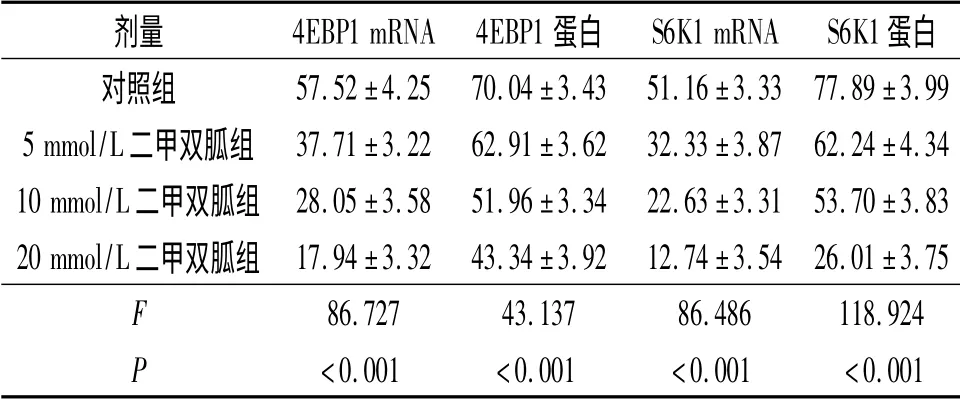
表2 不同浓度二甲双胍对KYSE450 细胞4EBP1、S6K1 mRNA 和蛋白表达的影响(n=3)
2.4 20 mmol/L 二甲双胍处理不同时间对KYSE450 细胞4EBP1、S6K1 mRNA 和蛋白表达的影响 见图3、4 和表3。结果显示,20 mmol/L 的二甲双胍培养KYSE450 细胞24、48 或72 h 后4EBP1、S6K1 mRNA 和蛋白表达水平逐渐下降,且呈时间依赖性。

图3 20 mmol/L 二甲双胍处理不同时间对KYSE450 细胞4EBP1、S6K1 mRNA 表达的影响

图4 20 mmol/L 二甲双胍处理不同时间对KYSE450 细胞4EBP1、S6K1 蛋白表达的影响

表3 20 mmol/L 二甲双胍处理不同时间对KYSE450 细胞4EBP1、S6K1 mRNA 和蛋白表达的影响
3 讨论
目前二甲双胍在临床上仍是广泛使用的治疗糖尿病的基础药物。在多个回顾性研究[11-13]中发现,服用二甲双胍的糖尿病患者其肿瘤患病率和病死率都较未服用二甲双胍的糖尿病患者低。越来越多的实验证明二甲双胍不仅对肿瘤细胞的周期有抑制作用[14],并且可以抑制肿瘤细胞的代谢,且对肿瘤细胞线粒体复合物也有抑制作用[15]。mTOR 信号通路在恶性肿瘤的进展过程中存在着过度激活现象[16],4EBP1 和S6K1 是mTOR 信号传导通路中的2个重要下游底物[17]。研 究[18]证 实mTOR 是AMPK 主要的下游靶点之一,而二甲双胍正是AMPK 的激活剂。
真核翻译起始因子(eIF4E)结合蛋白(4EBP)属于eIF4E 依赖性翻译的负调控因子家族,eIF4E与5'帽结构及其他2个蛋白(解旋酶eIF4A 和折叠蛋白eIF4G)结合成一个复合物——eIF4F[19-20],促进帽依赖蛋白翻译起始,诱导增加了具有5'端非翻译终端区域调控元件的下游靶基因mRNA 的翻译,这些基因都是细胞从G1进入S 期所必需的[21]。研究[22-24]发现4EBP1 在结肠癌、卵巢癌、乳癌和前列腺癌中高表达,且4EBP1 蛋白高表达与乳癌和前列腺癌的不良预后有关。该研究结果显示,随着二甲双胍浓度的加大,食管癌KYSE450 细胞的增殖抑制率增加,凋亡率增加,可能与通过mTOR 信号通路使4EBP1 mRNA 和蛋白水平表达下降有关。
S6K1 也是mTOR 通路下游的重要底物之一,S6K1 是核糖体40S 小亚基S6 蛋白激酶,mTOR 可以使真核生物核糖体40S 亚单位上的S6 蛋白磷酸化而活化,从而增强含有5-TOP mRNA 的翻译,此种mRNA 的翻译产物包括胰岛素生长因子-2、核糖体蛋白、延伸因子等[25];不仅如此,这些产物蛋白还包括HIF-1α,并参与调节Rb 蛋白、cyclinD1、cdk1/2、cdk 抑制剂(如p21Cip1 和p27Kip1)、RNA 聚合酶等[26],这些蛋白都是细胞从G1过渡至S 期需要的[27]。有研究[28]发现,激活LKB1/AMPK/mTOR通路,下调mTOR/S6K1 活性,可促进非小细胞肺癌细胞的凋亡。该研究结果显示,二甲双胍作用后KYSE450 细胞S6K1 mRNA 和蛋白的表达明显降低,同时细胞增殖能力减弱,凋亡率增加。
综上所述,二甲双胍作为一种不良反应轻微、耐受性良好的药物,其抗肿瘤作用的途径是多方面的,作用通路是多样的,这为研究新的肿瘤治疗策略以及临床应用提供了更多的思路。
[1]张思维,张敏,李光琳,等.2003~2007年中国食管癌发病与死亡分析[J].中国肿瘤,2012,21(4):241
[2]赫捷,邵康.中国食管癌流行病学现状、诊疗现状及未来对策[J].中国癌症杂志,2011,21(7):501
[3]时粒笠,钟德胜,古春萍,等.塞来昔布拮抗卡铂在食管癌细胞的细胞毒作用[J].南方医科大学学报,2014,34(6):792
[4]Du Y,Zheng H,Wang J,et al.Metformin inhibits histone H2B monoubiquitination and downstream gene transcription in human breast cancer cells[J].Oncol Lett,2014,8(2):809
[5]Zaafar DK,Zaitone SA,Moustafa YM.Role of metformin in suppressing 1,2-dimethylhydrazine-induced colon cancer in diabetic and non-diabetic mice:effect on tumor angiogenesis and cell proliferation[J].PLoS One,2014,9(6):e100562
[6]Miyoshi H,Kato K,Iwama H,et al.Effect of the anti-diabetic drug metformin in hepatocellular carcinoma in vitro and in vivo[J].Int J Oncol,2014,45(1):322
[7]Kobayashi M,Kato K,Iwama H,et al.Antitumor effect of metformin in esophageal cancer:in vitro study[J].Int J Oncol,2013,42(2):517
[8]Zarogoulidis P,Lampaki S,Turner JF,et al.mTOR pathway:a current,up-to-date mini-review (review)[J].Oncol Lett,2014,8(6):2367
[9]张菊新,李丹丹,邹玲.子宫内膜腺癌组织中p-mTOR 和p-4EBP1 蛋白的表达[J].郑州大学学报:医学版,2010,45(1):168
[10]鲁照明,杨帅,周媛媛,等.雷帕霉素对p70S6K-siRNA转染的EC9706 细胞增殖的影响[J].郑州大学学报:医学版,2013,48(6):717
[11]Lee MS,Hsu CC,Wahlqvist ML,et al.Type 2 diabetes increases and metformin reduces total,colorectal,liver and pancreatic cancer incidences in Taiwanese:a representative population prospective cohort study of 800,000 individuals[J].BMC Cancer,2011,11:20
[12]Noto H,Goto A,Tsujimoto T,et al.Cancer risk in diabetic patients treated with metformin:a systematic review and meta-analysis[J].PLoS One,2012,7(3):e33411
[13]Skinner HD,Mccurdy MR,Echeverria AE,et al.Metformin use and improved response to therapy in esophageal adenocarcinoma[J].Acta Oncol,2013,52(5):1002
[14]Zhao L,Wen ZH,Jia CH,et al.Metformin induces G1 cell cycle arrest and inhibits cell proliferation in nasopharyngeal carcinoma cells[J].Anat Rec(Hoboken),2011,294(8):1337
[15]Gallagher EJ,Leroith D.Diabetes,cancer,and metformin:connections of metabolism and cell proliferation[J].Ann N Y Acad Sci,2011,1243:54
[16]Ji J,Zheng PS.Activation of mTOR signaling pathway contributes to survival of cervical cancer cells[J].Gynecol Oncol,2010,117(1):103
[17]Hay N,Sonenberg N.Upstream and downstream of mTOR[J].Genes Dev,2004,18(16):1926
[18]Faubert B,Vincent EE,Griss T,et al.Loss of the tumor suppressor LKB1 promotes metabolic reprogramming of cancer cells via HIF-1α[J].Proc Natl Acad Sci U S A,2014,111(7):2554
[19]Zhao Y,Pang TY,Wang Y,et al.LMP1 stimulates the transcription of eIF4E to promote the proliferation,migration and invasion of human nasopharyngeal carcinoma[J].FEBS J,2014,281(13):3004
[20]Cope CL,Gilley R,Balmanno K,et al.Adaptation to mTOR kinase inhibitors by amplification of eIF4E to maintain capdependent translation[J].J Cell Sci,2014,127(Pt 4):788
[21]Faivre S,Kroemer G,Raymond E.Current development of mTOR inhibitors as anticancer agents[J].Nat Rev Drug Discov,2006,5(8):671
[22]Armengol G,Rojo F,Castellví J,et al.4E-binding protein 1:a key molecular "funnel factor" in human cancer with clinical implications[J].Cancer Res,2007,67(16):7551
[23]Coleman LJ,Peter MB,Teall TJ,et al.Combined analysis of eIF4E and 4E-binding protein expression predicts breast cancer survival and estimates eIF4E activity[J].Br J Cancer,2009,100(9):1393
[24]No JH,Jeon YT,Park IA,et al.Activation of mTOR signaling pathway associated with adverse prognostic factors of epithelial ovarian cancer[J].Gynecol Oncol,2011,121(1):8
[25]Morita M,Ler LW,Fabian MR,et al.A novel 4EHP-GIGYF2 translational repressor complex is essential for mammalian development[J].Mol Cell Biol,2012,32(17):3585
[26]Mccubrey JA,Steelman LS,Kempf CR,et al.Therapeutic resistance resulting from mutations in Raf/MEK/ERK and PI3K/PTEN/Akt/mTOR signaling pathways[J].J Cell Physiol,2011,226(11):2762
[27]Zhou HY,Huang SL.Current development of the second generation of mTOR inhibitors as anticancer agents[J].Chin J Cancer,2012,31(1):8
[28]Jin HO,Hong SE,Woo SH,et al.Silencing of Twist1 sensitizes NSCLC cells to cisplatin via AMPK-activated mTOR inhibition[J].Cell Death Dis,2012,3:e319