重症监护病房鲍曼不动杆菌耐药性与分子流行病学研究
李永丽,陈艺升,汪雅萍,应春妹
鲍曼不动杆菌是广泛存在于自然界、医院环境和人体皮肤的一类条件致病菌。近年来,随着广谱抗菌药物的大量使用及各种侵袭性诊疗技术的应用,该菌分离率逐年增加,且诱导大量耐药菌株产生,已成为仅次于铜绿假单胞菌的另一个重要不发酵糖革兰阴性杆菌,重症监护病房(ICU)是最容易定植、感染的科室之一[1]。此外,医院环境污染在鲍曼不动杆菌播散流行中亦占很重要位置,对医院环境采样并对分离菌株进行同源性分析,能够评估环境污染情况,快速准确地查找传染源和传播途径[2]。本研究目的为探讨神经外科ICU 中分离鲍曼不动杆菌的耐药特征,并分析其流行特征和可能的感染途径,为治疗和预防鲍曼不动杆菌医院感染提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源 收集2012年7—10月上海交通大学医学院附属仁济医院神经外科ICU 鲍曼不动杆菌临床分离株27株,剔除重复菌株。标本种类包括痰液、咽拭子、尿液、引流液。同期采用无菌棉拭子对ICU 医护人员手,患者病床、桌面,呼吸机表面,房间门把手等部位进行环境污染调查采样共214份,分离鲍曼不动杆菌28 株,其中包括分离于患者桌面17株,病床7株,呼吸机表面3株,门把手1株。所有菌株经VITEK-2 Compact全自动微生物分析系统鉴定,并通过16SrRNA 测序证实。质控菌株为大肠埃希菌ATCC25922,铜绿假单胞菌ATCC27853。
1.1.2 主要试剂 阿米卡星、环丙沙星、庆大霉素、头孢他啶、头孢噻肟、头孢吡肟、米诺环素、甲氧苄啶-磺胺甲口恶唑、美罗培南、哌拉西林、他唑巴坦、舒巴坦、亚胺培南等抗菌药物(上海科佳药检器材公司),黏菌素和替加环素(上海雅鉴生物科技有限公司);dNTP、Taq DNA 酶和蛋白酶K(大连TaKaRa公 司);ApaI 限制性 内切酶(Fermentas 公 司);pulsed field certified agarose(美国Bio-Rad公司);Tris、EDTA 等生化试剂(上海生工生物工程公司)。
1.1.3 主要仪器 全自动微生物分析系统(型号:VITEK-2 Compact,法国生物梅里埃公司);聚合酶链反应(PCR)扩增仪(型号为:ABI 2700,美国生物公司);琼脂糖凝胶电泳仪(上海天能科技有限公司)、凝胶成像仪(上海天能科技有限公司)。脉冲场凝胶电泳仪(型号:CHEFMapperTM,美国Bio-Rad公司)。
1.2 方法
1.2.1 细菌体外药敏试验 琼脂稀释法检测55株鲍曼不动杆菌对16 种抗菌药物的最低抑菌浓度(MIC),结果判定参照2011年美国临床和实验室标准化协会(CLSI)公布的标准[3]。
1.2.2 多位点序列分型(MLST)引物参照鲍曼不动杆菌的MIST 数据库(http://pubmlst.org/abaumannii/),针对gltA,gyrB,gdhB,recA,cpn60,gpi和rpoD7个管家基因进行测序比对分析。PCR总反应体系为25μL,其中10×缓冲液(含MgCl2)2.5μL,dNTPs(各2.5 mmol/L)混悬液2μL,DNA模板1μL,引物(10μmol/L)1μL,Taq 酶0.125μL,使用双蒸馏水补足于25μL。反应条件:94℃预变性5 min,然后94℃变性30 s,54℃复性30 s,72℃延伸1 min,共30个循环,最后72℃延伸7 min。扩增产物在含0.25 mg/L的溴化乙锭(EB)的1.5%琼脂糖凝胶中电泳30 min,PCR产物经纯化后由上海生工生物工程技术公司进行双向测序。
1.2.3 脉冲场凝胶电泳(PFGE)分型 将已培养过夜的纯菌落,配成细菌悬浮液,采用琼脂糖凝胶进行包被,在含有25μL蛋白酶K 的细胞裂解液中54℃水浴摇床4 h。充分洗涤,用限制性内切酶ApaI 37℃酶切3 h。用0.5×TBE 缓冲液配制1%琼脂糖凝胶加热溶解后冷却至60℃,缓缓注入模具中,放置30 min。电泳条件设置:核酸片段30~600 kb,6 V/cm,脉冲时间5~20 s,14℃,电场角度120°,电泳时间为19 h。电泳结束后用0.25 mg/L 的EB 染色45 min,蒸馏水冲洗30 min后观察结果。PFGE 结果判读按Tenover等[4]推荐的方法判读,酶切后图谱完全一致定为同一型,有1~3条带不同者为同一型的不同亚型,差异3个条带以上者为另一型。
1.2.4 统计学处理 药敏结果采用世界卫生组织(WHO)提供的微生物统计软件WHONET5.4进行统计分析。组内比较采用SAS(9.0版)统计软件卡方检验进行数据分析,P<0.05为差异有统计学意义。
2 结果
2.1 药敏结果
临床分离27株鲍曼不动杆菌除对黏菌素和替加环素全部敏感外,对其余14 种抗菌药物耐药率高。其中,对米诺环素耐药率稍低,其次为头孢哌酮-舒巴坦和亚胺培南,对其他抗菌药物的耐药率均超过70%,对甲氧苄啶-磺胺甲口恶唑全部耐药。环境分离28株鲍曼不动杆菌对抗菌药物较敏感,见表1。
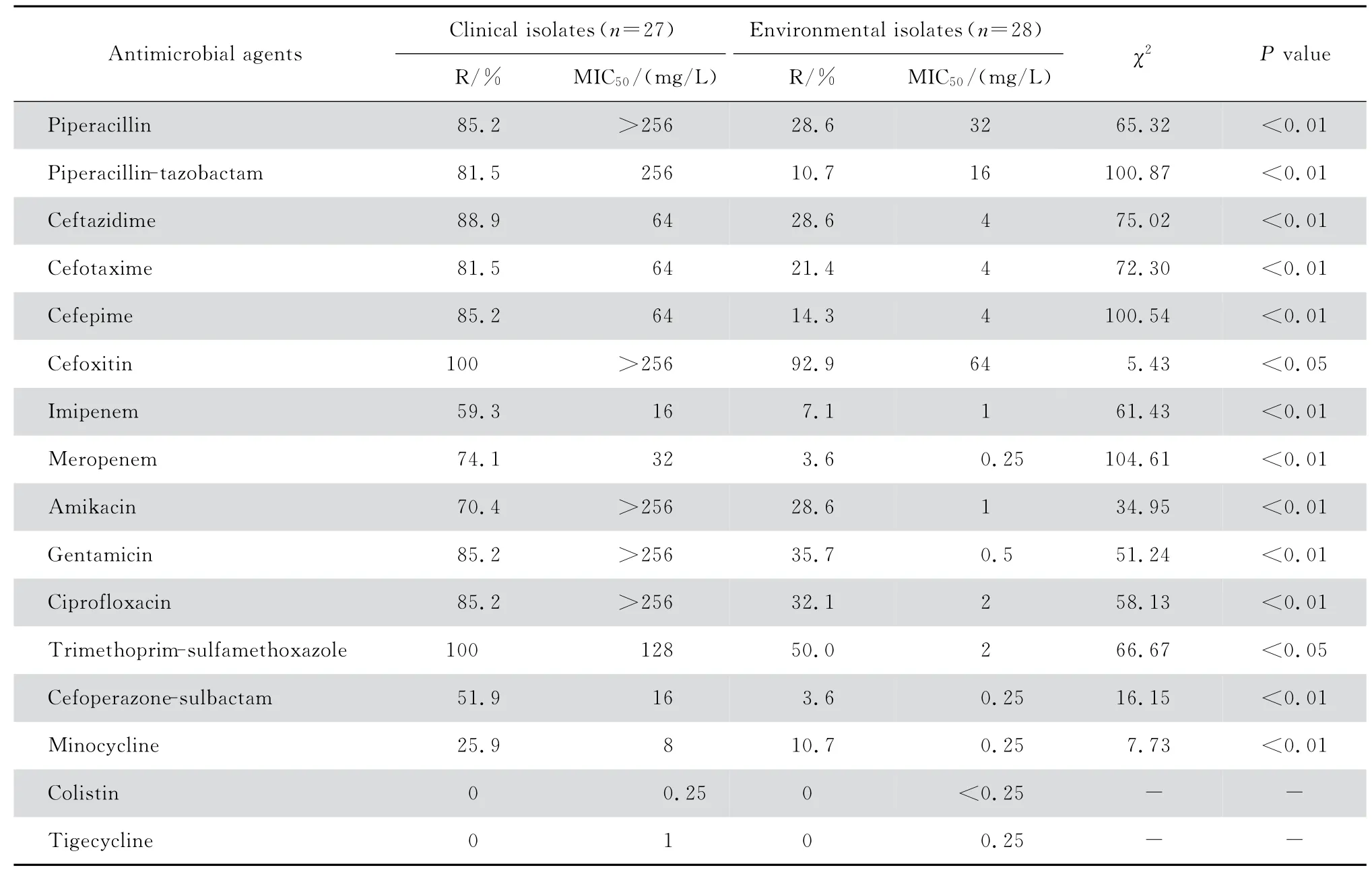
表1 55株鲍曼不动杆菌药敏结果分析Table 1 Susceptibility testing results of 55 strains of Acinetobacter baumannii
2.2 MLST 基因分型结果
27株临床分离鲍曼不动杆菌主要可分为5 个ST 型(ST208,1-3-3-2-2-97-3;ST368,1-3-3-2-2-140-3;ST191,1-3-3-2-2-94-3;ST195,1-3-3-2-2-96-3;ST540,1-3-3-2-2-160-3)与4个新ST 型。其中ST208是在神经外科ICU 中分布最为广泛的基因型,占到了菌株数的66.7%(18/27),其次是ST 540型有2 株,ST368、ST191、ST195 基因型 各1株。根据PubMLST 数据库中已有的鲍曼不动杆菌序列型进行eBRUST 分析,发现ST208、ST368、ST191、ST195和ST540只有gpI等位基因位点不同,均属于克隆复合体92(CC92)[5],占所有临床菌株的85.2%(24/27)。环境菌株中 有2 个ST 型(ST208 和ST229),其 中ST208 9 株,ST229 4 株,53.6%(15/28)的菌株至少有1个等位基因序列在数据库中没有对应的基因序列,是新的ST型。
2.3 PFGE基因分型结果
27株临床分离鲍曼不动杆菌PFGE 基因分型可分为5型,其中A 型23株(包括A1型15株,A2型7株,A3型1株),B型1株,D 型2株,E型1株。28株ICU 环境分离鲍曼不动杆菌主要分为9型,其中A 型15株(包括A1型7株,A2型2株,A3型6株),B型2株,C型1株,D 型2株,E型3株,F型2株,G、H、I型各1株(图1、2)。临床菌株与环境菌株不同基因分型结果比较见表2。
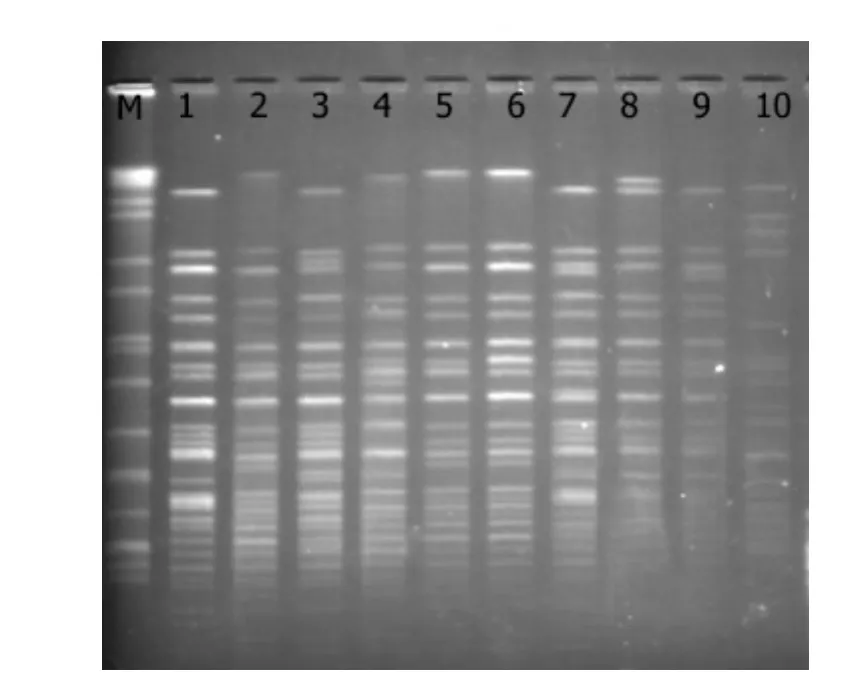
图1 部分临床菌株PFGE图谱Figure 1 Pulsotypes identified by pulsed-field gel electrophoresis from clinical isolates of Acinetobacter baumannii
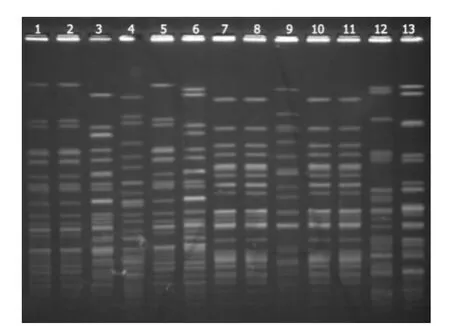
图2 部分环境菌株PFGE图谱Figure 2 Pulsotypes identified by pulsed-field gel electrophoresis from enviromental isolates of Acinetobacter baumannii
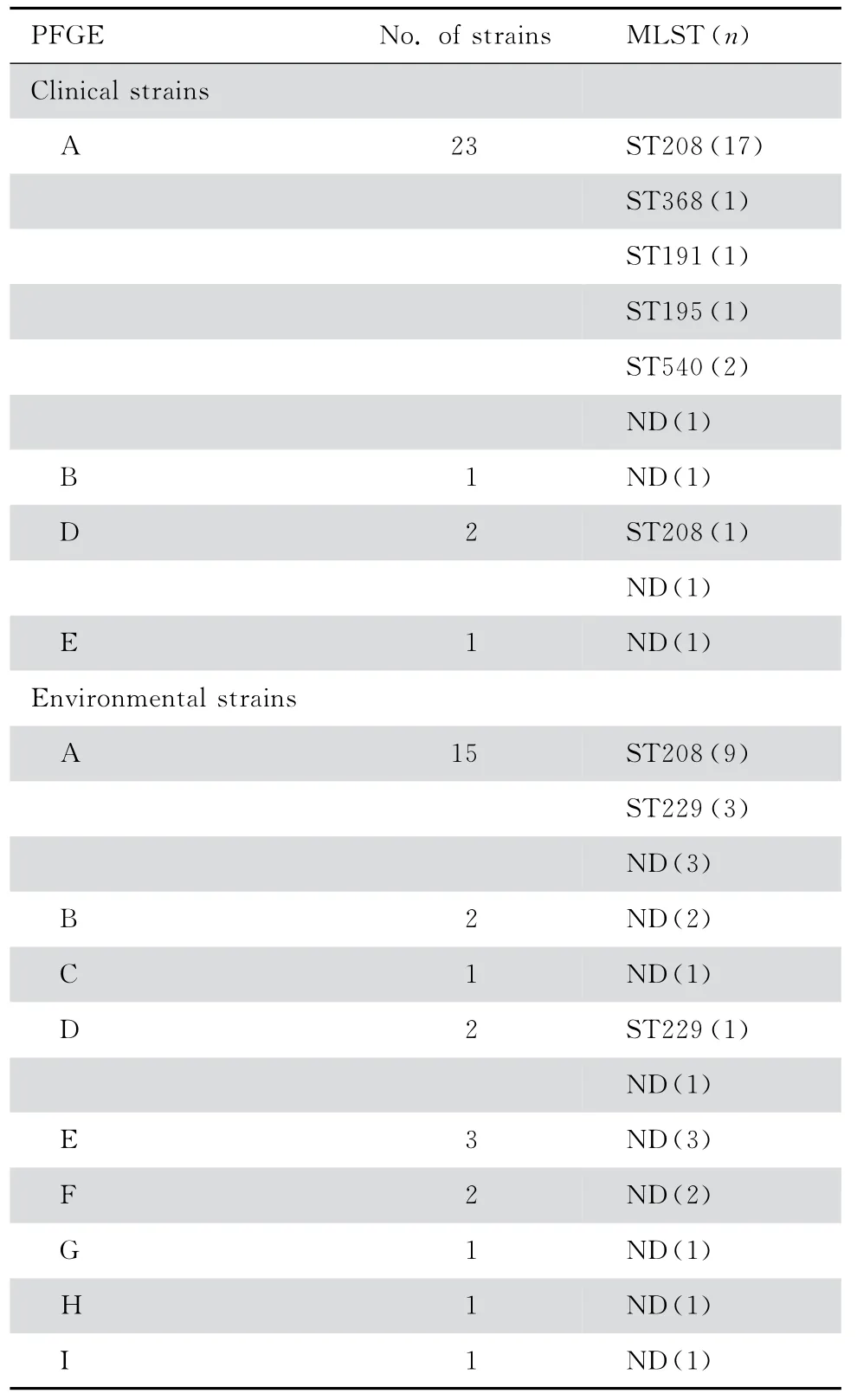
表2 临床菌株和环境菌株不同方法基因分型结果Table 2 Molecular typing results of clinical and environmental isolates of Acinetobacter baumannii
3 讨论
鲍曼不动杆菌为不发酵糖革兰阴性杆菌,系条件致病菌,生存能力强,定植率高,可在医院环境中长期生存,极易造成暴发流行[6]。鲍曼不动杆菌临床分离率逐渐增高,已成为医院感染的重要病原菌之一。ICU 患者往往患有多种基础疾病,免疫力低下,加上临床各种侵袭性操作等危险因素,更易于鲍曼不动杆菌定植感染。有研究显示,ICU 中该菌的感染暴发与其环境传播密切相关[7]。因此,对ICU环境中鲍曼不动杆菌进行分子流行病学监测,对于控制医院感染暴发,及时准确查找传染源和传播途径具有重要意义。
随着抗菌药物的大量应用,抗菌药物选择性压力导致鲍曼不动杆菌耐药株逐年递增。本研究临床分离鲍曼不动杆菌除对黏菌素和替加环素敏感外,对常用抗菌药物耐药率高,对氨基糖苷类,第三、四代头孢菌素耐药率高达80%以上,对头孢哌酮-舒巴坦和亚胺培南的耐药率分别为51.9%、59.3%,对米诺环素的耐药率为25.9%。环境分离28株鲍曼不动杆菌对头孢哌酮-舒巴坦、亚胺培南和美罗培南的耐药率分别为3.6%、7.1%、3.6%,对米诺环素、哌拉西林-他唑巴坦耐药率均为10.7%,对其他抗菌药物耐药率也在20%~50%。
细菌播散分布具有时间和地区间的差异,对一定时间内同一病区分离的鲍曼不动杆菌进行基因分型,分析其同源性关系,对医院感染预防与控制具有重要意义[8]。目前对病原菌同源性分析方法有PCR 指纹图谱分型、核糖体分型、PFGE 分型及MLST 分型等[9]。
本实验采用MLST 技术对临床和环境分离鲍曼不动杆菌进行型别分析。研究结果显示,27株临床分离菌株中ST208型18株(66.7%),是我院神经外科ICU 病区的主要流行型别,其次是ST540型2株,ST368、ST191、ST195基因型各1株。另有4株基因型与MLST 数据库中现有基因型不符,是新的基因型别。eBURST 分析显示ST208、ST368、ST191、ST195 和ST540 型均属 于CC92 克隆群。28株环境分离株中,ST208有9株,ST229有4株。综上,神经外科ICU 存在鲍曼不动杆菌感染传播,环境中病床、桌面,呼吸机表面,门把手等部位均有鲍曼不动杆菌污染,且具有相同型别。医院应加强医护人员的消毒意识,对环境中物体表面严格消毒,以防止医院感染暴发流行。
PFGE分型法重复性好、分辨率高、结果稳定、易于标准化,是细菌分子生物学分型技术“金标准”[10],能在细菌基因组庞大的情况下,尽可能反映更多的变异信息[11]。临床分离27株鲍曼不动杆菌可分为A、B、D、E 型,其中A 型23株,占85.2%;而同期收集28株环境分离鲍曼不动杆菌分为9型,A 型15株,占53.6%,A 型为主要克隆株。A 型克隆株的高检出率进一步说明临床分离株与环境分离株有密切相关性。不同基因分型技术结果显示,PFGE分型A 型菌株对应了MLST 的CC92 克隆群,同时环境物体表面也分布有鲍曼不动杆菌,说明此型克隆株存在科室内传播可能性。
综上所述,本研究中鲍曼不动杆菌对临床常用抗菌药物耐药率高,对米诺环素耐药率稍低,其次为头孢哌酮-舒巴坦和亚胺培南,临床应根据药敏结果选择合适抗菌药物。在PFGE 分型中,A 型克隆株为临床菌株和环境菌株的主要流行株,对应了MLST 的CC92克隆群,菌株间具有较高同源性,科室内存在交叉感染的可能性,需采取切实、有效措施及时进行干预。
[1]Pendleton JN,Gorman SP,Gilmore BF.Clinical relevance of the ESKAPE pathogens[J].Expert Rev Anti Infect Ther,2013,11(3):297-308.
[2]Durante-Mangoni E,Zarrilli R.Global spread of drugresistant Acinetobacter baumanii:molecular epidemiology and management of antimicrobial resistance [J].Future Microbiol,2011,6(4):407-422.
[3]Clinical and Laboratory Standards Institute.Performance standards for antimicrobial Susceptibility testing[S].19th informational supplement,2011,M100-S21.
[4]Tenover FC,Arbeit RD,Geering RV,et al.Interpreting chromosomal DNA restriction patterns produced by pulsedfield gel electrophoresis:criteria for bacterial strain typing[J].J Clin Microbiol,1995,33(9):2233-2239.
[5]Fu Y,Zhou J,Zhou H,et al.Wide dissemination of OXA-23-producing carbapenem-resistant Acinetobacter baumannii clonal complex22in multiple cities of China[J].J Antimicrob Chemother,2010,65(4):644-650.
[6]Torres HA,Vazqueez EG,Yague G,et al.Multidrug resistant Acinetobacter baumanii:clinical update and new highlights[J].Rev Esp Quimioter,2010,23(1):12-19.
[7]Thom KA,Johnsn JK,Lee MS,et al.Environmental contamination because of multidrug-resistant Acinetobacter baumanii surrounding colonized or infected patients[J].Am J Infect Control,2011,39(9):711-715.
[8]Karah N,Sundsfjord A,Towner K,et al.Insights into the global molecular epidemiology of carbapenem non-susceptible clones of Acinetobacter baumanii[J].Drug Resist Updat,2012,15(4):237-247.
[9]王璐,任微,褚美玲,等.耐碳青霉烯的多重耐药鲍曼不动杆菌分子流行病学研究[J].现代检验医学杂志,2010,25(1):87-89.
[10]Singh A,Goering RV,Simjee S,et al.Application of molecular techniques to the study of hospital infection[J].Clin Microbiol Rev,2006,19(3):512-530.
[11]Durmaz R,Otlu B,Koksal F,et al.The optimization of a rapid pulsed-field gel electrophoresis protocol for the typing of Acinetobacter baumanii,Escherichia coli and Klebsiellaspp.[J].Jpn J Infect Dis,2009,62(5):372-377.

