过表达HOPX基因对鸡脂肪生长发育重要基因表达的影响
王 宁,史洪岩,程 敏,孙婴宁,李 辉
(农业部鸡遗传育种重点实验室,东北农业大学动物科学技术学院,哈尔滨 150030)
过表达HOPX基因对鸡脂肪生长发育重要基因表达的影响
王 宁,史洪岩,程 敏,孙婴宁,李 辉
(农业部鸡遗传育种重点实验室,东北农业大学动物科学技术学院,哈尔滨 150030)
为揭示HOPX基因在鸡脂肪生长发育中的作用,研究采用Real-time RT-PCR和启动子荧光素酶报告基因技术,分析过表达HOPX基因对鸡脂肪生长发育重要基因的表达及其启动子活性的影响。结果表明,与空载体对照组(pCMV-HA vector)相比,HOPX基因能够促进A-FABP和PPARγ基因表达及其启动子活性,抑制KLF 7基因表达及其启动子活性,但对FAS基因表达及其启动子活性没有影响。研究结果显示,过表达HOPX基因可能促进鸡前脂肪细胞分化。
HOPX基因;鸡;脂肪细胞分化;发育
网络出版时间2015-4-30 14:30:00 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20150430.1430.004.html
王宁,史洪岩,程敏,等.过表达HOPX基因对鸡脂肪生长发育重要基因表达的影响[J].东北农业大学学报,2015,46(5):44-50.
Wang Ning,Shi Hongyan,Cheng Min,et al.Effect ofHOPXoverexpression on expression of the important developmental genes in chicken adipose[J].Journal of Northeast Agricultural University,2015,46(5):44-50.(in Chinese with English abstract)
前脂肪细胞向成熟脂肪细胞分化过程受多种转录因子调控,既有促进脂肪细胞分化的正调控转录因子,也有抑制脂肪细胞分化负调控转录因子,脂肪细胞分化是正、负转录调控因子共同作用的结果。PPARγ(Peroxisome proliferator-activated receptor γ)和C/EBPα(CCAAT/enhancer binding pro⁃teinα)是脂肪细胞分化关键基因,两者相互激活转录并协调作用,促进脂肪细胞分化。随前脂肪细胞向成熟脂肪细胞分化,PPARγ和C/EBPα表达量逐渐升高[1]。KLF 7(Krüppel-like factor 7)是脂肪细胞分化早期表达基因,是脂肪细胞分化负调控因子,能抑制C/EBPα基因启动子活性[2]。脂肪酸合成酶(Fatty acid synthase,FAS)基因和脂肪酸结合蛋白(Adipocyte fatty acid binding protein,A-FABP)基因是脂肪细胞分化晚期表达的基因,其表达量在脂肪细胞分化晚期显著上升[1,3]。
同源异型盒基因(Homeobox genes)家族成员多、分布广,参与脊椎和无脊椎动物器官发育和组织形成[4]。同源异型盒基因主要分为两类,一类是HOX基因,该基因家族成员在染色体上成簇排列;另一类是non-HOX基因,其家族成员分散在不同染色体上[5]。同源异型盒基因家族成员具有HD(Homeodomain)同源结构域,该结构域是同源异型盒基因结合DNA并发挥其功能的主要结构域。HOPX基因(Homeodomain only protein X)属于non-HOX基因家族[6],又被称为HOD、HOP、OB1、LAGY、TOTO、CAMEO、NECC1或SMAP31,是目前已知最小的同源结构域蛋白[7]。HOPX基因编码的蛋白一般含有73个氨基酸残基,其中60个氨基酸残基构成一个非典型的HD同源结构域[7]。研究发现HOPX基因同源结构域中与DNA结合的必要氨基酸发生突变[8],发现HOPX具有特殊蛋白质3D结构[9],导致HOPX不能直接结合DNA双链。HOPX通过与其他蛋白相互作用而发挥其生物学功能,目前已发现HOPX能够与SRF(Serum re⁃sponse factor)[7-9]、Epc1(Enhancer of polycomb 1)[10]和HDAC2(Histone deacetylase 2)相互作用[11-12]。研究结果表明,HOPX基因是哺乳动物心脏正常发育的重要调控因子[7,13-14],也是癌细胞增殖的负调控因子[15-16]。除此之外,HOPX基因也参与骨骼肌细胞分化[10]、免疫应答反应[17]和角质细胞分化[6,18]等。目前,HOPX基因在脂肪生长发育中的研究尚未见报道。
农业部鸡遗传育种重点实验室前期的表达谱芯片和Northern Blot分析发现,鸡HOPX基因在鸡脂肪组织中表达量较高[19],且具有一定脂肪组织表达特异性[20]。此外,HOPX基因在高、低脂系肉鸡腹部脂肪组织间差异表达[20]。因此,推测HOPX基因可能在鸡脂肪生长发育过程中发挥作用。本研究开展过表达HOPX基因对脂肪生长发育重要基因KLF 7、PPARγ、C/EBPα、FAS和A-FABP表达影响分析,研究结果将有助于揭示HOPX基因在鸡脂肪生长发育中作用,为阐明鸡脂肪生长发育分子机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 试验动物
12日龄商业化AA肉仔鸡。
1.1.2 试验试剂
TRIzol®Reagent和LipofectamineTM2000购自In⁃vitrogen(USA);逆转录试剂盒和Dual-Luciferase®Reporter Assay System购自Promega公司(USA);DMEM/F12培养基、Opti-MEM、胎牛血清(FBS)和胶原酶I购自Gibco公司(USA);油酸钠购自Sigma公司(USA);Fast Start Universal SYBR Green Master (ROX)购自Roche公司(Switzerland);RNase free water购自TaKaRa公司(Japan)。
1.1.3 试验载体
pCMV-HA vector购自Clontech公司(USA);pCMV-HA-HOPX真核过表达载体,海肾荧光素酶报告基因载体,鸡FAS启动子荧光素酶报告基因质粒pGL3-basic-FAS(-1086/+170);鸡PPARγ启动子荧光素酶报告基因质粒pGL3-basic-PPARγ (-1985/-89);鸡C/EBPα启动子荧光素酶报告基因质粒pGL3-basic-C/EBPα(-2214/-19);鸡KLF 7启动子荧光素酶报告基因质粒pGL3-basic-KLF 7 (-2270/-70);鸡A-FABP启动子荧光素酶报告基因质粒pGL3-basic-A-FABP(-1983/+35)均由农业部鸡遗传育种重点实验室保存。
1.2 方法
1.2.1 鸡前脂肪细胞原代培养
采用农业部鸡遗传育种重点实验室建立的肉仔鸡腹部脂肪组织前脂肪细胞分离和培养方法[21],体外分离和培养鸡原代前脂肪细胞。具体操作如下:选取12日龄AA肉仔鸡,在无菌条件下采集腹部脂肪组织,放入装有无菌PBS的平皿中,反复冲洗,除去血管和筋膜,剪碎组织,转入含有消化液的试管中,37℃消化65 min,每隔5 min轻轻摇动一次。消化完毕,加入全培养基(DMEM/F12+ 10%FBS+1%K)终止消化,轻轻吹打均匀,分别经100和600目不锈钢筛网过滤。过滤后培养基混合液分装入15 mL离心管中,700 g离心10 min,弃培养液,用红细胞裂解液重悬细胞,室温孵育10 min后轻轻吹匀,将细胞悬液700 g离心10 min,细胞沉淀用全培养基重悬,700 g离心10 min,再用培养基重悬,重悬后的细胞悬液为基质-血管细胞(S-V细胞),即前脂肪细胞。将分离的前脂肪细胞记数后,按(2~3)×105·mL-1密度接种,置5%CO2培养箱中37℃恒温培养,48 h后换液,细胞汇合度达到80%~90%时进行传代。
1.2.2 细胞总RNA提取及反转录PCR
按照TRIzol®Reagent说明书操作步骤提取总RNA,所得总RNA进行OD值测定,OD260/280在1.8~2.0即为RNA合格;反转录参照反转录试剂盒说明书进行操作,反转录后的cDNA在-20℃保存。
1.2.3 前脂肪细胞转染及诱导分化
以12日龄AA肉仔鸡腹部脂肪组织为原材料,体外分离、培养鸡原代前脂肪细胞,待细胞密度达到传代条件后(见1.2.1),将细胞传代接种于6孔细胞培养板中,当细胞密度达到80%~90%汇合度时进行瞬时转染,转染体系和操作步骤按照Lipo⁃fectamineTM2000说明书进行,转染24 h后,根据本实验室前期研究确认的适宜鸡原代前脂肪细胞分化的油酸浓度(160 μmol·L-1),对鸡原代前脂肪细胞进行诱导分化,在诱导0 h(转染24 h)、诱导24 h(转染48 h)、诱导48 h(转染72 h)和诱导72 h(转染96 h)后,利用Trizol法收集细胞。
1.2.4 Real-time RT-PCR检测
以反转录的cDNA为模板,使用Real-time PCR仪(ABI 7500)进行Real-time RT-PCR检测。反应体系为:Fast Start Universal SYBR Green Master (ROX)(2×)5 μL,cDNA模板1 μL,上、下游引物(10 μmol·L-1)各0.2 μL,ddH2O 3.6 μL,总体积为10 μL。反应条件:95℃预变性10 min;95℃变性15 s,60℃复性延伸60 s,共40个循环。以β-ac⁃tin基因为内参,利用2-ΔCt方法将原始Ct值转换为相对基因表达量。所用引物序列见表1。

表1 Real-time PCR引物Table 1 Real-time PCR primers used in this study
1.2.5 启动子荧光素酶报告基因活性检测
以鸡原代前脂肪细胞、鸡胚成纤维细胞系(DF1)和鸡永生化前脂肪细胞系(ICPA-I)为试验材料,将细胞按照(2~3)×105·mL-1密度接种于12孔细胞培养板中,待细胞汇合度达80%~90%时,将0.2 μg报告基因质粒和0.8 μg真核表达载体质粒,共转染鸡原代前脂肪细胞、DF1和ICPA-I,其中报告基因质粒和pCMV-HA-HOPX质粒共转染为试验组,报告基因质粒和pCMV-HA vector质粒共转染为对照组,转染细胞在37℃、5%CO2细胞培养箱中培养48 h后,按照Dual-Luciferase®Reporter Assay System(Promega)试剂盒说明书进行操作,采用化学单管检测仪,分别测定各组海肾(内参)和萤火虫荧光素酶活性。
1.2.6 统计分析
试验数据采用JMP 5.0软件进行t检验分析,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 过表达HOPX基因对脂肪发育相关重要基因表达的影响
为了解HOPX基因在鸡脂肪组织生长发育中的作用,选取与鸡脂肪发育相关的重要基因KLF 7、PPARγ、C/EBPα、FAS和 A-FABP,利用 Re⁃al-time RT-PCR方法,以β-actin为内参,分析在鸡原代前脂肪细胞分化过程中HOPX基因过表达对这5个基因表达的影响。结果显示,与对照组(pC⁃MV-HA vector)相比,HOPX基因过表达可降低KLF 7基因表达量,且在鸡前脂肪细胞诱导分化24 h时,达显著差异(P<0.05,见图1-A),在诱导分化72 h时,达极显著差异(P<0.01,见图1-A);HOPX基因过表达可提高PPARγ、C/EBPα和A-FABP基因表达量,其中,PPARγ基因表达量在鸡前脂肪细胞诱导分化48和72 h时达到显著差异(P<0.05,见图1-B),C/EBPα基因表达量在诱导分化24 h时达显著差异(P<0.05,见图1-C),A-FABP基因的表达量则在诱导分化0 h时达显著差异(P<0.05),诱导分化72 h时,呈现极显著差异(P<0.01,见图1-E);过表达HOPX基因对FAS基因表达无影响(见图1-D)。
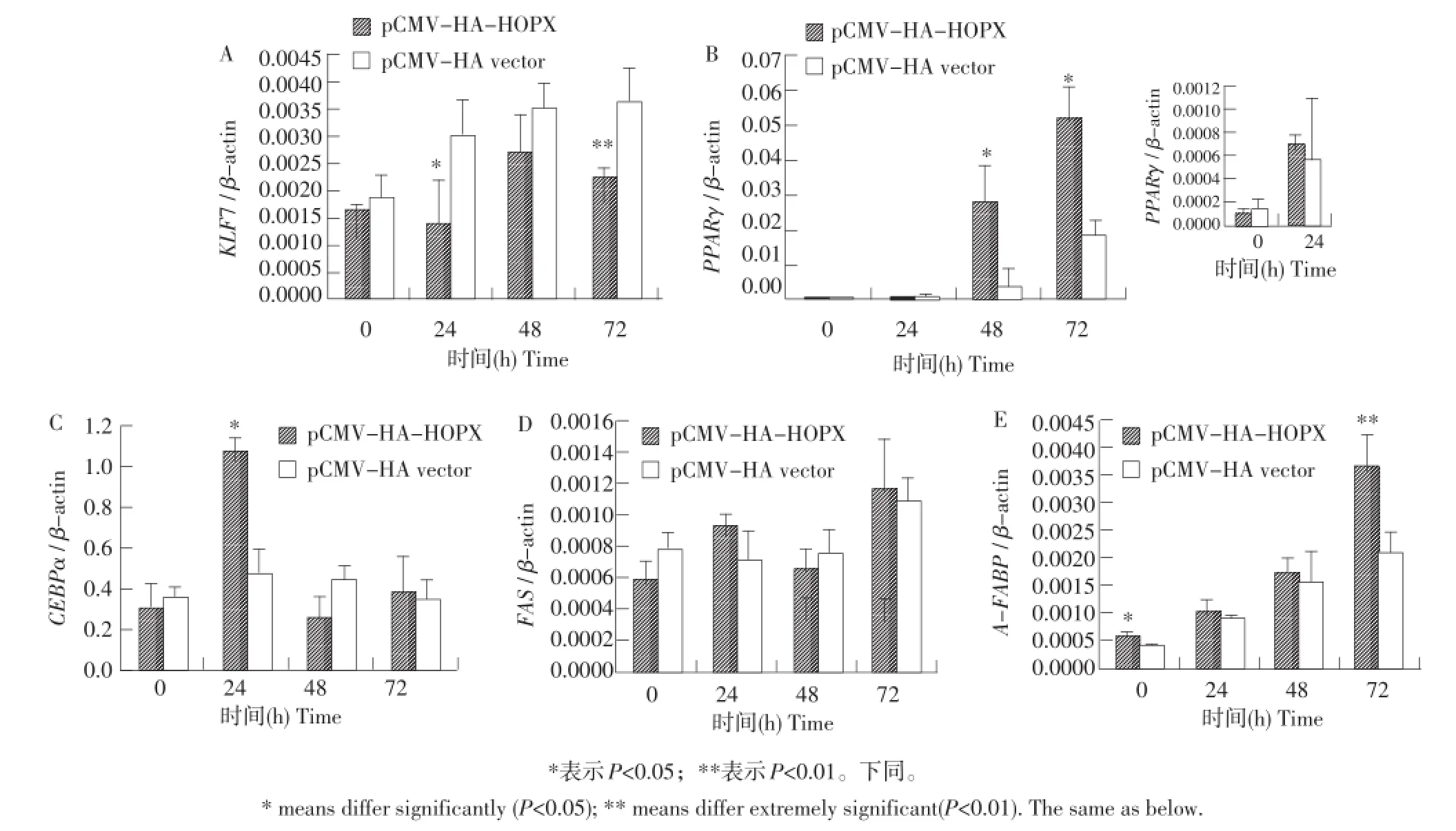
图1 HOPX过表达对前脂肪细胞KLF 7、PPARγ、C/EBPα、FAS和A-FABP基因表达的影响Fig.1 Effects of HOPX overexpression on mRNA expression levels of KLF 7,PPARγ, C/EBPα,FAS and A-FABP during chicken preadipocyte differentiation
2.2 过表达HOPX基因对脂肪细胞分化相关重要基因启动子活性的影响
为进一步了解HOPX基因对脂肪发育重要基因启动子活性的影响,利用荧光素酶双报告基因技术,分析HOPX基因过表达对KLF 7、PPARγ、C/ EBPα、FAS和A-FABP基因启动子活性的影响。结果显示,与对照组(pCMV-HA vector)相比,在鸡原代前脂肪细胞中,过表达HOPX基因能极显著抑制KLF 7基因的启动子活性(P<0.01,见图2-A-1),显著增强A-FABP基因启动子活性(P<0.05,见图2-E-1),但对PPARγ、C/EBPα和FAS基因启动子活性无影响(见图2-B-1,图2-C-1,图2-D-1);在鸡胚成纤维细胞系(DF1)中,过表达HOPX基因可显著抑制KLF 7基因启动子活性(P<0.05,见图2-A-2),显著增强PPARγ和AFABP基因启动子活性(P<0.05,见图2-B-2,图2-E-2),但是对C/EBPα和FAS基因启动子活性无影响(见图2-C-2,图2-D-2);在鸡永生化前脂肪细胞系(ICPA-I)中,过表达HOPX基因能显著抑制KLF 7基因启动子活性(P<0.05,见图2-A-3),显著增强PPARγ基因启动子活性(P<0.05,见图2-B-3),对C/EBPα、FAS和A-FABP基因启动子活性无影响(见图2-C-3,图2-D-3,图2-E-3)。
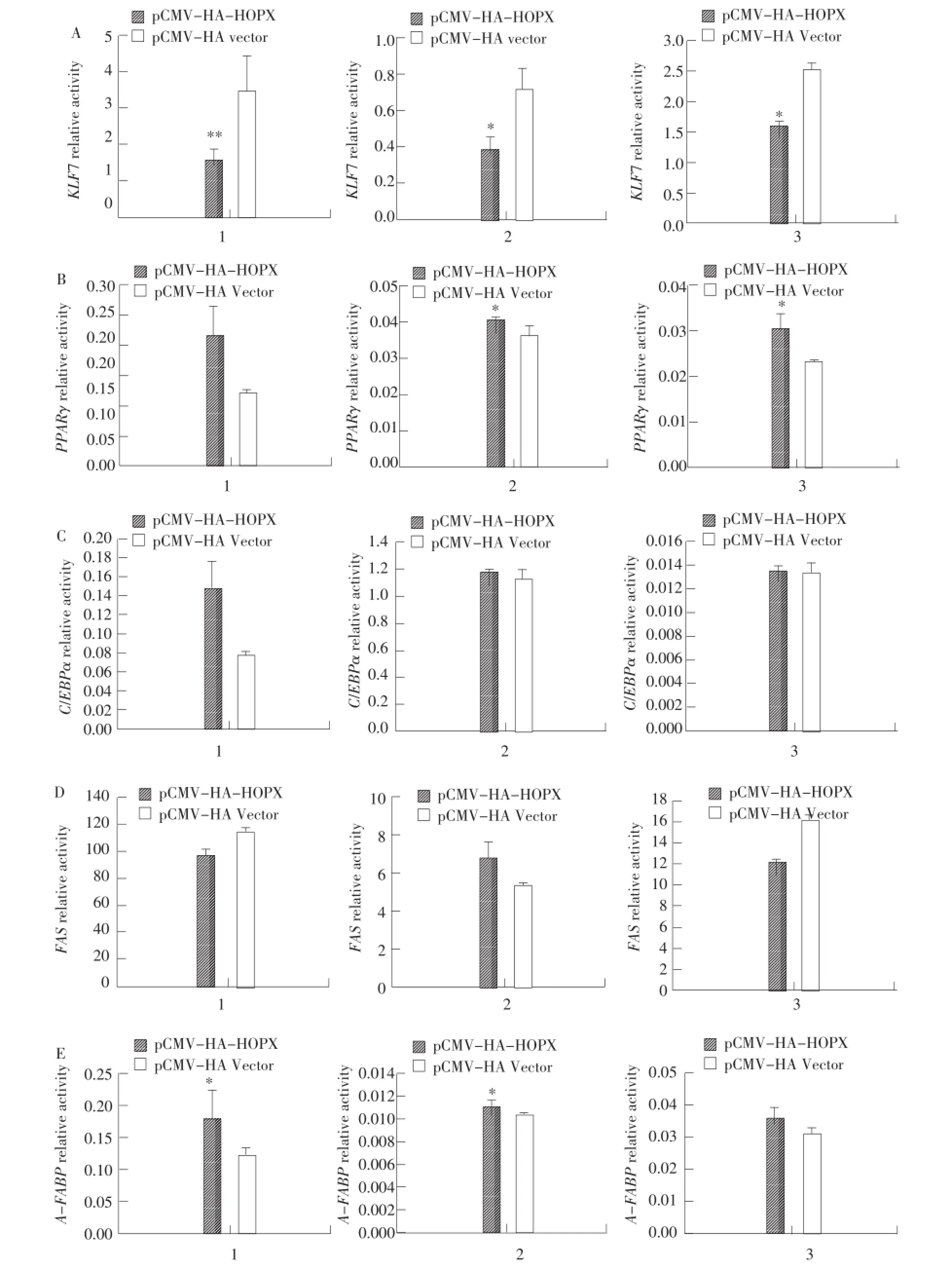
图2 HOPX过表达对鸡KLF 7、PPARγ、C/EBPα、FAS和A-FABP基因启动子活性的影响Fig.2 Effectsof HOPXoverexpressiononthepromoteractivitiesofchickenKLF7,PPARγ,C/EBPα,FASandA-FABPgenes
3 讨论与结论
HOPX基因在哺乳动物心脏发育及癌症发生中的研究已比较深入,但在其他器官和组织发育中的研究相对较少。东北农业大学高、低脂系肉鸡腹部脂肪组织的比较分析发现,随着高、低脂系肉鸡生长,高脂系肉鸡腹部脂肪细胞数目及脂肪细胞体积均高于低脂系鸡[22],结合本实验室前期研究发现,HOPX基因在东农高、低脂系肉鸡腹部脂肪组织中差异表达。因此,推测HOPX基因可能是导致东农高、低脂系肉鸡脂肪性状差异重要基因之一。本研究发现HOPX基因影响鸡脂肪生长发育重要基因表达和启动子活性,因此推测HOPX基因参与鸡脂肪组织生长发育调控。
骨骼肌细胞和前体脂肪细胞均起源于间充质干细胞[23],Kee等研究证明,HOPX基因能够促进骨骼肌细胞分化[10],但HOPX基因是否促进鸡前脂肪细胞分化尚未明确。本研究发现,HOPX基因能够显著上调PPARγ、C/EBPα和A-FABP基因mRNA的表达(见图1-B,图1-C,图1-E),在前脂肪细胞诱导分化24 h时,过表达HOPX基因会使C/ EBPα基因表达量显著升高(见图1-C),同时,会显著下调脂肪分化负调控因子KLF 7的表达量(见图1-A),推测HOPX基因可能具有促进鸡前脂肪细胞分化作用。鸡原代前脂肪细胞、鸡胚成纤维细胞系(DF1)及鸡永生化前脂肪细胞系(ICPA-I)中荧光素酶双报告基因分析结果表明,HOPX基因能够增强A-FABP和PPARγ基因的启动子活性(见图2-E-1/2、图2-B-2/3),抑制KLF 7基因启动子活性(见图2-A-1/2/3)。荧光素酶双报告基因分析结果与mRNA表达检测分析结果基本一致,提示HOPX基因可能具有促进鸡前脂肪细胞分化作用。
本研究发现,在不同细胞中HOPX基因过表达对不同脂肪发育重要基因启动子活性影响存在差异,这可能由于这些细胞遗传背景和细胞状态不同。表达分析发现,过表达HOPX基因48 h(诱导24 h)时,C/EBPα基因表达量升高(见图1-C),但pCMVHA-HOPX和pGL3-basic-C/EBPα(-2214/-19)共转染48 h后,报告基因检查发现,HOPX基因过表达对C/EBPα基因启动子活性无显著影响(P>0.05,见图2-C)。导致这一差异原因可能是由于C/EBPα基因启动子报告基因载体为质粒,可能不能反映染色体上C/EBPα基因启动子的真实状态和活性,但这一推测需进一步试验验证。
HOPX基因作为转录辅助因子不能与DNA结合,只能通过与其他蛋白结合发挥作用,目前已知与HOPX基因相互作用的3个蛋白中,HDAC2和SRF均与脂肪细胞分化有关。Mikkelsen等研究表明,SRF能抑制小鼠3T3-L1细胞分化[24];Yoo等研究表明,抑制HDAC2能促进脂肪细胞分化[25]。因此推测在鸡脂肪细胞发育过程中,HOPX可能通过与SRF和/或HDAC2蛋白互作调控鸡脂肪细胞分化。
本研究揭示过表达HOPX基因对脂肪发育(分化)重要基因表达和启动子活性影响。由于脂肪细胞分化过程复杂,要阐明HOPX基因在鸡前脂肪细胞分化中的作用,除基因表达检测和启动子活性分析外,还需要开展细胞形态学、脂肪合成以及HOPX分子作用机制等研究。虽然HOPX基因在鸡脂肪细胞分化中的功能及分子作用机制有待深入研究,但是可确定HOPX是新的脂肪生长发育调控因子。
[1] 张崇本.脂肪细胞的分化及调控[J].生理科学进展,2004,35 (1):7-12.
[2] 张志威.KLF 2、KLF 3和KLF 7在脂肪组织生长发育中的功能研究[D].哈尔滨:东北农业大学,2012.
[3] 张庆秋,石慧,王宇祥,等.鸡前脂肪细胞中A-FABP基因表达的变化对PPARγ、perilipin和A-FABP表达的影响[J].畜牧兽医学报,2012,43(10):1531-1538.
[4] 李慧,花保祯.Hox基因及其进化机制的研究进展[J].动物学杂志,2011:46(1):136-142.
[5]金淑清,浦予飞,裘莹.HOX基因的研究进展[J].癌症进展, 2011,9(2):154-158.
[6] Obarzanek F M,Favre B,Kypriotou M,et al.Homeodomain-only protein HOP is a novel modulator of late differentiation in kerati⁃nocytes[J].European Journal of Ccell Biology,2011,90(4):279-290.
[7] Fabian C,Hyun K,Aaron D G,et al.Hop is an unusual homeobox gene that modulates cardiac development[J].Cell,2002,110: 713-723.
[8] Chong H S,Liu Z P,Robert P,et al.Modulation of cardiac growth and development by HOP,an unusual homeodomain pro⁃tein[J].Cell,2002,110(6):725-735.
[9] Hyun K W,Raina J S,Hae J K,et al.Analysis of the structure and function of the transcriptional coregulator HOP[J].Biochemis⁃try,2006,45(35):10584-10590.
[10] Kee H J,Kim J R,Nam K I,et al.Enhancer of polycomb1,a nov⁃el homeodomain only protein-binding partner,induces skeletal muscle differentiation[J].Journal of biological chemistry,2009, 284:16308-16316.
[11] Hyun K,John J L,Aaron D G,et al.Cardiac hypertrophy and his⁃tone deacetylase-dependent transcriptional repression mediated by the atypical homeodomain protein Hop[J].Journal of Clinical Investigation,2003,112(6):863-871.
[12] Trivedi C M,Zhu W T,Wang Q H,et al.Hopx and Hdac2 inter⁃act to modulate Gata4 acetylation and embryonic cardiac myocyte proliferation[J].Developmental Cell,2010,19(3):450-459.
[13] Fraz A I,Zhang M Z,Hyun K,et al.Homeobox protein hop func⁃tions in the adult cardiac conduction system[J].Circ Res,2005,96 (8):898-903.
[14] Trivedi C M,Cappola T P,Margulies K B,et al.Homeodomain only protein x is down-regulated in human heart failure[J].Journal of Molecular and Cellular Cardiology,2011,50(6):1056-1058.
[15] Mina W,Keishi Y,Hiroshi K,et al.Cancer specific promoter CpG Islands hypermethylation of HOP homeobox(HOPX)gene and its potential tumor suppressive role in pancreatic carcinogene⁃sis[J].BMC Cancer,2012(12):397.
[16] Hiroshi K,Keishi Y,Mina W,et al.Epigenetic silencing of HOPX promotes cancer progression in colorectal cancer[J].Neo⁃plasia,2012,14(7):559-571.
[17] Daniel H,Yisong Y W,Elizabeth E E,et al.Homeodomain only protein is required for the function of induced regulatory T cells in dendritic cell-mediated peripheral T cell unresponsiveness[J]. Nature Immunology,2010,11(10):962-968.
[18] Yang J M,Sim S M,Kim H Y,et al.Expression of the homeobox gene,HOPX,is modulated by cell differentiation in human kerati⁃nocytes and is involved in the expression of differentiation mark⁃ers[J].European Journal of Cell Biology,2010,89(7):537-546.
[19] 王洪宝.影响鸡脂类代谢重要基因的筛选及调控通路分析[D].哈尔滨:东北农业大学,2008.
[20] 张坤.鸡HOPX基因的克隆及表达分析[D].哈尔滨:东北农业大学,2011.
[21] Wang Y X,Mu Y S,Li H,et al.Peroxisome proliferator-activated receptor-γ gene:A key regulator of adipocyte differentiation in chickens[J].Poult Sci,2008,87(2):226-232.
[22] Guo L,Sun B,Shang Z,et al.Comparison of adipose tissue cellu⁃larity in chicken lines divergently selected for fatness[J].Poult Sci,2011,90(9):2024-2034.
[23] Tchkonia T L M,Thomou T.Identification of depot-specific hu⁃man fat cell progenitors through distinct expression profiles and developmental gene patterns[J].Am J Physiol Endocrinol Metab, 2007:E298-E307.
[24] Mikkelsen T S,Xu Z,Zhang X,et al.Comparative epigenomic analysis of murine and human adipogenesis[J].Cell,2010,143(1): 156-169.
[25] Yoo C J,Choe S S,Kim K H,et al.Down-regulation of histone deacetylases stimulates adipocyte differentiation[J].Journal of Bi⁃ological Chemistry,2006,281(10):6608-6615.
Effect ofHOPXoverexpression on expression of the important devel⁃opmental genes in chicken adipose
WANG Ning,SHI Hongyan,CHENG Min,SUN
Yingning,LI Hui(Key Laboratory of Chicken Genetics and Breeding,Ministry of Agriculture,School of Animal Science and Technology,NortheastAgricultural University,Harbin 150030,China)
To explore the functions ofHOPXin chicken adipose development,in the present study, the effects ofHOPXoverexpression on mRNA expression and promoter activity of the important developmental genes in chicken adipose tissue were tested using Real-time RT-PCR and luciferase reporter assays.The results showed that compared to empty vector control,HOPXoverexpression increased the mRNA expression and promoter activities ofA-FABPandPPARγgenes,decreased the mRNA expression and promoter activity ofKLF7 gene,butHOPXoverexpression had no effect on mRNA expression and promoter activity ofFASgene.The results of this study indicate thatHOPXmay promote chicken preadipocyte differentiation.
HOPX;chicken;adipopocyte differentiation;development
S831
A
1005-9369(2015)05-0044-07
2014-04-02
国家重点基础研究发展计划(973计划)(2009CB941604);国家肉鸡产业技术体系项目(CARS-42);黑龙江高校科技创新团队建设项目(2010td02)
王宁(1964-),男,教授,博士,博士生导师,研究方向为动物遗传育种。E-mail:wayane123@aliyun.com

