神经干细胞移植联合促红细胞生成素对大鼠脊髓损伤的修复作用
赵 岩,肖宇龙,左 媛,王喜良,霍洪军,江建明,闫慧博
(1.内蒙古医科大学第二附属医院脊柱外科,内蒙古 呼和浩特 010030;2.南方医科大学附属南方医院脊柱外科,广东 广州 510515;3.南方医科大学第三附属医院脊柱外科,广东 广州 510630)
目前,脊髓损伤是神经损伤领域的常见疾病,但各国医学界对其治疗仍无重大突破。近年来研究[1]结果显示:与其他干细胞比较,神经干细胞(neural stem cells,NSCs)具有显著优势,NSCs有较高的自我更新和增殖潜能,具备早期胚胎细胞特性,能够分化为神经系统的各类细胞,其被认为是一种治疗脊髓损伤的理想干细胞。目前,研究[2]结果显示:促红细胞生成素(erythropoietin,EPO)是一种新型的组织保护因子,具有神经保护和营养作用。但针对NSCs移植联合EPO是否可有效地促进脊髓损伤大鼠功能的恢复尚鲜有研究。因此,本研究将NSCs和EPO联合用于治疗大鼠脊髓损伤,探讨联合应用治疗脊髓损伤的效果是否优于单纯NSCs移植,为临床治疗脊髓损伤提供理论依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器 健康成年雌性Wistar大鼠40只,体质量(220±20)g,孕14d的Wistar大鼠2只,均由内蒙古大学动物实验中心提供,动物合格证号:SCXK(蒙)2002-0001。DMEM-F12培养基、胎牛血清(FBS)和B27补充液(美国Gibco公司),EPO(沈阳三生制药公司),SABC免疫组织化学试剂盒、Nestin抗体和抗神经丝 NF-200抗体(武汉博士德公司)。FITC、胰蛋白酶和25cm2培养瓶(美国Corning公司),外科手术器械和纤维器械1套。
1.2 NSCs原代培养和鉴定 实验方法参考文献 [3],将孕鼠断头处死,迅速在无菌条件下剖腹取出胎鼠,剪开颅骨取脑组织,在解剖显微镜下分离中脑、海马和侧脑室下区组织。将分离的胎鼠脑组织用D-Hank’s液浸洗,用眼科剪将胎鼠脑组织剪成1mm×1mm×1mm的小组织块,用等体积0.125%胰酶37℃消化10~15min,反复机械吹打,然后加入双倍体积、含10%FBS的DMEM/F12终止消化。经200目不锈钢筛网过滤,800r·min-1离心10min,弃去上清液。加入完全培 养 液 [DMEM/F12 加 20mol· L-1B27,10μg·L-1碱 性 成 纤 维 生 长 因 子(bFGF),20μg·L-1表皮细胞生长因子(EGF)]。吹打为单细胞悬液后,以活细胞浓度为1×108L-1接种于培养瓶中[3]。于CO2培养箱中培养5~7d,每隔2~3d离心、半量换液1次,将传至3~4代的NSCs制作成细胞悬液,将细胞浓度调至1×109L-1[4-6],行 Nestin抗原免疫组织化学和免疫荧光鉴定。
1.3 大鼠脊髓全横断模型的建立[7]用3.5%戊巴比妥(1.3mL·100g-1)腹腔内注射麻醉,在无菌条件下以T8棘突为标志暴露脊髓T10节段[8-10],用钝头的钩针完整地挑起脊髓,尖刀片于大鼠T10节段处连同硬脊膜和脊髓组织一起切断,并切除1mm脊髓节段,弯头显微镊轻抬起横断脊髓两断端以明确脊髓组织完全横断,明胶海绵填塞脊髓损伤处。
1.4 动物分组和给药 40只大鼠随机分为4组,每组10只。对照组:造模后大鼠在明胶海绵中给予DMEM/F12培养液10μL,并腹腔注射等量生理盐水;NSCs组:大鼠造模成功后,将制备好的NSCs悬液用台式离心机离心5min(1000r·min-1),再用 DMEM 调整细胞浓度至1×109L-1,在损伤局部明胶海绵中注入NSCs悬液10μL,在损伤处上下各1mm范围内用微量注射器于0.25、0.50和0.75mm深度各注入 NSCs悬液共3μL,每个注射点0.5μL;EPO组:大鼠腹腔注射EPO 5000IU·kg-1,每天1次,连续注射7d,造模后在明胶海绵中给予DMEM/F12培养液10μL;NSCs+EPO组:移植NSCs并联合腹腔注射EPO,5000IU·kg-1,每天1次,连续注射7d。
1.5 免疫组织化学染色和FITC-NF-200免疫荧光染色观察大鼠NSCs和脊髓组织形态学 术后大鼠存活8周,8周后应用4%多聚甲醛磷酸盐溶液经心脏灌注固定,取脊髓损伤处及上下各1cm脊髓组织置于质量分数30%蔗糖溶液中4℃过夜。部分脊髓组织常规梯度脱水、透明、石蜡包埋,切片行抗神经纤维丝蛋白抗体NF-200免疫组织化学染色;部分脊髓组织行纵向连续冰冻切片,片厚为30μm,隔3张取1张,NF-200为一抗,行FITC荧光标记的NF-200神经纤维丝蛋白染色。
1.6 大鼠后肢运动功能评分的检测 应用实验性脊 髓 损 伤 运 动 功 能(Basso-Beattie-Bresnahan)BBB评分法[11]对大鼠后肢运动功能恢复情况进行评价,评价时间为术前12h和术后3、7、14、28、42和56d。所有数据均由2名非本研究组但熟悉本评分标准的人员进行随机双盲评分,取平均值作为最终得分。
1.7 统计学分析 采用SPSS 13.0统计软件进行统计学处理。各组大鼠后肢运动功能BBB评分以表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD法。
2 结 果
2.1 体外培养的NSCs形态学 从胎鼠中脑、海马和侧脑室下区组织分离的单个细胞近似圆形、大小相近,培养2~3d后大多数细胞死亡,只有少数细胞进入有丝分裂期,镜下可见明显细胞核分裂象,分裂象的细胞逐渐聚集成团。细胞培养4~5d后,可见数个到数十个由细胞组成呈悬浮状的球状细胞团,这些细胞团体积很小,折光性强,突起不明显,边界清楚,大多呈褐色,边缘见较小毛刺,称为 “神经干细胞球”,中心部分颜色较深,但边缘颜色较浅(图1A,见插页五)。将传代后的神经干细胞球制备成单细胞悬液,经2~3d培养,可见这些单个细胞出现分裂现象,并重新形成小的细胞团,经5~6d培养,培养液中出现散在的、大小不等的神经干细胞球,7d时形成大的神经干细胞球,其边界清楚、折光性强。NSCs标记性蛋白Nestin在原代和传代培养的神经干细胞球中均有表达,并呈现绿色荧光(图1B,见插页五)。
2.2 大鼠损伤脊髓组织的形态学 术后8周,肉眼见损伤处脊髓组织因瘢痕组织增生而颜色变深,损伤处脊髓组织轻度萎缩(图2,见插页五)。横断处脊髓组织纵向切片NF-200染色显示:对照组大鼠横断处脊髓组织残端萎缩,横断区均为透明、不着色的瘢痕组织所代替,脊髓白质和灰质间可见大量空洞形成(图3A,见插页六);NSCs+EPO组大鼠横断处脊髓组织残端轻度萎缩,横断区可见大量呈杂乱、无序生长的神经纤维,并可见有连续性神经纤维通过脊髓横断区,脊髓白质和灰质间可见少量空洞形成(图3B,见插页六)。对照组和EPO组大鼠未见有明显的神经纤维再生;NSCs组大鼠可见少量的神经纤维再生,未通过损伤区到达尾侧;NSCs+EPO组大鼠中,FITC共轭抗神经丝蛋白抗体NF-200标记的再生神经纤维在横断区头侧大量再生,呈无序状生长,并通过损伤区到达尾侧(图4,见插页六)。
2.3 各组大鼠后肢运动功能BBB评分 正常大鼠后肢运动功能BBB评分为21分。在本实验中,术后3d内4组大鼠后肢运动功能的BBB评分均为0分。而后随着时间的推移,4组大鼠后肢运动功能BBB评分均有不同程度升高,提示大鼠后肢运动功能均出现不同程度的恢复。尤以NSCs+EPO组大鼠更为显著,并呈一定规律,脊髓横断损伤后各组大鼠后肢运动功能丧失,1周后开始恢复,其中2~5周恢复较快,6~8周后恢复明显减慢。术后1~4周,NSCs组和EPO组大鼠后肢运动功能BBB评分比较差异无统计学意义(P>0.05),4周后NSCs组与EPO组大鼠后肢运动功能BBB评分比较差异有统计学意义(P<0.05);NSCs+EPO组大鼠后肢运动功能BBB评分高于其他各组(P<0.05)。术后8周末,NSCs+EPO组大鼠前、后肢运动协调、有规律,后肢脚掌可负重,但仍无法使躯体抬离地面;NSCs组大鼠前、后肢运动协调功能欠佳,只有少数大鼠后肢脚掌可负重,其余大鼠后肢脚趾呈弯曲状,负重功能欠佳;对照组和EPO组大鼠后肢运动均为不协调、无规律的滑动。各组大鼠后肢运动功能BBB评分 见表1。
表1 各组大鼠后肢运动功能BBB评分Tab.1 BBB scores of motor function of hind limbs of rats in various groups (n=10,)
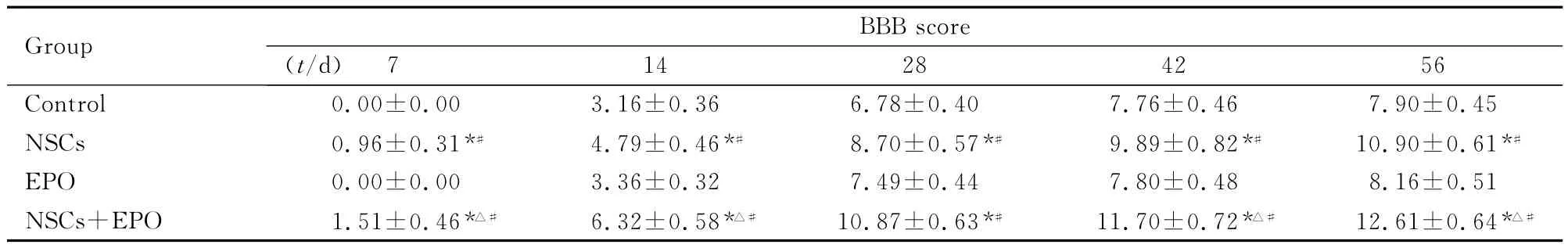
表1 各组大鼠后肢运动功能BBB评分Tab.1 BBB scores of motor function of hind limbs of rats in various groups (n=10,)
*P<0.05 vs control group;△P<0.05 vs NSCs group;#P<0.05 vs EPO group.
7 14 28 42 56 Control 0.00±0.00 3.16±0.36 6.78±0.40 7.76±Group BBB score(t/d)0.46 7.90±0.45 NSCs 0.96±0.31*# 4.79±0.46*# 8.70±0.57*# 9.89±0.82*# 10.90±0.61*#EPO 0.00±0.00 3.36±0.32 7.49±0.44 7.80±0.48 8.16±0.51 NSCs+EPO 1.51±0.46*△# 6.32±0.58*△# 10.87±0.63*# 11.70±0.72*△# 12.61±0.64*△#
3 讨 论
脊髓损伤后很难再生修复,其主要原因包括损伤局部神经营养因子的缺乏和大量抑制性因子的分泌导致轴突再生的微环境遭到破坏;脊髓损伤后脊髓再生能力不足;损伤局部有胶质瘢痕形成。如能解决上述问题则有望解决脊髓损伤后神经修复和功能恢复的难题。自Reynolds等[12]首次在成年小鼠脑纹状体中分离出可在体外分裂增殖、具有分化潜能的细胞群,并正式提出了 “NSCs”的概念以来,人们对其研究一直没有中断,并发现其有以下几方面的基本特性[13-14]:可自我更新,从而维持稳定的细胞储备;具有多向分化潜能,可分化为神经系统的各种细胞。鉴于其上述独特的生物学特性,因此被认为是一种理想的移植种子细胞。本实验从胎鼠脑组织中提取NSCs进行体外培养,观察到其具有很好的克隆能力,并可稳定传代。但NSCs在体内自然分化为神经元的比例仅占1%,分化为胶质细胞和少突胶质细胞却分别占31.2%和50.3%[15],这严重影响NSCs移植后对脊髓损伤的修复效果。Watt等[16]和Hermanson等[17]采用各种神经生长因子或药物对NSCs进行体外诱导,但分化为神经元的比例报道不一。近年来随着人们对EPO研究的深入,证实其是一种新型的组织保护因子,具有神经营养和神经保护作用。研究[18]结果显示:在实验性自身免疫性脑脊髓炎模型中,EPO能够增强少突胶质细胞的增殖和髓鞘的再生,促进脊髓损伤后神经功能的恢复。袁丽丽等[19]观察EPO对体外培养的大鼠NSCs凋亡和分化的影响结果显示:EPO可降低体外培养的大鼠NSCs的凋亡率,促进NSCs向神经元方向分化。尽管近些年的研究[20-22]显示:EPO具有神经保护、神经营养的作用,但很少有人将NSCs和EPO联合用于治疗大鼠脊髓损伤。
本研究将NSCs和EPO共同作用于横断性脊髓损伤大鼠,利用EPO对NSCs的增殖及分化的影响,以期有效促进脊髓损伤大鼠脊髓功能的恢复,从而为临床治疗脊髓损伤提供实验理论依据。本研究结果显示:脊髓损伤大鼠如术后未给予任何的干预措施,自然恢复后其后肢运动功能BBB评分一般均在10分以下,大多集中在8分左右;术后8周,NSCs+EPO组大鼠后肢功能恢复明显优于其他各组,对照组和EPO组大鼠后肢运动功能BBB评分比较差异无统计学意义;随着时间的延长,NSCs+EPO组大鼠后肢功能恢复更为显著,NSCs+EPO组大鼠在术后28d时后肢运动功能BBB评分达即可到10分以上,证明其对脊髓功能的恢复作用显著。
目前判定损伤脊髓是否再生修复的标志是检测是否有神经轴突的再生,NF-200是构成神经细胞体和神经轴突的框架,脊髓损伤后随着神经轴突的变性坏死,构成神经轴突框架的NF-200也随之崩溃减少,甚至消失为空洞或为瘢痕组织所替代。本研究中术后8周NF-200免疫组织化学染色结果显示:对照组大鼠横断处脊髓组织残端萎缩,横断区均为透明、不着色的瘢痕组织,脊髓白质和灰质间可见大量空洞形成;NSCs+EPO组大鼠横断处脊髓组织残端轻度萎缩,横断区可见大量呈杂乱、无序生长的神经纤维,并有连续性神经纤维通过脊髓横断区,脊髓白质和灰质间可见少量空洞形成;NSCs+EPO组大鼠FITC共轭抗神经丝蛋白抗体NF-200标记的再生神经纤维在横断区头侧大量再生,呈无序状生长,并通过损伤区到达尾侧;对照组大鼠未见有明显的神经纤维再生;NSCs组大鼠可见少量神经纤维再生,未通过损伤区到达尾侧。本研究结果表明:无论是单纯NSCs移植治疗脊髓损伤还是NSCs联合EPO治疗脊髓损伤,二者均可以促进大鼠脊髓横断损伤后后肢运动功能的恢复,但NSCs联合EPO治疗脊髓损伤的修复作用更加显著。
本研究结果表明:NSCs移植联合腹腔注射EPO较单纯NSCs移植能更有效地促进脊髓损伤大鼠后肢运动功能的恢复,该方法是探索脊髓损伤治疗策略的一种有意义的、积极的尝试,同时也为临床治疗脊髓损伤提供了非常重要的实验理论依据。
[1]Andres RH,Horie N,Slikker W,et al.Human neural stem cells enhance structural plasticity and axonal transport in the ischaemic brain [J].Brain,2011,134(6):1777-1789.
[2]Sanchis-Gomar F,Perez-Quilis C,Lippi G,et al.Erythropoietin receptor(EPOR)agonism is used to treat a wide range of disease [J].Mol Med,2013,19(1):62-64.
[3]徐富翠,邹礼乐,梅欣明,等.神经干细胞培养及其影响因素 [J].中国组织工程研究,2013,17(10):1835-1840.
[4]张殿君,刘 一,付长峰,等.新生大鼠脊髓源性神经干细胞的分离培养及分化鉴定 [J].吉林大学学报:医学版,2009,35(2):230-233.
[5]Salazar DL,Uchida N,Hamers FP,et al.Human neural stem cells differentiate and promote locomotor recovery in an early chronic spinal cord injury NOD-scid mouse model [J].PLoS One,2010,5(8):1-15.
[6]张向荣,郭光华,刘德伍,等.人骨髓间充质干细胞的分离培养及BrdU标记鉴定 [J].中国组织工程研究和临床康复,2009,13(19):3618-3622.
[7]孟步亮,巴迎春,宋士娜,等.脊髓全横断大鼠模型的构建 [J].中国组织工程研究与临床康复,2011,15(7):1215-1218.
[8]Zhang SX,Huang F,Gates M,et al.Extensive scarring induced by chronic intrathecal tubing augmented cord tissue damage and worsened functional recovery after rat spinal cord injury [J].J Neurosci Methods,2010,191(2):201-207.
[9]Ozsoy O,Ozsoy U,Stein G,et al.Functional deficits and morphological changes in the neurogenic bladder match the severity of spinal cord compression [J].Restor Neurol Neurosci,2012,30(5):363-381.
[10]Talac R,Friedman JA,Moore MJ,et al.Animal spinal cord injury for evaluation of tissue engineering treatmentstrategies[J].Biomaterials,2004,25(9):1505-1510.
[11]Basso DM,Beattie MS,Bresnahan JC.Graded histological and locomotor outcomes after spinal cord contusion using the NYU weight-drop device versus transaction[J].Exp Neurol,1996,139(2):244-256.
[12]Reynolds BA,Tetzlaff W,Weiss S.A multipotent EGF-responsive striatal embryomic progenitor cell produces neurons and astrocytes [J].J Neurosci,1992,12(11):4564-4574.
[13]Nakamura M,Toyama Y,Okano H.Transplantation of neural stem cells for spinal cord injury [J].Rinsho Shinkeigaku,2005,45(11):874-876.
[14]Nandoe Tewarie RS,Hurtado A,Bartels RH,et al.Stem cell-based therapies for spinal cord injury [J].J Spinal Cord Med,2009,32(2):105-114.
[15]Parr AM,Kulbatski I,Tator CH.Transplantation of adult rat spinal cord stem/progenitor cells for spinal cord injury [J].Neurotrauma,2007,24(5):835-845.
[16]Watt FM,Hogan BL.Out of Eden:stem cells and their niches[J].Science,2000,287(5457):1427-1430.
[17]Hermanson O,Jepsen K,Rosenfeld MG.N-CoR controls differentiation of neural stem cells into astrocytes [J].Nature,2002,419(6910):934-939.
[18]Kang SY,Kang JH,Choi JC,et al.Expression of erythropoietin in the spinal cord of Lewis rats with experimental autoimmune encephalomyelitis [J].J Clin Neurol,2009,5(1):39-45.
[19]袁丽丽,杜红梅,管英俊,等.促红细胞生成素体外培养鼠胚脑皮质神经干细胞的分化 [J].中国组织工程研究与临床康复,2011,15(49):9174-9177.
[20]Subiros N,Del Barco DG,Coro-Antich RM.Erythropoietin:still on the neuroprotection road [J].Ther Adv Neurol Disord,2012,5(3):161-173.
[21]Hong Z,Hong H,Chen H,et al.Investigation of the protective effect of erythropoietin on spinal cord injury in rats[J].Exp Ther Med,2011,2(5):837-841.
[22]Giese AK,Frahm J,Hubner R,et al.Erythropoietin and the effect of oxygen during proliferation and differentiation of human neural progenitor cells [J].BMC Cell Biol,2010,11(94):3-13.

