螺旋涂布法评价联合诱导制备大鼠肝S9的活性大小
单 纯,张凤兰,崔生辉
(中国食品药品检定研究院,北京 100050)
沙门氏菌致突变(Ames)试验现广泛应用于检测食品添加剂、化妆品等的致突变性,在其标准操作中,需将细菌测试菌株与受试物以及可选外源性代谢活化系统(S9)三者混合进行熔化琼脂覆盖培养。但实验周期较长、需用仪器设备多、方法要求严格、操作步骤复杂、实验成本高,在筛选、抽检大量检品时有一定难度。沙门氏菌螺旋涂布致突变检测技术是新开发、低成本、自动化高、试验周期短的一种微生物检测技术,目前国内外实验室认知并使用该技术较少[1]。本实验室建立该法目的主要是以期最终替代经典回复突变试验对大量未知样品的快速筛检和食品化妆品大量抽检工作改善Ames试验梯度稀释的低效率问题。体外代谢活化剂(S9)常使用“多氯联苯”(PCBs)作为诱导剂。PCBs已被国际上定为致癌剂、长久不宜消除的有机污染物,已禁止生产使用。目前常采用的如3-甲基胆蒽等单独诱导制备诱导剂,存在活化程度不稳定、敏感性低、无指标进行有效控制等缺陷,试验结果出现几十到上百倍的误差[2]。故本实验室采用苯巴比妥和β-苯黄酮(BF)联合诱导大鼠肝S9以替代PCBs,并比较不同来源S9活性优劣[3]。目前国内外保存S9均保存于液氮或-80℃冰箱中,反复冻融造成酶活大大降低,故本实验室在酶保护剂作用下将S9呈液态长期置-20℃冰箱中,替代传统酶保存方法。
1 材料和方法
1.1 实验动物及饲养条件
SPF级 SD大鼠24只,雄性,体重180~200 g,由中国食品药品检定研究院实验动物资源中心提供【SCXK(京)2009-0017】,实验在中国食品药品检定研究院三级实验动物室进行【SYXK(京)2011-0008】,温度22℃ ~24℃,相对湿度40% ~45%,日光灯12 h照明。大鼠繁殖颗粒饲料和去离子水,自由饮水。
1.2 主要试剂及仪器
β-苯黄酮,苯巴比妥钠,2-氨基芴,冷冻离心机,比浊仪,CO2培养箱,螺旋涂步仪,市售S9(多氯联苯诱导制得)。
1.3 分组和剂量设定
联合诱导组为苯巴比妥钠+萘黄酮80 mg+100 mg/kg,另设溶剂对照组(玉米油)每组大鼠12只。
1.4 动物处理及S9制备
联合诱导:给药组于处理1、2、3 d大鼠灌胃给予苯巴比妥钠+萘黄酮,每天1次,剂量为80 mg+100 mg/kg,给药体积为2 mL/kg。大鼠在首次注射后4 d处死,处死前12 h禁食不禁水;对照组给予玉米油2 mL/kg,余下步骤同一般肝S9制备方法。S9分装于冻存管中,速冻后,部分保存于超低温冰箱中用于实验验证活性[4-5]。
1.5 Ames试验
增菌:将来自MH主板的单个菌落接种至TSB营养肉汤的20 mL无菌锥形瓶中。接种后的锥形瓶在37℃、125 r/min的旋转培养箱中孵育16 h。将培养物于5080 r/min,4℃,离心10 min,弃去上清,用0.15 mol/L PBS洗涤,连续离心3次。后将培养物用比浊仪测浊度值在0.8~1之间,即约每毫升1×109至2×109个细胞的密度,存放于冰箱直到需要进行生物检验[6]。采用平板掺入法,选阳性对照物为2-氨基芴(2-AF,100 μg/mL),阳性组每皿加 2-AF溶液0.1 mL,每组3个平行平板,三种S9(联合诱导、对照、市售)分别设加S9混合液(浓度10%)0.5 mL的阳性组,菌株TA98、TA100通过鉴定都符合试验要求。经其余同一般Ames试验。试验重复1 次[7-9]。
1.6 螺旋涂布评价S9活性方法的建立
TA100比浊浓度为109数量级后用于实验(比浊值:0.8~1)。
螺旋涂布仪每皿匀速涂布TA100原菌液20 μL(Unif,20 μL),待干后(<1 min)均速涂布 20 μL 阳性剂 2-AF(100 μg/mL),静置 <1min,最后以对数递减(log,50 μL)分别涂布 50 μL 三种肝 S9(市售、联合诱导、对照)。实验保证每次涂布平皿起点相同,依次覆盖从而形成一个阿基米德螺旋。涂布完毕待干后倒扣于37℃培养箱培养48 h后,接种受试物的营养最低需求培养板上将选择性地生长突变菌种。突变体菌落采用细菌菌落计数仪计数[1,10 -11]。
1.7 肝S9低温保存法的建立
20 mmol/L Tris-HCl(pH=7.4)、1 mmol/L CaCl2、50%丙三醇、47%S9原液制备低温储存液。制备后的低温储存液将呈液态保存于-20℃冰箱中。用Ames实验方法,选择菌株 TA98、TA100,分别于配制后1周、1个月、3个月验证该储存液活性[12-13]。
2 结果
2.1 Ames试验菌株回变数结果
TA98、TA100两种菌株分别采用联合诱导法制备和市售S9活化的阳性组回变数无较大差异,采用联合诱导法制备、市售S9阳性组的回变数均超过相同条件下对照组大鼠制备S9回变数的2倍以上,出现阳性结果。两种S9活性间无显著性差异,且均高于对照组大鼠S9活性(P <0.05,表1)。
2.2 螺旋涂布实验结果
涂布用S9浓度选择较合理(38%),能做出比较好的浓度梯度,线性关系明显。涂布平皿阿基米德螺旋清晰可见,菌落回变数随螺旋由内向外依次递减。回变数 S9涂布量在1.48~6.62 μL/μL菌液浓度下,有较好的致突变活性,检测组菌落数均达到自发回变组及阳性对照组相应菌落数的2倍以上,可以判定结果阳性(P﹤0.05,表2,图1)。
2.3 Ames实验验证肝S9低温保存法的可行性
Ames验证活性结果表明:在3个月内,S9储存液活性与原液活性相当,加入的离子及甘油保护剂不会对其活性造成影响(P﹤0.05,表3,4)。
3 讨论
在体外致突变试验中体外代谢活化剂是实验中必不可少的重要环节。目前国内实验室多使用市售S9上清液,一般300元/2mL/支,价格昂贵,使实验成本大大增加;实验结果表明,实验室自制S9活性与市售S9活性相当,无显著性差异。选择联合诱导制备大鼠肝匀浆S9,不仅试剂方便够得,减少污染,且可以大大降低实验成本,在某些条件下可以替代市售S9用于实验。沙门氏菌螺旋涂布法的原理与Ames及其同事发明的标准平板插入法的原理一致;即,在存在或不存在外源性代谢活化系统的情况下,暴露于一定剂量范围的受试物后突变细菌受试菌株出现选择性生长。不同的是,在螺旋涂布法中,这些步骤是自动化的,使用特定机器依次将细菌、受试物和S9混合物加入到旋转琼脂培养板上,依次覆盖从而形成一个阿基米德螺旋,最终密度均匀的细菌将暴露于一系列连续浓度梯度的受试物中。在37物加孵育48~72h后,接种受试物的营养最低需求培养板上将选择性地生长突变菌种。突变体菌落采用细菌菌落计数仪计数,该计数仪可对螺旋路径上的菌落进行计数。计数仪与装有特别设计的用于螺旋涂布培养板分析程序的个体计算机相连。经分析可得出突变体的数目、大小和位置,通过这些信息,可得出每块螺旋涂布培养板的剂量-反应曲线[14-15]。
表1两种诱导方法制备的S9阳性诱变剂Ames试验回变数结果(±SD)Tab.1 Results of the Ames assay using S9 from 2 souces
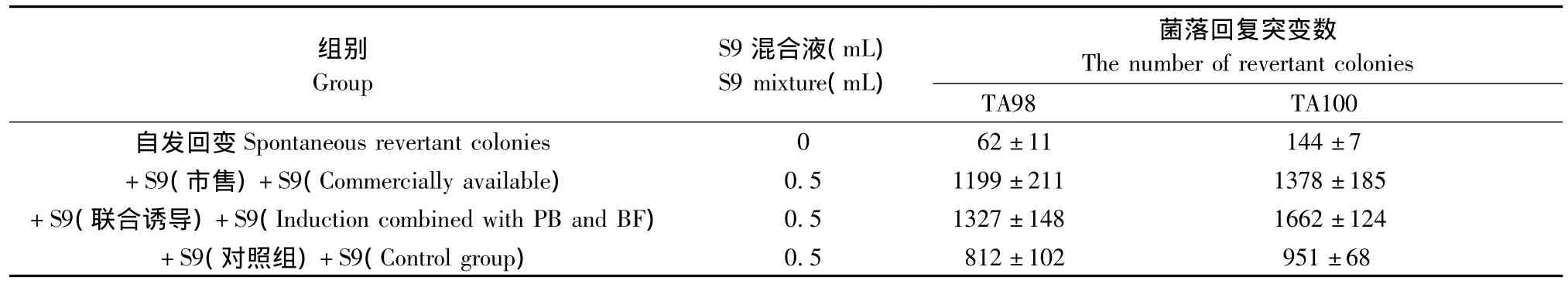
表1两种诱导方法制备的S9阳性诱变剂Ames试验回变数结果(±SD)Tab.1 Results of the Ames assay using S9 from 2 souces
组别Group S9混合液(mL)S9 mixture(mL)菌落回复突变数The number of revertant colonies自发回变Spontaneous revertant colonies 0 62±11 144±7+S9(市售)+S9(Commercially available) 0.5 1199±211 1378±185+S9(联合诱导)+S9(Induction combined with PB and BF) 0.5 1327±148 1662±124+S9(对照组)+S9(Control group)0.5 812±102 951±68

表2 螺旋涂布法验证S9致突变活性Tab.2 Results of the activation of S9 using spiral coating technique

图1 螺旋涂布法验证S9致突变活性TA100菌回复突变数情况Fig.1 The reverse mutation number of Salmonellatyphimurium histidine strains TA100 using spiral coating technique

表3Ames法验证S9低温储存液致突变活性(TA98、TA100,ˉx±SD)Tab.3 Results of the activation of S9 stored in -20℃ refrigerator using the Ames assay
螺旋涂布法可将一系列浓度梯度的受试物涂布在单个琼脂板上,促进了其在致突变性研究领域的使用。沙门氏菌螺旋涂布致突变检测技术自Houk[16]发明此法自今,已成为国外实验室致突变检测技术中多项研究的选择。其被国际公职分析化学工作者协会(AOAC)批准,是APHA推荐的致突变检测替代方法。国内实验室建立和应用该实验方法十分罕见,查阅国内、外文献报导,各实验室还没有一整套规范的操作方法及结果评价体系。本实验室已对涂布用培养基的配制、受试物的前处理及平皿涂布方式、细菌接种数量及操作顺序、稳定自发回变数范围、确定细菌回复突变数等逐一成功建立。研究结果表明,在进行与标准法相同剂量范围的检测时,螺旋涂布法仅需要约1/10的纯化合物样本量以及1/40~1/80的复杂混合物样本量,剂量-反应分析数据来源于单个琼脂培养板而非一系列培养板。证实了其方法的的突出特点“敏感”、“广谱”、“快速”、“低廉”。
国内外实验室S9肝匀浆系统多保存在液氮罐或-80℃冰箱中,每次使用前需室温融化,大大降低酶的活性和利用率。本实验室将制成品S9经酶保护剂作用,在液态下长期于-20℃冰箱储存。结果表明,通过3个月时间的验证,加入甘油保护剂不会对S9活性造成影响,避免了反复冻融使酶活性降低。最终确定一套实验室制备规范,达到诱导剂易购买、对环境、人类危害轻微、成本低廉、制得的代谢活化剂酶生物活性高且稳定的目的。为本实验室今后大量、快速、准确筛检食品、保健食品和化妆品打下物质基础。
[1] Claxton,L.D.,V.S.Houk,S.Warren.Methods for the spiral Salmonella mutagenicity assay including specialized applications[J].Mutat Res,2001.488(3):241 -257.
[2] 王亚其,肖凯,刘玉清,等.两种诱导方法制备大鼠肝S9在两种遗传毒性试验中活性比较.现代预防医学[J],2006.33(4):4.
[3] Garcia Franco,S.,G.Dominguez,J.C.Pico.Alternatives in the induction and preparation of phenobarbital/naphthoflavoneinduced S9 and their activation profiles[M].Mutagenesis,1999.14(3):323-326.
[4] Woodall,G.M.,Jr.,W.C.Dauterman,D.M.DeMarini.Effect of dietary casein levels on activation of promutagens in the spiral Salmonella mutagenicity assay.II.Studies with induced rat liver S9[J].Mutat Res,1996.360(2):127 -143.
[5] Atsushi Hakura,S.S.,Shigeki Sawada,et al.An improvement of the Ames test using a modified human liver S9 preparation[J].Journal of Pharmacological and Toxicological Methods,2002.169:4.
[6] Maron,D.M.and B.N.Ames.Revised methods for the Salmonella mutagenicity test[J].Mutat Res,1983.113(3 -4):173-215.
[7] Aubrecht.Bioluminescent Salmonella reverse mutation assay:a screen for detecting mutagenicity with high throughput attributes[J].Mutagenesis,2007.22(5):335 -342.
[8] Jemnitz,K.Comparative study in the Ames test of benzo[a]pyrene and 2-aminoanthracene metabolic activation using rat hepatic S9 and hepatocytes following in vivo or in vitro induction[J].Mutagenesis,2004.19(3):245 -250.
[9] Claxton,L.D.,A.Umbuzeiro Gde,D.M.DeMarini.The Salmonellamutagenicity assay:the stethoscope ofgenetic toxicology for the 21st century[J].Environ Health Perspect,2010.118(11):1515-1522.
[10] Houk,V.S.,S.Schalkowsky,L.D.Claxton.Development and validation of the spiral Salmonella assay:an automated approach to bacterial mutagenicity testing[J].Mutat Res,1989.223(1):p.49-64.
[11] Claxton,L.D.Evaluating the relationship of metabolic activation system concentrations and chemical dose concentrations for the Salmonella spiral and plate assays[J].Mutat Res,1991.253(2):127-136.
[12] Yang,Z.Rapid purification of truncated Taq DNA polymerase Stoffel fragment by boiling lysis of bacterial expression cultures[J].Biotechnol Appl Biochem,2008.50(Pt 2):71-75.
[13] Youngblom,J.Extended stability of Taq DNA polymerase and T4 DNA ligase at various temperatures[J].Biotechniques,2003.34(2):264-266,268.
[14] B.N.Ames,J.M.,E.Yamasaki.Methods for detecting carcinogensand mutagenswith the Salmonella/mammalian microsome mutagenicity test[J].Mutat 1975.31:17.
[15] Ames, B.N. Identifyingenvironmentalchemicalscausing mutations and cancer[J].Science,1979.:p.6.
[16] Association of Official Analytical Chemists. General referee reports[S].J Assoc Off Anal Chem,1989.72(1):62 -137.

