融水小型猪剖检程序以及主要脏器自发性病变组织学观察
施赫赫,孙 侠,刘 科,任海涛,陈 淦,黄 威,钟志勇,刘运忠,林秋雄,唐小江
(1.广东省医学实验动物中心,广东佛山 528248;2.广东贝格生物科技有限公司,广东佛山 510642;3.广州医药工业研究总院,广州 510240;4.广东省医学科学院,广州 510060)
猪在解剖学、生理学、疾病发生机制等方面与人极其相似,小型猪作为实验动物应用十分广泛,包括肿瘤、心血管病、糖尿病、外科、牙科、皮肤烧伤、血液病、遗传病、营养代谢病和新药评价等多个方面[1]。小型猪因体型小,便于实验研究,许多个国家的研究机构对小型猪已经进行深入研究和应用。脏器解剖学和组织学数据是衡量动物遗传品质的重要生物学特性,在遗传品质鉴定、衡量和动物功能状态以及药物、生物制品非临床安全性评价中起到重要的作用[2],这些指标的测定及评价对小型猪的研究应用具有重要意义和价值。融水小型猪(rongshui miniature pig,RMP)是一种体型小、性情温驯的小黑猪。2009年本课题组在广西壮族自治区融水县杆洞村苗寨发现并将该品种引种到广东佛山三水乐平镇的小型猪基地进行实验动物化研究。该猪种缺少科学、系统的观测数据,测定和分析各种生物学数据是融水小型猪实验动物化的基础。为此,我们初步对F1代融水小型猪进行了主要器官解剖学和组织学观察,制作组织切片进行观察拍照,同时测定了全身血量及血浆量、记录脊椎数量和恒齿齿式。
1 材料和方法
1.1 动物来源
6月龄普通级融水小型猪4头,雌雄各半,由广东贝格生物科技有限公司(广东省医学实验动物中心小型猪研发基地)提供。实验动物及实验操作经过广东省医学实验动物中心伦理委员会批准。
1.2 动物饲养条件
饲养环境为普通级,湿帘通风系统和局部保温灯控制舍内温湿度,夏天温度可控制在28℃ ~30℃,冬天温度可控制在16℃ ~20℃;每天定时定量饲喂全价颗粒料,上下午各一次;自由饮水。
1.3 主要仪器及试剂
1.3.1 主要仪器:轮转切片机(德国LEICA公司RM2135),生物组织全自动脱水机(湖北孝感医用仪器有限公司TS-12C),生物组织包埋机及冷冻机(湖北孝感医用仪器有限公司 BM-VII),摊片烤片机(湖北孝感医用仪器有限公司 CS-VI),生物组织全自动染色机(湖北孝感医用仪器有限公司 RS-18),病理图像分析系统(日本奥林巴斯BX41)。
1.3.2 主要试剂:福尔马林、石蜡、二甲苯、酒精、伊红、苏木素、中性树胶。
1.4 方法
1.4.1 解剖、组织学检查项目
心脏、肝脏、脾脏、肺脏、肾脏、肾上腺、脑、脊髓、胃、十二指肠、空肠、回肠、结肠、直肠、睾丸、附睾、前列腺、精囊腺、子宫、卵巢、胸腺、胰腺、淋巴结、肌肉、坐骨神经、甲状腺、膀胱、胆囊。
1.4.2 解剖
解剖前禁食12 h,麻醉后颈动脉放血,处死后立即分离主要脏器,剔除脏器表面的脂肪和筋膜,用滤纸吸净表面的血液,使用电子天平称量实质器官重量,并用NICON D4000单反相机拍照。软尺测量大小肠长度并记录颈椎、胸椎、腰椎、骶椎、尾椎、乳头数量及齿式。
1.4.3 制片
组织标本经取材、固定、修块、流水冲洗、脱水、透明、浸蜡、石蜡包埋后,石蜡切片,HE染色、封片;
1.4.4 读片
将制作好的HE染色切片置于显微镜下,从低倍到高倍观察组织有无病理变化,并用奥林巴斯BX41显微镜拍照。
2 结果(彩图见彩插1-7)
2.1 大体解剖流程及解剖图
对4头融水小型猪进行大体解剖,过程如下:沿气管旁剪开皮肤,钝性分离皮下结缔组织和肌肉,找到颈动脉钝性分离,使用血管夹夹住近心端,在远心端作一斜面切口插入导管并用棉线扎紧,放开血管夹放血用于测定全身血量和血浆量。切开腹部中部纵向皮肤,在腹白线处分离皮下结缔组织,肌肉与腹膜;暴露腹腔取出各个器官并称重拍照;分离胸骨暴露胸腔,取出器官称重拍照。切开头颅皮肤,分离皮下结缔组织与肌肉;锯开颅骨暴露脑组织并取出称重拍照。取完各脏器后,分别分离出后腿侧的坐骨神经;分离出脊椎,记录各段数量;观察恒齿,并记录数量。大体解剖见图1。
2.2 脏器重量、脏器系数、脊椎数量及恒齿齿式
对4头融水小型猪测定了脏器重量及脏器系数,记录了脊椎数量等数据。脏器重量及脏器系数见表1,数据以平均数(ˉx)和标准差(SD)表示,未进行统计分析。从表1可知,雄性体重小于雌性,除了肾上腺平均重量相同外,其各主要脏器平均重量都是雄性小于雌性。脏器系数除了胸腺的脏器系数是雄性大于雌性外,其他主要脏器系数均是雄性小于雌性。脊椎个数等其他基础数据(表2)。
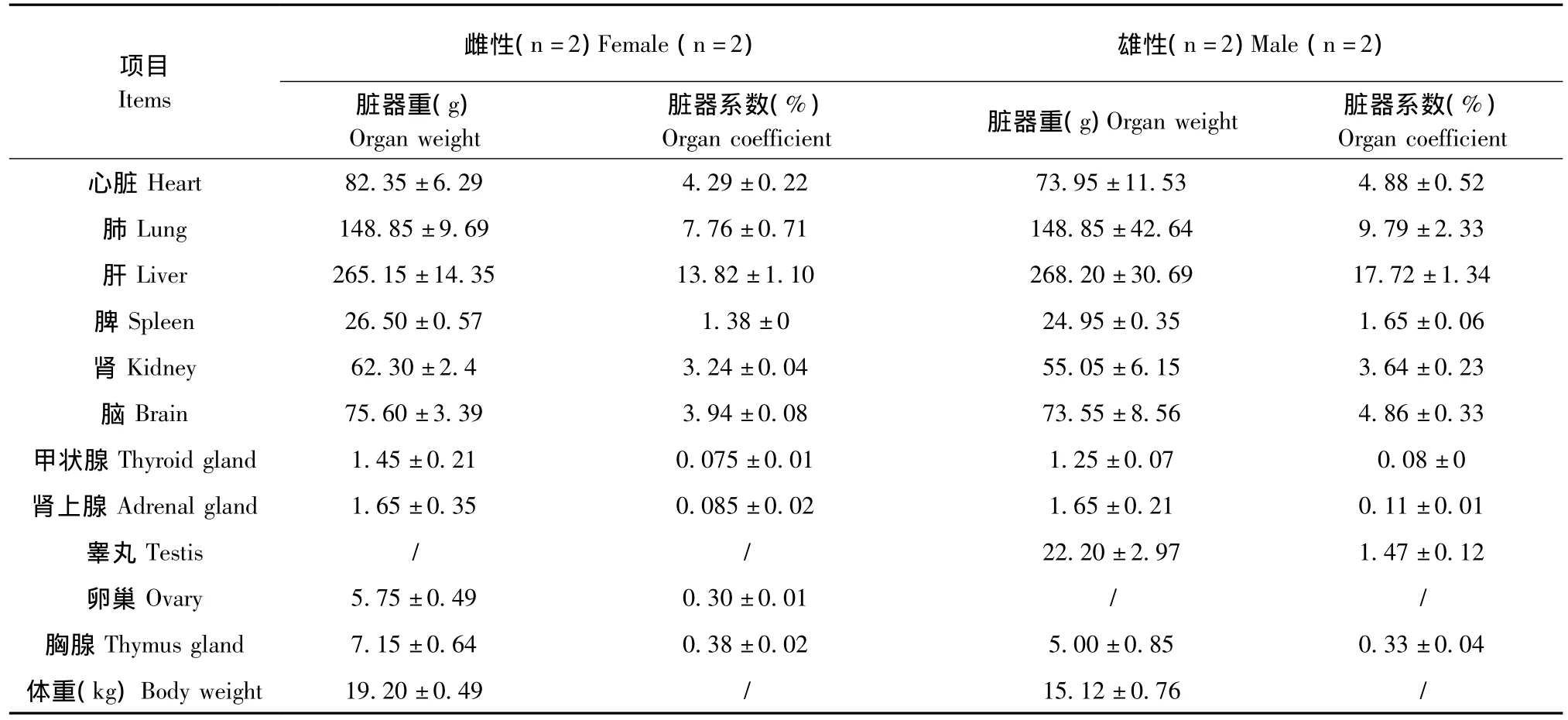
表1 融水小型猪体重、脏器重量和脏器系数的测定结果Tab.1 The body weight,organ weight and organ coefficient in Rongshui miniature pigs
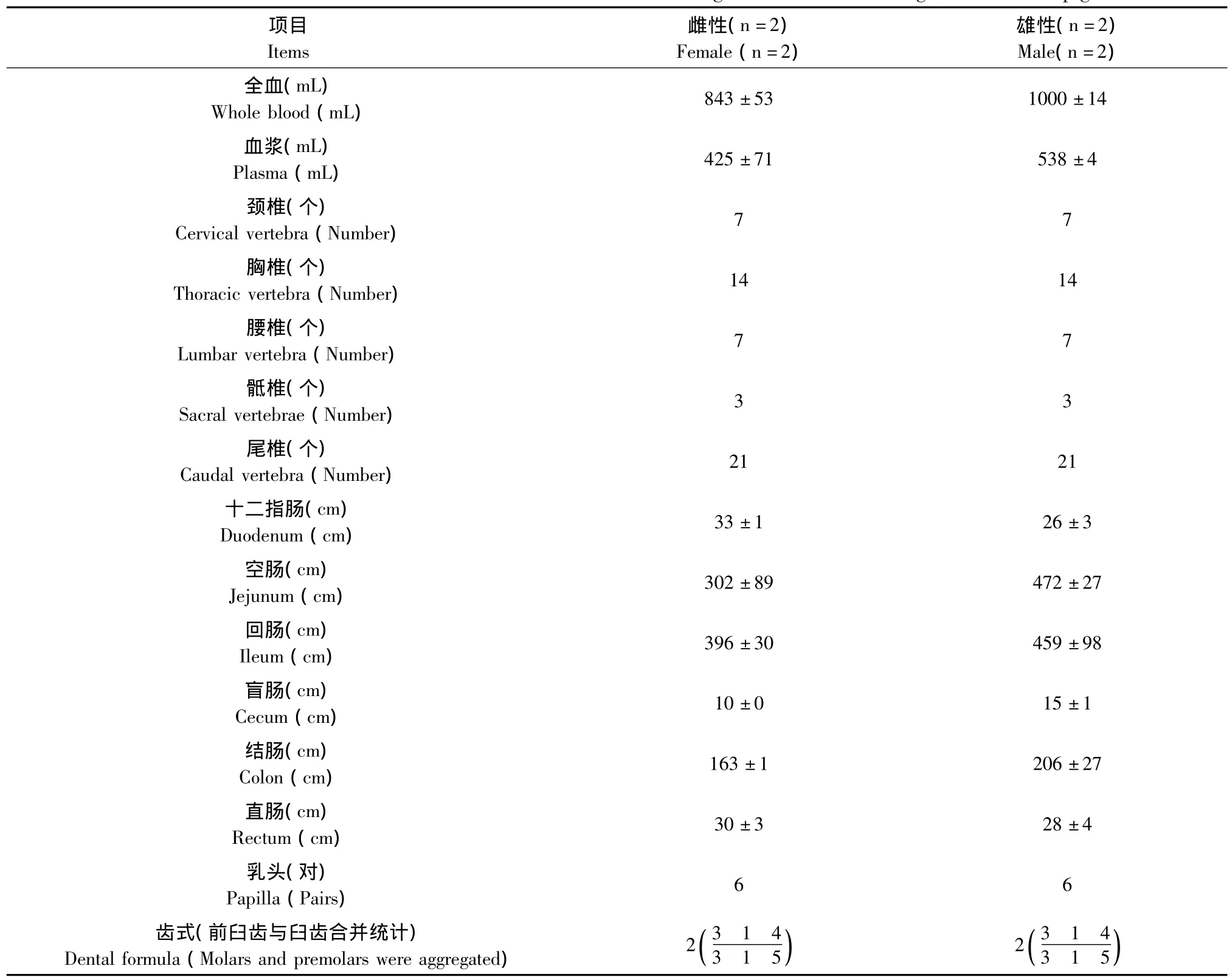
表2 融水小型猪脊椎个数、肠长度等基础数据Tab.2 The basic data such as number of vertebration and length of intestine in Rongshui miniature pigs
2.3 主要脏器观察与组织学检查
对融水小型猪脏器组织进行了脏器观察,拍照,各脏器组织外观未见明显病理异常,脏器组织(图2)。并对各组织器官进行了病理切片,各组织检查结果如下:
心脏:心肌纤维束排列整齐,未见萎缩、肥大、空泡变性、坏死,未见心肌纤维化,间质未见水肿、充血、出血及炎细胞浸润(图3-A)。
肝脏:肝小叶结构清晰,肝细胞索状排列,肝细胞未见变性、坏死,窦内皮细胞及枯否氏细胞未见增生,未见胆管增生、胆汁瘀滞、纤维化及炎细胞浸润(图3-B)。
脾脏:红、白髓结构清晰,动脉周围淋巴鞘清晰可见,中央动脉未见病变,脾小体分布、形态正常,部分生发中心清晰,脾窦未见出血(图4-A)。
肺脏:细、小支气管周淋巴细胞浸润;肺泡管及肺泡结构清晰,肺泡未见扩张、萎陷,肺泡壁毛细血管未见扩张、充血,肺泡间隔未见增厚,肺泡腔清晰,未见肺水肿和肺出血,肺泡内未见巨噬细胞聚集(图4-B)。
肾脏:皮、髓结构清晰,肾小球未见明显增大、萎缩、空泡化、玻璃样变、硬化,肾小管未见萎缩、肥大、增生、再生、空泡化、嗜碱性变、色素沉着、凝固性坏死,肾小管管腔未见扩张,未见透明管型、矿物质沉积,间质未见炎细胞浸润、纤维组织增生,肾乳头未见坏死,肾盂未见扩张积水及炎细胞浸润(图5-A)。
肾上腺:皮、髓质结构清晰,皮质球状带、束状带、网状带细胞排列及形态正常,髓质细胞形态及分布正常,各区细胞未见增生、萎缩,未见出血、坏死及炎症反应(图5-B)。
大脑:大脑皮质各层神经元、神经胶质细胞形态正常,未见萎缩、变性、坏死、增生等改变,间质未见水肿、充血、出血,未见炎症细胞浸润及血管浸润套形成。白质未见脱髓鞘,室管膜及脉络膜未见异常,未见脑室积水(图6-A)。
小脑:皮质中浦肯野细胞及各种神经元细胞形态正常,各层组织结构清晰,脑膜未见充血,蛛网膜下腔未见水肿及渗出物,小脑组织神经元未见肿胀,胞浆未见空泡形成,未见核偏位;未见神经细胞坏死、胶质细胞增生,未见软化灶形成;脑组织间质未见水肿、血管扩张充血、瘀血及炎症细胞浸润,白质未见脱髓鞘(图6-B)。
脑干:脑干各神经核团形态清晰、正常,神经元细胞较大、神经突起明显,神经核大、核仁清晰。神经纤维束分布正常。脑干内未见出血、坏死灶(图6-C)。
脊髓:白质和灰质结构完整,灰质呈H型,脊髓灰质前角运动神经元细胞形态排列正常,未见变性、坏死表现,脊髓侧角和后角神经元及中央管结构亦正常,未见神经细胞坏死及嗜神经细胞现象;未见血管扩张充血、出血;白质有髓神经纤维结构清晰、未见脱髓鞘(图7-A)。
胃:粘膜上皮完整,腺体排列整齐,未见糜烂、出血、坏死或溃疡形成。胃壁细胞及主细胞形态正常,未见萎缩、变性或坏死,未见化生或异型增生。肌层未见肥厚、萎缩或出血、坏死。浆膜未见充血、水肿及炎症细胞渗出(图8A)。
十二指肠:粘膜上皮组织部分自溶,考虑未及时固定(图8-B)。
空肠:粘膜上皮组织部分自溶,考虑未及时固定(图9-A。)
回肠:绒毛间质充血、少量炎细胞浸润(图9-C)。
结肠:粘膜层见粘膜相关淋巴组织(图9-B)。
睾丸:生精小管结构清晰,各级生精细胞形态正常,精子细胞清晰可见,支持细胞未见异常,未见曲细精管萎缩、多核巨细胞生成改变;间质细胞未见增生;间质未见水肿、充血、出血及炎症细胞浸润(图10-A)。
附睾:附睾管上皮细胞未见空泡化,管腔内可见大量精子,未见精子肉芽肿,间质未见水肿、充血、出血及炎细胞浸润(图10-B)。
前列腺:腺体松散分布,腺腔内可见分泌物,间质疏松、量少,未见腺上皮增生、间质纤维组织增生、间质充血、水肿、炎细胞浸润等病理改变(图10-C)。
子宫:子宫壁各层结构清晰,子宫内膜粘膜上皮呈单层柱状排列,粘膜下固有膜结缔组织内有子宫腺,子宫肌层和子宫外膜未见明显病理异常(图11-B)。
卵巢:各级卵泡、黄体,数量正常,未见滤泡囊肿、血肿及肿物形成(图11-A)。
胸腺:胸腺皮、髓质形态正常,分界清晰,皮质未见萎缩,皮质淋巴细胞形态及分布正常,髓质细胞形态及分布未见异常(图12-B)。
胰腺:胰腺组织结构未见异常,可见外分泌部和胰岛,胰岛细胞排列正常,外分泌部腺泡上皮细胞未见细胞萎缩、变性、坏死,未见炎细胞浸润(图14-B)。
淋巴结:皮质区淋巴小结形态正常,帽区、明区和暗区清晰可见,副皮质区淋巴细胞形态及分布正常,髓窦及被膜下淋巴窦形态未见异常(图13-B)。
甲状腺:甲状腺组织结构未见异常,甲状腺滤泡结构正常,滤泡上皮细胞未见变性、坏死,滤泡旁细胞未见增生,未见炎症细胞浸润(图12-A)。
膀胱:粘膜(变移上皮)由三层至数层移行上皮细胞组成,结构完整,上皮细胞未见变性、坏死、脱落,固有膜内胶原纤维、弹力纤维未见变性、增生等改变,肌层内平滑肌纤维形态排列正常,各层组织中未见炎细胞浸润(图13-B)。
胆囊:粘膜固有层见炎细胞浸润(图14-A)。
皮肤:表皮结构完整,真皮层的胶原纤维、皮肤附件结构清晰,未见坏死、水肿、充血、出血及炎细胞浸润(图15-A)。
肌肉:肌浆红染,横纹清晰,细胞核位于肌纤维周边部。未见肌纤维凝固性坏死,间质水肿、充血、出血及炎细胞浸润(图15-B)。
坐骨神经:神经纤维平行排列,未见神经纤维变性及脱髓鞘(图7-B)。
3 讨论
本研究对融水小型猪的29个器官进行外观和组织切片观察及拍照,保存了大体解剖和组织学的资料,充实了融水小型猪的生物学数据。各脏器组织外观未见明显病理异常,仅肺颜色有点暗红;组织学检查中发现,肺脏细小支气管周淋巴细胞浸润,其他器官均为正常,未发现病理性变化。
将融水小型猪的组织切片结果与《西藏小型猪组织胚胎学研究》[3]和《贵州小型猪组织学图谱》[4]进行比对,骨骼肌横断面组织切片的比较中,融水小型猪的骨骼肌肌束之间结缔组织和肌间脂肪比西藏小型猪与贵州小型猪少,骨骼肌更致密,这与大体解剖观察到的一致。
猪淋巴结的组织结构并不完全与人类的相同,皮质和髓质可以分别出现于外周区域和中央区域,西藏小型猪淋巴结皮质和髓质交替存在[3]。但贵州小型猪的髓质成分分布在外周,皮质则位于淋巴结的中央部分[4]。从融水小型猪淋巴结组织切片来看,其皮质区同样可以出现在外周区域,而髓质分布于中央区域,说明融水小型猪与西藏小型猪在淋巴结结构上与人更加接近。
实验动物的自发性病变存在于普通级、SPF级动物,如大鼠、比格犬、食蟹猴、树鼩等都有相关报导[5-10]。引起自发性病变的因素很多,如遗传、营养、用药、中毒及环境因素等,也包括原因未明的传染因子[8]。有的还与年龄增长相关[11-12]。徐永华等[13]的研究认为,人类和其他动物在支气管、小支气管周围有不同程度炎细胞浸润,而且肺内尘细胞较多,是与生存环境空气受污染有关。西藏小型猪由于长期生存在很少受污染的高原寒冷环境,呼吸系统是清洁的。同样地,由于融水小型猪在普通级环境下饲养,而呼吸系统各器官属于管腔器官,容易与空气中物理性、化学性物质如粉尘、氨气等接触,刺激引起小支气管、细支气管的病理变化。另外,小支气管、细支气管黏膜细胞浸润,存在病原体影响的可能性。在融水小型猪的肺脏组织切片中,只发现小支气管、细支气管周围淋巴细胞浸润,肺内未发现尘细胞,其他结构未发现病理性变化,这也说明了饲养环境中的刺激因素比较小,或者病原体对肺脏的影响较小。
本研究使用的融水小型猪总体健康状况良好,其组织器官外观正常,组织切片检查基本正常,可以作为融水小型猪病理性检查的正常组织切片参考依据。同时,从本次研究的结果也可以从侧面反映出,在融水小型猪饲养管理过程中,较好的控制了环境、饲料和微生物等环节。融水小型猪在医学实验相关方面是一种具有潜力的实验动物。由于实验动物的自发性病变会影响动物质量和干扰动物实验结果,提示在融水小型猪的整个饲养管理过程中,必须严格执行各方面质量控制体系,尽量减少外部诱因对融水小型猪自发性病变的影响。
[1] 张德福,刘东.国内外小型猪实验动物化研究[J].生物学通报,2004,39(10):14 -16.
[2] 闵凡贵,潘金春,王希龙,等.影响五指山小型猪主要脏器重量及脏器系数的因素分析[J].中国畜牧兽医,2012,39(10):218-222.
[3] 那顺巴雅尔.西藏小型猪组织胚胎学研究[D].广州:南方医科大学,2009.
[4] 甘世祥,钱宁,冯济凤,等.贵州小型猪组织学图谱[M].贵州:贵州科技出版社,2001.
[5] 乔俊文,陆妲磊,孙景军,等.药物临床前安全性评价中食蟹猴常见自发性病变[J].中国药理与毒理学杂志,2013,27(3):548.
[6] 徐文漭,李霞,李涛,等.恒河猴、比格犬、树鼩、兔、大鼠及小鼠消化管的比较组织学[J].临床与实验病理学杂志,2013,29(11):1211-1217.
[7] 苏晓鸥,戴益民,弓雪莲,等.毒性试验中SD大鼠常见自发性病变[J].中国药理学与毒理学杂志,2013,27(3):518.
[8] 王辉,陆妲磊,盛嬅,等.SPF级F344大鼠的脏器重量和自发性病变的研究[J].毒理学杂志,2007,21(4):291 -292.
[9] 罗灼玲,张立群,李文,等.实验动物比格(Beagle)犬自发性病变的研究[J].广州中医药大学学报,1999,16(2):151-154.
[10] 程树军,黄韧,秦瑶.比格犬肝脏自发性病变的组织学研究[J].上海实验动物科学,2003,23(4):200 -202.
[11] 徐艳峰,马春梅,黄澜,等.Wistar大鼠心脏自发性病变的病理学观察[J].中国比较医学杂志,2012,22(2):6 -8.
[12] 胡建延,英永,邱波,等.不同周龄SPF级SD大鼠胰腺自发性病变的组织学观察[J].2012,33(8):65-68.
[13] 徐永华,张东辉,许琴,等.西藏小型猪心脏、呼吸系统组织学观察[J].中国比较医学杂志,2009,19(8):61 -62.

