流式细胞仪筛选环磷酰胺诱导骨髓嗜多染红细胞微核的技术方法
刘仕杰,方展强
(华南师范大学生命科学学院,广东省高等学校生态与环境科学重点实验室,广州 510631)
微核实验作为一种检测遗传毒物的短期测试法,已在细胞遗传学中得到广泛应用。但长期以来,微核检测一直是由人工完成。由于微核在骨髓细胞以及外周血细胞中含量极少,一般要求计数数千个细胞,才能得到一个比较准确的微核率,这样导致人工阅片工作量太大且敏感性较低,并能导致一些样本的漏检或出现一些假阳性。80年代,Hutter和Stohr[1]最先应用流式细胞仪检测了小鼠外周血中的红细胞微核率。流式细胞仪在短时间内能检测大量的嗜多染红细胞(polychromatic erythrocytes,PCE),与传统的人工显微镜计数法相比,将其用于微核实验,可使检测更加快速、简单,结果更加客观可靠[2-3]。本实验利用环磷酰胺腹腔注射小鼠和大鼠,染毒24 h后取骨髓细胞,经过吖啶橙(acridine orange,AO)荧光染色,采用单激光流式细胞仪检测骨髓细胞的含微核的嗜多染红细胞(micronucleated PCE,MNPCE)和含微核的成熟红细胞(micronucleated NCE,MNNCE),比较两者的量效关系,力图建立一种基于单激光流式细胞仪的微核自动化检测方法,初筛化合物诱导微核作用的毒性。
1 材料和方法
1.1 实验动物
SPF级雄性KM小鼠16只,体重18~22 g,1.5月龄;SPF级雄性SD大鼠16只,体重150~250 g,1.5月龄。均购于南方医科大学实验动物中心【SCXK粤2006-0015】。小鼠和大鼠的组织取材于南方医科大学实验动物科学部动物实验设施内进行【SYXK粤2006-0015】。实验小鼠和大鼠分别称重,编号,随机分为4组,每组4只动物。实验动物的使用及实验过程“参照实验动物使用的3R原则进行”[4]。
1.2 主要试剂及配置方法
环磷酰胺(cyclophosphamide,CP);吖啶橙(acriding organe,AO)(北京索莱宝科技有限公司);TritonX-100(美国Sigma公司);固定液:含 SDS 30 μg/mL,1%(v/v)戊二醛的 Sorensen’s缓冲液(0.05 mol/L,pH6.8);溶液 A:0.1 mL Triton X-100+8 mL 1.0 mol/L HCl+0.877g NaCl,加蒸馏水至100 mL;溶液B:37 mL 0.1 mol/L无水柠檬酸 +63 mL 0.2 mol/L磷酸氢二钠 +0.877 g NaCl+34 mg EDTA-Na2+0.6 mL 1mg/mL AO水溶液;0.067 mol/L,pH7.2 Sorensen’s缓冲液。
1.3 主要仪器
离心机、流式细胞仪、荧光显微镜。
1.4 药物处理
环磷酰胺用生理盐水配制。设置4个剂量组:0、10、20 及 40 mg/kg。注射体积为 0.25 mL/100g体重。单次腹腔注射。给药后24 h后取样。
1.5 骨髓悬液的制备
小鼠骨髓悬液的制备:断颈处死小鼠,分离双侧股骨,用1 mL注射器吸取400 μL小牛血清将骨髓冲出,反复吹打过滤制成悬液。大鼠骨髓悬液的制备:断颈处死大鼠,分离双侧股骨,用1 mL注射器吸取400 μL小牛血清将骨髓冲出,反复吹打过滤制成悬液。
1.6 细胞固定与染色
取5 mL固定液,一边剧烈振荡,一边加入200 μL 细胞悬液,固定5 min,1650 r/min离心5 min,去上清,细胞沉淀重新混悬于0.2 mL 0.067 mol/L,pH7.2 Sorensen’s缓冲液中。溶液A与溶液B在使用前置于冰上暗处,加入400 μL溶液A与1.2 mL溶液B,轻轻混匀,细胞于冰上暗处染色30 min。1650 r/min离心5 min,去上清,细胞沉淀重新混悬于 0.5 mL 0.067 mol/L,pH7.2 Sorensen’s缓冲液中。
1.7 流式细胞仪分析
仪器设置的参数包括:前置角散射光(forward angle scatte,FSC),刻度设置为线性;DNA荧光(FL1,525 nm),刻度设置为对数。分析速度为大约1000个细胞/秒。每个样本检测不少于200,000个细胞。采用流式细胞仪分析软件 WinMDI进行分析。
1.8 人工显微镜检测
同时采用显微镜进行人工镜检。
2 结果
2.1 流式细胞仪检测对小鼠骨髓各细胞群的区分效果
联合使用前置角散射光(forward angle scatter,FSC)和DNA荧光(DNA fluorescence,FL1)作图,可以明显地区分小鼠骨髓样本中5个细胞群的分布区域:嗜多染红细胞(polychromatic erythrocytes,PCE)(R1),含微核的嗜多染红细胞(micronucleated polychromatic erythrocytes,MNPCE)(R2),成熟红细胞(mormochromatic erythrocytes,NCE)(R3),含微核的成熟红细胞(micronucleated normochromatic erythrocytes,MNNCE)(R4)和有核细胞(nucleated cells,NC)(R5)(图1A~D)。图1所示,有核细胞和红细胞区分界清楚,嗜多染红细胞和成熟红细胞分界也较为清楚,含微核的红细胞和不含微核的红细胞分界虽有一定形态,但不是特别明显,一方面流式细胞仪的分界本来就带有一定主观性,另一方面也提示我们是否可以改进试验方法,使图形更为明了。
2.2 不同剂量环磷酰胺染毒对小鼠24 h后的影响
彩插8图1A~D显示0,10,20和40 mg/kg不同剂量环磷酰胺(cyclophosphamide,CP)处理24 h后,小鼠骨髓样本各细胞群的分布及流式细胞仪检测的结果。经吖啶橙(acriding organe,AO)染色后,细胞形态完好,嗜多染红细胞发出桔红色荧光,所含微核为圆形,发出黄绿色荧光,易于分辨;成熟红细胞无荧光,显示为暗影。可见,在488 nm激发光下,AO荧光和DNA结合,发出黄绿色荧光,通过FL1通道检测,以FL1为纵轴,有核细胞DNA含量最多,在最上方,嗜多染红细胞其次,在纵轴的中间,成熟红细胞在最下方;因CP毒性作用阻碍了DNA合成,导致细胞生长不平衡。而RNA的复制不受影响,因此,细胞分裂的延迟导致胞浆成分,尤其是血红蛋白的生成增加,从而使含微核的细胞较正常细胞略大[5],前置散射光FSC作为横轴,指示了细胞的大小,含微核的细胞较大在横轴的右边,不含微核的细胞其左边。图1所示,有核细胞的DNA荧光强度最强,其细胞大小跨度也最大,而嗜多染红细胞的DNA光强度则界于有核细胞与成熟红细胞之间。镜检结果发现,含有微核的红细胞比正常红细胞要略大些,在二维等高图上位于相应正常红细胞的右侧;与对照组(彩插8图1A)相比,经不同浓度CP处理后的各试验组(彩插8图1B~D)中,含微核的嗜多染红细胞以及含微核的成熟红细胞所在区域的细胞密度都有不同程度的增加。
根据分界进行窗口GATE设置,利用WinMDI软件计算各细胞群的比例,结果如表1所示,随着CP浓度的增高,含微核的嗜多染红细胞也逐步增多,在CP到达40 mg/kg的时候,出现了细胞抑制(PCE/NCE<1)。经不同剂量CP处理24 h后,流式细胞仪检测的小鼠骨髓样本fMNPCE与fMNNCE随着处理剂量由0 mg/kg增至40 mg/kg,fMNPCE平均值由5.79‰增至20.19‰,而fMNNCE平均值则由2.62‰增至3.36‰。图2显示了含微核的嗜多染红细胞随着CP浓度增高而增多,一元回归方程显示量效存在的关系(R=0.917)。
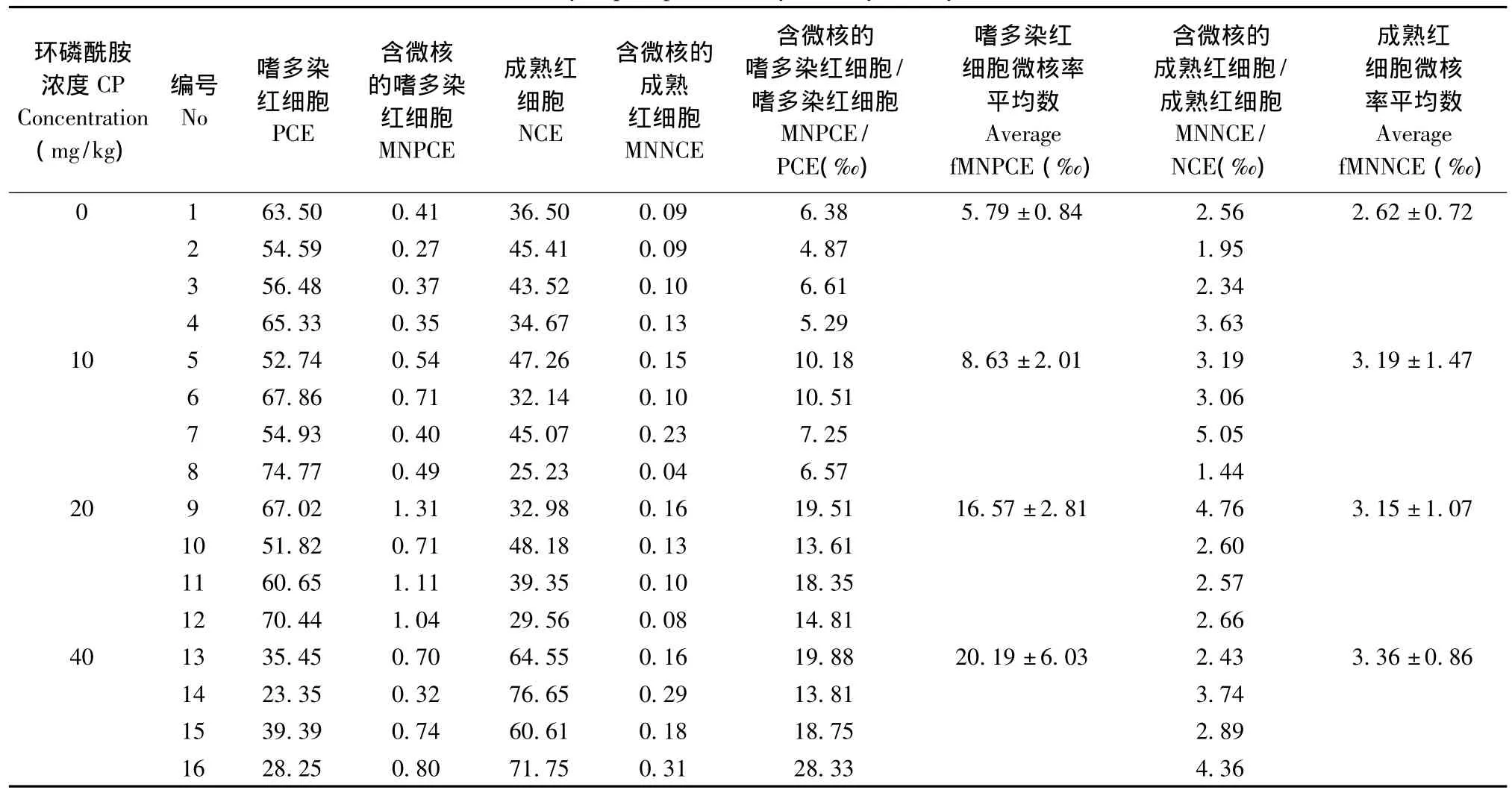
表1 环磷酰胺处理24 h后流式细胞仪检测KM小鼠的骨髓fMNPCE与fMNNCE(‰)Tab.1 The fMNPCE and fMNNCE(‰)of KM mice bone marrow collected 24h after injection of cyclophosphamide by flow cytometry
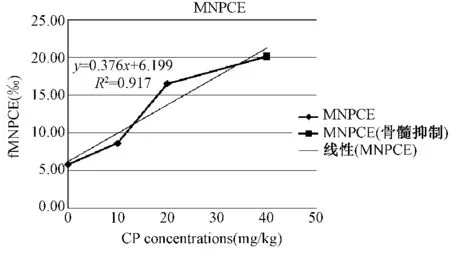
图2 环磷酰胺处理KM小鼠24 h后fMNPCE和环磷酰胺浓度的量效关系Fig.2 Dose-effect relationship of Cyclophosphamide(CP)concentrations and fMNPCE in KM mice exposed to CP after 24 h
2.3 流式细胞仪检测对大鼠骨髓各细胞群的区分效果
与2.1相同,联合使用FSC和FL1作图,也可以明显地区分大鼠骨髓样本中5个细胞群的分布区域:嗜多染红细胞(PCE)(R1),含微核的嗜多染红细胞(MNPCE)(R2),成熟红细胞(NCE)(R3),含微核的成熟红细胞(MNNCE)(R4)和有核细胞(NC)(R5)(图3 A~D)。彩插9图3所示,有核细胞和红细胞区分界清楚,嗜多染红细胞和成熟红细胞分界也较为清楚,含微核的红细胞和不含微核的红细胞分界虽有一定形态,但不是特别明显。
2.4 不同剂量环磷酰胺染毒对大鼠24h后的影响
图3A~D显示使用0~40 mg/kg CP剂量处理24 h后,大鼠骨髓样本各细胞群的分布及流式细胞仪检测的结果。经AO染色后,细胞形态完好,嗜多染红细胞发出桔红色荧光,所含微核为圆形,发出黄绿色荧光;成熟红细胞无荧光,显示为暗影。在488 nm激发光下,AO荧光和DNA结合,发出黄绿色荧光,通过FL1通道检测,以FL1为纵轴,有核细胞在最上方,嗜多染红细胞在纵轴的中间,成熟红细胞在最下方;前置散射光FSC作为横轴,指示了细胞的大小,含微核的细胞较大在横轴的右边,不含微核的细胞其左边。彩插9图3所示,有核细胞的DNA荧光强度最强,其细胞大小跨度也最大,而嗜多染红细胞的DNA光强度则界于有核细胞与成熟红细胞之间。镜检结果发现,含有微核的红细胞比正常红细胞要略大些,在二维等高图上位于相应正常红细胞的右侧;与对照组(图3A)相比,经5~40 mg/kg不同浓度CP处理后的各试验组(图3B~D)中,含微核的嗜多染红细胞以及含微核的成熟红细胞所在区域的细胞密度都有不同程度的增加。
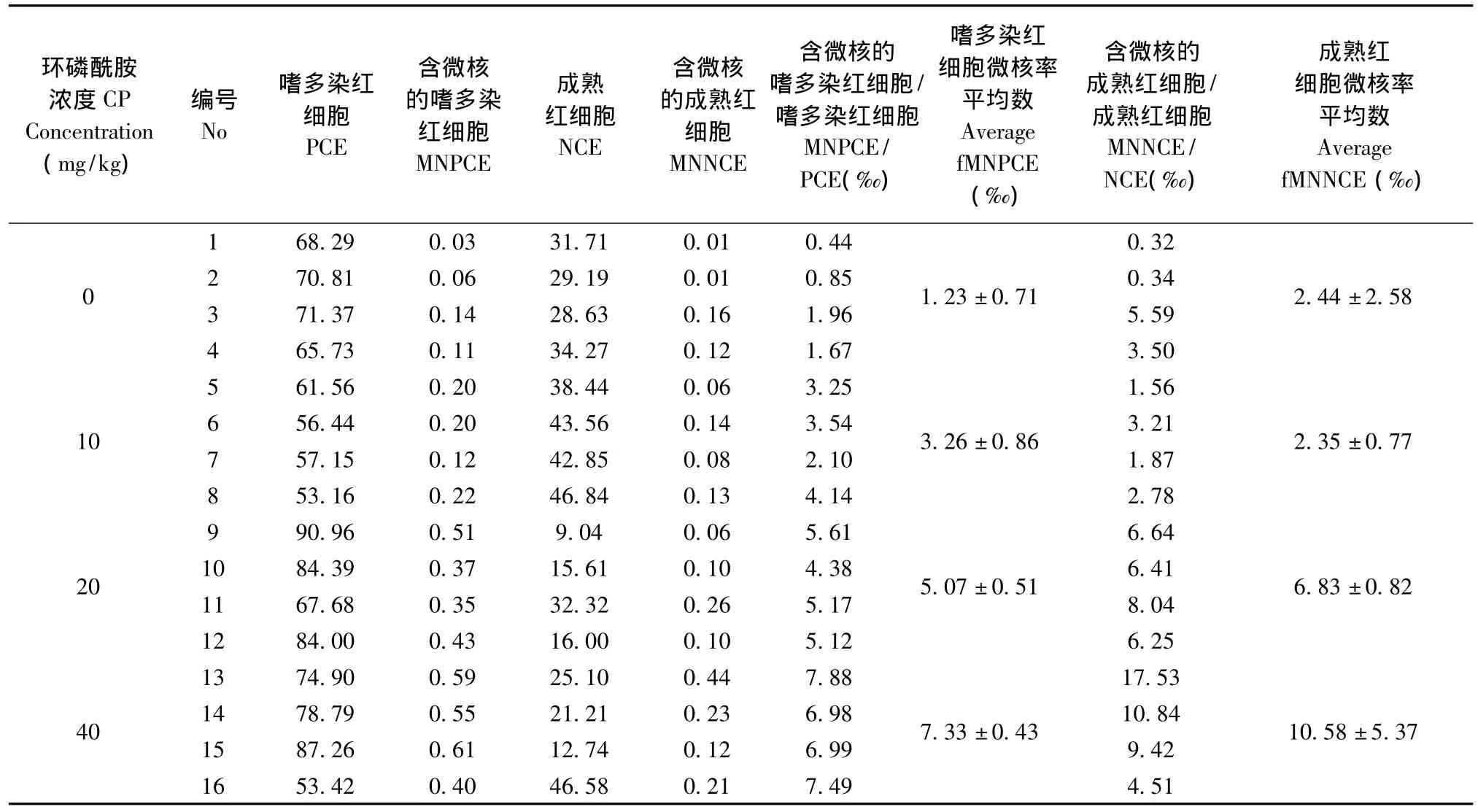
表2 环磷酰胺处理24 h后流式细胞仪检测SD大鼠的骨髓fMNPCE与fMNNCE(‰)Tab.2 The fMNPCE and fMNNCE(‰)of SD rat bone marrow collected 24 h after injection of cyclophosphamide by flow cytometry
根据分界进行窗口GATE设置,利用WinMDI软件计算各细胞群的比例,结果如表2所示,随着CP浓度的增高,含微核的嗜多染红细胞也逐步增多,在CP到达40 mg/kg的时候,出现了细胞抑制(PCE/NCE<1)。经不同剂量CP处理24 h后,流式细胞仪检测的大鼠骨髓样本fMNPCE与fMNNCE随着处理剂量由0 mg/kg增至40 mg/kg,fMNPCE平均值由1.23‰增至7.33‰,而fMNNCE平均值则由2.44‰增至10.58‰。图4显示了含微核的嗜多染红细胞随着CP浓度增高而增高,明显存在量效关系(R=0.977)。
图4显示了MNPCE随着CP浓度增高而增多的量效关系,而且一元回归方程显示量效的存在一定的关系,这有待进一步研究。
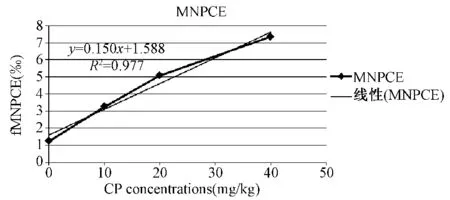
图4 环磷酰胺(CP)染毒SD大鼠24 h后fMNPCE和CP浓度的量效关系Fig.4 Dose-effect relationship of Cyclophosphamide(CP)concentrations and fMNPCE in SD rat exposed to CP after 24 h
3 讨论
Hutter和Stohr[1]利用单激光流式细胞仪成功地检测了小骨髓红细胞微核,但这一方法尚不能区分嗜多染红细胞(PCE)和成熟红细胞(NCE)。Grawe等[6]则用噻唑橙染 RNA,Hoechst 33342染 DNA,成功地用双激光流式仪将去除有核细胞后的小鼠外周血区分为4个细胞群:嗜多染红细胞(PCE),含微核的嗜多染红细胞(MNPCE),成熟红细胞(NCE)以及含微核的成熟红细胞(MNNCE)。Cao等[7-8]随后发展了该技术,使小鼠外周血嗜多染红细胞微核流式仪自动化检测技术达到实用化水平。孙立平等[3]又进一步建立了吖啶橙AO染色结合单激光流式细胞仪的大鼠骨髓嗜多染红细胞微核率自动化检测的方法,由于操作更为简单,应用更为普及,使其较基于双激光流式细胞仪的微核自动化检测方法具有更为广阔的应用前景。
吖啶橙(AO)是一种异染性荧光染料,它对DNA和RNA均有很强的亲和力。当AO以插入方式与双链核酸结合后,经488 nm激发,530 nm处发黄绿色荧光,指示DNA;当与单链核酸结合后,640 nm处发橘红色荧光,指示 RNA。应用乙二胺四乙酸(EDTA)能选择性变性RNA,从而保证双链RNA不会干扰DNA。酸性条件能够促进核蛋白从DNA解离,从而使AO更加容易与DNA结合,进一步提升AO染 DNA 的能力[9-10]。理论上,可利用 FL1(黄绿色荧光,指示 DNA)或者 FL4(红色荧光,指示RNA)区分嗜多染红细胞(PCE)与成熟红细胞(NCE),然而,本实验中发现,FL4根本不能区分PCE与NCE,而用FL1则能很好地对其区分,但FL1不能区分含微核的细胞和不含微核的细胞,如果利用FL1并结合 FSC(指示细胞大小),则能区分PCE、含微核的嗜多染红细胞(MNPCE)、NCE、含微核的成熟红细胞(MNNCE)以及有核细胞(nucleated cell)。我们认为,可能因为PCE含有较多的残留细胞器—核糖体及线粒体,而RNA含量极少,所以利用FL4反而不能区分PCE和NCE,而利用FL1则更为合适区分 PCE和 NCE,同时,也正因为线粒体DNA干扰了FL1对含微核的细胞与不含微核的细胞的区分。
环磷酰胺(CP)是经典染色体断裂剂,在微核实验中经常被用作阳性对照试剂。在本实验中,无论是CP诱导的小鼠骨髓fMNPCE还是大鼠骨髓fMNPCE都呈现良好的剂量-效应关系,其中CP诱导小鼠骨髓MNPCE在高浓度组(40 mg/kg)出现了骨髓抑制(PCE/NCE<1)。正常情况下,红血球的有丝分裂是一个同步化过程,从骨髓有规律地释放大小均一的红细胞进入外周血。微核,在血液学中又被称为 Howell-Jolly小体,常见于巨幼细胞贫血[11]。可见,一般含有微核的红细胞体积都较平常细胞大,这是因为CP毒性作用阻碍了DNA合成,导致细胞生长不平衡。由于RNA的复制不受影响,因此,细胞分裂的延迟导致胞浆成分,尤其是血红蛋白的生成增加。从而使含微核的细胞较正常细胞略大[5]。本实验正是利用这个特点,采用前置散射光FSC为横坐标,标示细胞的大小,以区分含微核和不含微核的红细胞,这同时要求我们寻找良好的细胞固定方法,以保证红细胞的形态稳定。长期以来,应用流式细胞仪检测微核往往包括较长时间的细胞固定,导致细胞发生萎缩,以至细胞间大小的这种细微改变不能被检出。本文参考了胡冰冰的实验研究[12],确定固定细胞的优化条件为:戊二醛pH4.0~5.0;缓冲液为0.06 mol/L,pH7.2的索伦森缓冲液,并加入30 ug/mL SDS以防止红细胞聚集成团。该实验仅对细胞进行5 min固定,固定后的细胞形态非常规则,有利于流式细胞仪检出细胞间在大小上的细微区别。
关于利用流式细胞仪自动化检测外周血红细胞MNPCE 的方法,Dertinger[13]提出利用CD71-FITC 标记PCE的方法,并称此方法简单可信。他们采用-70℃至-90℃的甲醇固定红细胞,再用重碳酸盐缓冲液冲洗,细胞可以在4℃环境中保存至少1个星期。在染色上,因为PCE细胞膜表面上都有CD71受体(转铁蛋白),他们采用CD71-FITC标记PCE,再经核糖核酸酶处理细胞,消化RNA后,加入PI荧光试剂,标记微核,利用单激光流式细胞仪在488 nm激发光,2500个细胞/秒速度检测,很清楚将红细胞区分为PCE,MNPCE,NCE和MNNCE 4个群。他们同时利用AO荧光染色,在显微镜下进行手工计数以作比较,发现两种方法数值相近,统计学上没有显著差异,流式细胞仪因为可以计数整个样本的细胞数,结果更为灵敏,而且重复试验比较,流式细胞仪自动化方法比手工计数方法变异性更小。
骨髓细胞相对于外周血细胞有其特殊性,骨髓悬浮液含有数量更大的有核细胞和相当量的细胞碎片,这些都会干扰MN的正确计数,传统的方法是利用Percoll离心或者纤维素柱分馏除去有核细胞、凋亡细胞或者细胞碎片[14-16],即使这样,运用流式细胞仪自动化检测MNPCE还需加入更多条件来补偿实验方法的缺陷才得以更加准确计数MNPCE[15]。Dertinger[17]使用和检测小鼠外周血同样的方法对小鼠骨髓细胞进行检测分析,验证此方法是否能够同样简单有效地分析小鼠骨髓MNPCE。他们对实验进行了2处略微地调整:1)延长RNase处理细胞时间,2)增加PI的浓度。结果表明,实验能很好地将红细胞分开 PCE,MNPCE,NCE,MNNCE 4个群,和AO染色的手工计数比较,具有很高的直线相关性(r=0.954),他们得出流式细胞仪自动化检测MNPCE起码具有3个方面的优势:1)处理样本比较容易,不需要特殊纯化过程,2)分析效率高,可以达到8000 cells/s,1个样本,流式细胞仪只需数小时分析,而手工方法需要1天时间,3)提高灵敏度,每个样本可计数成千上万个PCE,而不是手工方法只计数 1000~2000个 PCE。Dertinger[18]并利用单激光流式细胞仪成功检测了人外周血的MNPCE。
Criswell[5]利用更简单的吖啶橙(AO)荧光染色,单激光流式细胞仪成功检测了大鼠骨髓的MNPCE。AO是一种异染性荧光染料,它对DNA和RNA均有很强的亲和力。当AO以插入方式与双链核酸结合后,经488 nm激发,530 nm处发黄绿色荧光,指示DNA;当与单链核酸结合后,640nm处发橘红色荧光,指示RNA。环磷酰胺(CP)是经典染色体断裂剂,CP毒性作用阻碍了DNA合成,导致细胞生长不平衡。由于RNA的复制不受影响,因此,细胞分裂的延迟导致胞浆成分,尤其是血红蛋白的生成增加。从而使含微核的细胞较正常细胞略大。实验采用了加入SDS和戊二醛的索伦式缓冲液固定细胞,固定时间仅5 min,而且保全了红细胞的完整形态,固定后的细胞经AO染色后,单激光流式细胞仪的FL1通道(绿光,指示DNA)区分PCE和NCE,利用FSC(指示细胞大小)区分含微核和不含微核的红细胞,成功检测了大鼠骨髓的MNPCE,结果和赖特吉姆萨染色手工计数相比,线性关系良好,没有统计学上的差别。另外,他们同时还检测了脾脏血的MNPCE发现,尽管用本实验的方法检测大鼠脾脏血的MNPCE有良好的量效和关系,但是MNPCE的本底数较手工计数要明显增高,建议还是采用骨髓检测。
为了能快速而简单初筛化合物诱导微核的作用,本实验采用了AO染色的单激光流式细胞仪方法检测微核,实验证明,此方法速度较快,仅用一种染料染色,不需要任何抗体标记,细胞固定时间5 min即可;实验灵敏度高,用很简单的单激光流式细胞仪对整个样本进行细胞技术。但是,实验也存在不稳定性,部分个体的MNPCE变化较大,甚至导致实验组的标准差很高,这一方面说明体内实验的变异性较大,更能反应个体差异,另外也提示应用流式细胞仪界定细胞群的阈值是带有一定主观性,细胞群分界不一定十分明显。这也提示我们实验方法还存在一定的缺陷,从其他学者的实验来分析,是否应该使用虐原虫感染的红细胞做标准[19],是否在固定液和染色方法上能进一步改善以使结果更为稳定。总之,通过本实验可为进一步研究快速自动化检测化合物诱导微核作用的研究提供参考。
[1] Hutter KJ,Stohr M.Rapid detection of mutagen induced micronucleated erythrocytes by flow cytometry[J].Histochemistry,1982,75:353-362.
[2] Abramsson-Zetterberg L,Zetterberg G,Bergqvist M,et al.Human cytogenetic biomonitoring using flow-cytometric analysis of micronuclei in transferrin-positive immature peripheral blood reticulocytes[J].Environ Mol Mutagen,2000;36(1):22-31.
[3] 孙立平,李德志,刘志谋,等.人外周血网织红细胞的流式细胞仪自动化检测[J].癌变.畸变.突变,2004,16(3):159-162.
[4] 贺争鸣,李冠民,邢瑞昌.3R理论的形成、发展及在生命科学研究中的应用[J].实验动物科学与管理,2000,17(3):43-47.
[5] Criswell KA,Krishna G,Zielinski D,et al.Use of acridine orange in:flow cytometric assessment of micronuclei induction[J].Mutat Res,1998,414:63 -75.
[6] Grawe J,Zetterberg G,Amneus H,et al.Flow_cytometric enumeration of micronucleated polychromatic erythrocytes in mouse peripheral blood[J].Cytometry,1992,13:750 -758.
[7] Cao J,Beisker W,Nusse M,et al.Flow cytometric detection of micronuclei induced by chemicals in poly_and normochromatic erythrocytes of mouse peripheral blood[J].Mutagenesis,1993,8:533-541.
[8] 曹佳,Nusse M,Beisker W,等.流式细胞术对小鼠外周血红细胞微核自动化检测的研究[J].癌变·畸变·突变,1994,6(6):11-17.
[9] Darzynkiewicz Z,Traganos F,Sharpless T,et al.Conformation of RNA in situ as studied by acridine orange staining and automated cytofluorometry[J].Exp Cell Res,1975,95(1):143-153.
[10] Darzynkiewicz Z,Traganos F,Sharpless T,et al.Lymphocyte stimulation,a rapid multiparameter analysis[J].Proc Natl Acad Sci,1976,73(8):2881 -2884.
[11] Hoagland HC,Gastineau DA.Hematologic complications of cancer chemotherapy[D],in:M.C.Perry(Ed.),The Chemotherapy Source Book.Williams & Wilkins,Baltimore,MD,1992,pp.559-569.
[12] 胡冰冰,杨录军,周燕虹,等.小鼠骨髓嗜多染红细胞微核单激光流式细胞仪自动化检测[J].癌变.畸变.突变,2006,18(1):19-22.
[13] Dertinger SD,Dorothea K Torous,Kenneth Tometsko R.Simple and reliable enumeration of micronucleated reticulocytes with a single-laser flow cytometer[J].Mutat Res,1996,371:283-292.
[14] Romagna F, Staniforth CD. Theautomated bonemarrow micronucleus test[J].Mutation Res,1989,213:91 -104.
[15] Grawe J,Zetterberg G,Amneus H.Effects of extended low-doserate exposure to 137Cs detected by flowcytometric enumeration of micronucleated erythrocytes in mouse peripheral blood[J].Int J Radiat Biol,1993,63:339 -347.
[16] Krishna GD, UrdaBG, McKeelM, etal. Comparative micronucleus quantitation in pre-and post-column fractionated mouse bone marrow by manual and flow methods[J].Mutation Res,1993,302:119-127.
[17] Dertinger SD.Dorothea K,Torous NE,et al.Flow cytometric analysis of micronucleated reticulocytes in mouse bone marrow[J].Mutat Res,1997,390:257 -262.
[18] Dertinger SD, Dorothea K Torous, Nikki E Hall, et al.Enumeration of micronucleated CD71-positive human reticulocytes with a single-laser flow cytometer[J].Mutat Res,2002,515:3-14.
[19] Tometsko A,Torous D,Dertinger S.Analysis of micronucleated cells by flow cytometry:1.Achieving high resolution with a malaria model[J].Mutat Res,1993,292:129 -135.

