模式生物线虫在药物复杂体系活性评价中的应用
王欣佩,余 煊,雷 帆,邢东明,杜力军
(清华大学蛋白质科学教育部重点实验室,生命科学学院医学院药物药理实验室,北京 100084)
秀丽隐杆状线虫,Caenorhabditis elegans(C.elegans),属于线形动物门、线虫纲。线虫广泛的分布在土壤中,以细菌为食,能够感知气味、光线、温度以及机械刺激。早在20世纪60年代初期,科学家Sdyney Brenner就将线虫(C.elegans)引入到发育生物学和神经生物学的研究中[1]。随后,在90年代中期,科学家 John E.Sulston[2-4]利用微分干涉显微镜(DIC)绘制线虫的细胞谱系,揭示了雌雄同体线虫全部细胞的命运,促进线虫在单细胞水平上的深入研究。1998 年,Craig Mello 和 Andrew Fire[5]在线虫上发现了dsRNA介导的RNA干扰(RNAi)现象,为线虫基因功能的研究奠定了重要基础。1998年底,线虫的全基因组序列在Science上发表,线虫成为了第一个完成全基因组测序的多细胞真核生物[6]。目前,线虫作为模式生物,已经被广泛用于多个领域的生物学研究,包括遗传学、发育生物学、神经生物学、细胞生物学、衰老调控机制、性别决定、药物作用等[7]。本文从药物作用角度讨论了线虫作为模式生物特点,以及利用线虫作为模式生物在药物研究方面的应用。
1 线虫的构成特点
线虫是一类多细胞生物,其幼虫含有556个体细胞和2个原始生殖细胞。发育成熟的雌雄同体线虫含有959个体细胞和2000个生殖细胞,而发育成熟的雄性成虫仅有1031个体细胞和1000个生殖细胞。尽管线虫是一种简单的模式生物,但是它具有精密的结构器官,包括肌肉、表皮、肠、生殖系统、腺体以及由302个(雌雄同体成虫)或391个(雄虫)神经元组成的神经系统。
2 线虫作为模式生物的优势
线虫以大肠杆菌(Escherichia coli,E.Coli)OP50为食,既可以养于琼脂培养板,还可以养于液体培养基[8]。线虫成虫体长仅1.3 mm左右,对成长空间的需求较小,96孔板的一个孔内即可培养100条线虫[9]。在实验室条件下易于大量培养、繁殖。此外,与细菌、细胞一样,线虫可以在液氮或-80℃冰箱中长期冷冻保存[1]。线虫身体透明,在普通显微镜下下易于观察其体内结构及生长发育过程。此外,还可以通过体内荧光标记,利用荧光显微镜直观地追踪某些生物过程,如轴突生长、胚胎发生、脂肪代谢等[10]。线虫的生长和繁殖速度很快,其生长发育速度受生长环境温度的调控。在25℃培养条件下,从虫卵长至成虫需要2.5 d。20℃培养条件下,需要3.5 d发育为成虫。15℃培养条件下,则需要6 d才能发育为成虫。在最适培养温度(20℃)下,成虫的繁殖能力最强,通过自体受精,一次可以产生300多个后代[11]。线虫具有5对常染色体和1对性染色体,遗传背景简单。线虫的全基因组测序早在1998年业已完成。目前,已建成多个数据平台,如worm base、worm book实现了遗传信息的共享。2000年,Arhinger实验室完成了线虫全基因组的RNAi文库,使得线虫成了第一个在全基因组范围内进行功能缺失分析的多细胞生物。
3 人类基因和线虫基因间的保守性
在线虫中建立人类疾病的模型的一个重要依据是药物靶点在两个物种之间是否具一定的保守性。通过生物信息学研究,我们发现60% ~80%的人类基因在线虫体内都具有同源直系物[12]。除了同源基因外,目前还发现许多重要的信号通路在线虫和人类中也具有一定的保守性,如细胞增殖相关的RAS 信号[13]、Wnt信号[14],免疫相关的 TGF-β 信号、Toll信号、MAPK 信号[15-17]。
根据Ortho Disease数据库的分析结果显示,在2,466个人类疾病相关基因中,小鼠中有1,354个同源基因,果蝇有724个,线虫有533个,大肠杆菌中有153个[18]。在众多模式生物中,选择大鼠、小鼠、灵长类等作为实验动物往往导致实验效率低下、实验成本昂贵、可操作性有限的局面。选择细菌、酵母、体外细胞进行实验又可能造成实验结果与人类疾病相关性差的结果。相比之下,利用线虫进行实验是一个快速的、有效的、经济的、高通量技术。我们可以基于一个完整的生命体进行系统研究,而非仅仅局限于药物对某个细胞系或某个受体蛋白的作用。
4 线虫在药物发现中的应用
4.1 人类疾病在线虫中的模型建立
利用线虫进行药物筛选的第一步就是建立人类疾病的线虫模型,包括确定疾病相关基因在线虫体内的同源基因,了解同源基因在线虫体内的相关功能。一般来说,有三种方式可以建立人类疾病的线虫模型:1)敲除(突变体)、敲低(RNAi)或增强线虫中人类疾病相关基因的同源直系基因并考察该基因对表型的影响,即建立突变体模型。2)通过药物或化合物诱导,线虫中建立一个与疾病相关或相似的生物过程,即化学诱导模型。3)在线虫中表达人类基因并产生一些疾病相关的表型,即建立转基因动物模型。
4.2 人类疾病的线虫模型
糖尿病模型:线虫体内daf-2基因与哺乳动物体内的胰岛素样生长因子IGFs受体家族同源,该基因调控了线虫的代谢、生长及寿命[19]。DevGen公司通过daf-2基因突变株建立了2型糖尿病药物高通量筛选的线虫模型。目前己从insulin信号通路对相关药物进行筛选研究[20]。
衰老模型:常用的线虫衰老模型有daf-2突变株、daf-16突变株以及原始野生型N2[21]。daf-2基因突变导致DAF-2受体型酪氨酸激酶结构变异,相比野生型该突变株的寿命更长。daf-16作为一个重要的转录因子,促进体内寿命相关基因的表达,daf-16的突变导致线虫的寿命比N2野生株短。利用线虫模型,高通量的筛选抗衰老药物已经有近30年的历史,并取得了丰硕的研究成果。
阿尔兹海默症(AD)模型:将人源β-淀粉样蛋白转入线虫中异源表达,建立AD的转基因线虫模型。结果表明,在转基因模型中可以诱导产生淀粉样蛋白沉淀物,并引起线虫麻痹。该转基因模型可以有效的用于β-淀粉样蛋白抑制剂的高通量筛选[22]。
帕金森病模型:包括通过异源过表达人α-突触核蛋白建立转基因模型[23]和通过神经毒素1-甲基-4-苯基吡啶(MPP)建立药物诱导模型[24],两种模型分别导致线虫神经元的损伤和多巴胺能神经元的选择性凋亡。此外还有氧化应激及其金属离子失紊态相关模型[25]。
亨廷顿病模型:通过注射人源亨廷顿蛋白N末端基因建立转基因模型,导致线虫的神经细胞凋亡,并且,随着时间的延长,神经细胞蛋白沉积增多[26]。目前,使用此模型筛选到的光辉霉素和氯化锂已经经过FDA批准,成为治疗该疾病的有效药物[12]。
线虫的抑郁模型:MOD-5是哺乳动物中血清素重吸收转运体(SERT)的同源直系物,通过抗抑郁药物氟西汀阻断MOD-5可以建立线虫的化学诱变模型。氟西汀作用于MOD-5后,可以增加突触前5-羟色胺的浓度,刺激线虫进食行为,并增加排卵量。而在MOD-5突变体中,氟西汀的这种作用消失。通过该模型,确定了抗抑郁药物氟西汀的作用靶点就是SERT,并且证明线虫模型也能够用于抗抑郁药物的筛选[27]。
抗菌模型:线虫还经常被用于宿主-病原体的研究中。线虫可以被一些病原体杀死,如假单胞菌、粘质沙雷菌、肠炎沙门菌亚属、金黄色葡萄球菌、肺炎链球菌等。由于,宿主-编码的防御系统在进化上是保守的,因此涉及其中的有害机制可以用于研究涉及这些病原体的人类疾病[28]。
除此之外,近年来线虫还被应用到多个生理系统疾病的研究中,例如:癌症及其抗癌药物,空间障碍及衰老,酒精成瘾,空气微粒体毒性等[29-32]。
5 线虫在药物作用研究中的应用
尽管线虫是一个简单的模式生物,但是它具有精密完善的系统结构。如图1[38]所示,药物作用于线虫时,首先,药物需要进入线虫体内(通过皮肤扩散,或通过摄取进入肠腔)。药物需要为生物体可用的,才能够穿过肠细胞膜并到达靶组织。到达靶向位置后,药物需要作用于其初始靶点,并克服胞内和组织内的自身调节,发挥药效。换句话说,只有在体内具有活性的物质才能在线虫体内引发反应。因此,利用线虫进行整体动物实验,可以用于药物对其作用靶点机制的研究,以及增加对药物对多个靶点协同作用的研究。目前,基于线虫的药物作用靶点研究方法主要有以下两类:
正向遗传学(forward genetics):正向遗传学是一个从表型到基因型的基本研究策略。正向遗传学的基础是通过诱变剂诱导线虫DNA的随机突变,筛选预期表型的突变体,通过单核苷酸多态性(SNP)等方法对突变基因的染色体进行定位,并获得突变基因的序列,从而确定表型和基因型的关系。这种研究方法可以检测突变体对某个药物/化合物的是否有超敏或脱敏的现象,从而探索药物的作用机制以及作用靶点。抗抑郁药物氟西汀的作用靶点就是利用MOD-5(人类血清素重吸收转运体的同源基因)突变体对氟西汀作用脱敏的现象,确定MOD-5是氟西汀的一个作用靶点,并由此推断人类SERT基因可能是氟西汀治疗抑郁的重要靶点。
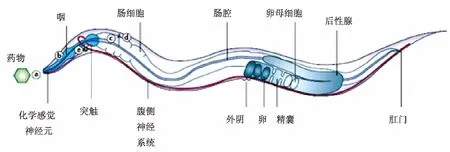
图1 药物进入线虫体内的路径Fig.1 Drug entry route into C.elegans
反向遗传学(reverse genetics):与正向遗传学相反,反向遗传学是从基因型到表型的研究策略。反向遗传学的基础是观察某个基因失活后生物体表型的变化。常用的反向遗传学方法有:一是根据研究需求,建立不同基因的突变体[33]。根据Caenorhabditis Genetics Center(CGC)的记录,目前CGC已经保存并可以提供1万多种线虫的突变体,包括有人类疾病基因同源基因的突变体线虫,以及同一基因的多种突变体。根据研究的需要,选择不同的突变体,即可考察该突变基因的功能以及确定药物的作用靶点。另一类反向遗传学的研究方法是RNA干扰(RNAi),RNAi是一个在线虫体内发现的现象,用于降低目标基因的表达。RNAi介导的基因敲除操作简单,可以通过直接将线虫浸润在含有dsRNA的溶液或者用可以产生dsDNA的细菌喂养线虫。在线虫中导入RNAi需要至少100 bp长的dsRNA。在哺乳动物系统中,只有短于22个核苷酸的dsRNA(通常成为small interfering RNA,siRNA)分子可以使用,以免引起干扰素反应或非特异性的抑制蛋白质生成。这两种副反应在线虫体内都是不存在的。线虫对长链dsRNA的兼容性可以通过作用于靶基因的多个位点来提高RNAi的效率。当线虫暴露于dsRNA后,靶基因的表达很快被降低,导致线虫出现新的表型。这一过程的发生需要多少时间,取决于不同的靶基因以及编码蛋白的周转率。RNAi可以在线虫的任意生命周期中被导入,并且可以通过持续的使用可以产生相关dsRNA的细菌喂养线虫来将RNAi诱导的表型维持很多代。由于在线虫上做RNAi实验操作简单,并且已经有丰富基因组数据做支持,这促进了一个新的高通量的方法,即全基因组RNA干扰(genome-wide RNAi)。在药物作用机制的研究中,我们可以使用线虫,在完整的生命体中进行药物靶点的自动化/半自动化高效筛选。
6 线虫在中药提取物药理作用研究中的应用
中药及其中药复方制剂以其成分复杂、作用全面等特点而不同于西药,以“多成分、多靶点”而凸显自己的优势。同时也正是由于复方提取物的复杂性且只能口服给药,并进行整体动物实验,制约了对其作用机制的研究。分子机制研究须依赖于细胞水平的实验,但中药提取物体外给药难以排除非特异性成分的影响,由此而使研究进入到两难境地。
“血清药理学”方法就是为了使中药提取物进行体外实验而产生的。旨在利用胃肠作为过滤屏障,直接采集口服中药提取物后的血清进行体外实验,以此来探讨其药物的作用机制。但是这一技术有两个不足:一是对血清含药量不易控制;二是对所含药物成分不清。如此影响了其后续机制的深入探讨和对研究结果的准确判定。线虫是独立的个体,且体内结构简单,易于观察。因此,在施以中药提取物的同时,就可以直接检测体内的分子水平的变化。即保证了中药提取物的复杂特性,同时又利于对其作用的观察和研究,是一个较为理想的模式生物。例如,我们可以利用分子生物技术构建相关靶标蛋白荧光表达的转基因线虫模型,通过其荧光蛋白表达与否可以直接观察到受试中药的靶标作用。这是一种较为理想的研究中药的技术。目前,国内以线虫来观察研究中药提取物的工作开展得还十分有限,大多集中在对中药安全性及其抗衰老延长线虫寿命等方面[34-36],关于线虫在中药研究中的优势也有一定的探讨[37]。未来,关于线虫在中药提取物中的研究方法学的考察及其对该技术的特点和规律的研究等有待于加强。
7 小结
在生物医学研究领域,我们对模式生物线虫的研究已经积累了丰富的研究经验,并取得了卓越的科研成果。然而我们也必须认识到线虫作为实验动物模型也有一定局限性:首先,线虫作为一个无脊椎低等生物,我们很难保证在药物在线虫模型和人体中具有一致的安全性和有效性。其次,线虫的身体结构简单,没有心脏、呼吸系统、特异免疫系统,因此有一些人类疾病很难在线虫中建立疾病模型。由于线虫和人类的种间差距较大,线虫模型不适用于药物安全性评价或某些特定疾病的相关研究,但是,这并不代表线虫模型不能用于药物研究。事实上,在药物的早期研究中,线虫迅速提供一些基础机制的线索,如某个特定基因的功能或药物的某个靶点。特别是当确定了某个疾病的分子基础后,可以针对某一靶点利用线虫进行药物的高通量快速筛查。线虫模型最重要的意义在于,线虫搭起了体内(in vivo)实验和体外(in vitro)实验中间的桥梁,在整体动物水平实现了高通量的、可靠的实验研究。这一点也是中药提取物研究的最理想之处。
[1] Brenner S.The genetics of Caenorhabditis elegans[J].Genetics,1974,77(1):71-94.
[2] Sulston J.E. NeuronalCellLineagesin the Nematode Caenorhabditis-Elegans[C].Cold Spring Harbor Symposia on Quantitative Biology,1983,48:443-452.
[3] Sulston J.E.,H.R.Horvitz.Post-Embryonic Cell Lineages of Nematode,Caenorhabditis-Elegans[J].Developmental Biology,1977,56(1):110-156.
[4] Sulston J.E.,E.Schierenberg,J.G.White,et al.The embryonic cell lineage of the nematode Caenorhabditis elegans[J].Dev Biol,1983,100(1):64 -119.
[5] Fire A.,Xu S.Q.,Montgomery M.K.,et al.Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J].Nature,1998,391(6669):806-811.
[6] Consortium C.e.S.Genome sequence of the nematode C.elegans:a platform for investigating biology[J].Science,1998,282(5396):2012-2018.
[7] Riddle D.L.,Blumenthal T.,Meyer B.J.,et al.C.elegans II[J].Trends in Cell Biology,1998,8(2):92.
[8] T.Stiernagle,Maintenance of C.elegans.C.elegans:A practical approach[M].UK:Oxford University Press,1999.51-67.
[9] Simonetta S.H.,Golombek D.A.An automated tracking system for Caenorhabditis elegans locomotor behavior and circadian studies application[J].Journal of neuroscience methods,2007,161(2):273-280.
[10] Burns A.R.,Kwok T.C.Y.,Howard A.,et al.Highthroughput screening of small molecules for bioactivity and target identification in Caenorhabditis elegans[J].Nature Protocols,2006,1(4):1906-1914.
[11] Silverman G.A.,Luke C.J.,Bhatia S.R.,et al.Modeling Molecular and Cellular Aspects of Human Disease Using the Nematode Caenorhabditis elegans[J]. Pediatric Research,2009,65(1):10-18.
[12] Voisine C.,Varma H.,Walker N.,et al.Identification of potential therapeutic drugs forhuntington'sdisease using Caenorhabditis elegans[J].PLoS One,2007,2(6):e504.
[13] Blume-Jensen P.,Hunter T.Oncogenic kinase signalling[J].Nature,2001,411(6835):355-365.
[14] Janssens N., JanicotM., PereraT. TheWnt-dependent signaling pathways as target in oncology drug discovery[J].Investigational New Drugs,2006,24(4):263 -280.
[15] Millet A.C.M.,Ewbank J.J.Immunity in Caenorhabditis elegans[J].Current Opinion in Immunology,2004,16(1):4-9.
[16] Nicholas H.R.,Hodgkin J.Responses to infection and possible recognition strategies in the innate immune system of Caenorhabditis elegans[J].Molecular Immunology,2004,41(5):479-493.
[17] Kurz C.L.,Ewbank J.J.Caenorhabditis elegans:An emerging genetic model for the study of innate immunity[J].Nature Reviews Genetics,2003,4(5):380 -390.
[18] O 'Brien K.P., Westerlund I., E.L.L. Sonnhammer,OrthoDisease:A database of human disease orthologs[J].Human Mutation,2004,24(2):112-119.
[19] Kimura K.D.,Tissenbaum H.A.,Liu Y.X.,et al.daf-2,an insulin receptor-like gene that regulates longevity and diapause in Caenorhabditis elegans[J].Science,1997,277(5328):942-946.
[20] O'Reilly L.P.,Benson J.A.,Cummings E.E.,et al.Worming our way to novel drug discovery with the Caenorhabditis elegans proteostasis network,stress response and insulin-signaling pathways[J].Expert Opinion on Drug Discovery,2014,9(9):1021-1032.
[21] Olsen A.,Vantipalli M.C.,Lithgow G.J.Using Caenorhabditis elegans as a Model for Aging and Age-Related Diseases[J].Understanding and Modulating Aging,2006,1067:120-128.
[22] Link C. D., C. elegans models of age-associated neurodegenerative diseases:Lessons from transgenic worm models of Alzheimer’s disease[J].Experimental gerontology,2006,41(10):1007-1013.
[23] Lakso M.,Vartiainen S.,Moilanen A.M.,et al.Dopaminergic neuronal loss and motor deficits in Caenorhabditiselegans overexpressing human alpha-synuclein[J]. Journal of Neurochemistry,2003,86(1):165-172.
[24] Braungart E.,Gerlach M.,Riederer P.,et al.Caenorhabditis elegans MPP+model of Parkinson’s disease for high-throughput drug screenings[J].Neurodegenerative diseases,2004,1(4 -5):175-183.
[25] Chege P.M.,McColl G.Caenorhabditis elegans:a model to investigate oxidative stress and metal dyshomeostasis in Parkinson's disease[J].Frontiers in Aging Neuroscience,2014,6.
[26] Faber P.W., AlterJ.R., MacDonaldM.E., etal.Polyglutamine-mediated dysfunction and apoptotic death of a Caenorhabditis elegans sensory neuron[J].Proceedings of the National Academy of Sciences,1999,96(1):179 -184.
[27] Ranganathan R.,Sawin E.R.,Trent C.,et al.Mutations in the Caenorhabditis elegans serotonin reuptake transporter MOD-5 reveal serotonin-dependent and -independent activities of fluoxetine[J].Journal of Neuroscience,2001,21(16):5871 -5884.
[28] Sifri C.D.,Begun J.,F.M.Ausubel.The worm has turnedmicrobial virulence modeled in Caenorhabditis elegans[J].Trends in Microbiology,2005,13(3):119-127.
[29] Kobetl R.A.,Pan X.P.,Zhang B.H.,et al.Caenorhabditis elegans:A Model System for Anti-Cancer Drug Discovery and Therapeutic Target Identification[J]. Biomolecules &Therapeutics,2014,22(5):371 -383.
[30] Honda Y.,Honda S.,Narici M.,et al.Spaceflight and Ageing:Reflecting on Caenorhabditis elegans in Space[J].Gerontology,2014,60(2):138-142.
[31] Zhu G.,Zhang F.,W.Li.Nematodes feel a craving-Using Caenorhabditis elegans as a model to study alcohol addiction[J].Neuroscience Bulletin,2014,30(4):595-600.
[32] Choi J.,Tsyusko O.V.,Unrine J.M.,et al.A micro-sized model for the in vivo study of nanoparticle toxicity:what has Caenorhabditis elegans taught us? [J]. Environmental Chemistry,2014,11(3):227-246.
[33] Liu L.X.,Spoerke J.M.,Mulligan E.L.,et al.Highthroughput isolation of Caenorhabditis elegans deletion mutants[J].Genome Research,1999,9(9):859 -867.
[34] 李贞景,张金阳,王昌禄,等.4种有毒中药对秀丽隐杆线虫致死率和产卵数的影响[J].毒理学杂志,2013,4:017.
[35] 肖家军,陆媚,马胜利,等.西藏红景天提取物延长线虫寿命和抗氧化活性探索[J].天然产物研究与开发,2013,25(8):1033-1036.
[36] 陈中孚,顾惠娟,王玲华,等.三种中药制剂对大肠杆菌 SOS应答的抑制作用及对线虫寿命的影响[J].癌变.畸变.突变,1991,3:5.
[37] 王香明,汪晓燕,高会丽,等.从分子机制研究抗帕金森病中药的线虫模型[J].中国中药杂志,2010(5):661-663.
[38] Kaletta T.,Hengartner M.O.Finding function in novel targets:c.elegance as a model organism[J].Nature Reviews Drug Discovery.2006,5(5):387 -399.

