探析伦理审查会议中的常见问题(二)
——比较中美两国伦理审查会议之不同*
訾明杰,何 军,高 蕊,唐旭东
(1中国中医科学院西苑医院医学伦理委员会,北京 100091,drzimingjie@126.com;2中国中医科学院医学伦理委员会,北京 100700; 3中国中医科学院西苑医院药物临床试验机构,北京 100091;4中国中医科学院西苑医院,北京 100091)
探析伦理审查会议中的常见问题(二)
——比较中美两国伦理审查会议之不同*
訾明杰1,何 军2,高 蕊3,唐旭东4**
(1中国中医科学院西苑医院医学伦理委员会,北京 100091,drzimingjie@126.com;2中国中医科学院医学伦理委员会,北京 100700; 3中国中医科学院西苑医院药物临床试验机构,北京 100091;4中国中医科学院西苑医院,北京 100091)
具体阐述了中美两国伦理委员会的会议审查在项目汇报、项目答疑、伦理讨论、投票表决等各环节的不同,分析了两国伦理审查模式的差异,并就中美两国伦理审查会议的模式进行了比较,有助于发现自身伦理审查会议模式的不足,提高自身伦理委员会会议审查效率。
伦理委员会;伦理审查会议;项目审查;伦理讨论
随着国内外医学临床研究的不断进展,行业内外越来越重视临床研究中受试者的权益和安全的保护,建立健全受试者保护体系与伦理委员会的工作受到越来越多的关注。伦理委员会依据国内外相关法规进行伦理审查,如世界医学会《赫尔辛基宣言》、世界卫生组织《生物医学研究审查伦理委员会操作指南》(2000年)、国际医学科学组织委员会(CIOMS)《人体生物医学研究国际伦理指南》(2002年)等国际指南,我国的伦理委员会还应遵从国家食品药品监督管理总局(CFDA)《药物临床试验质量管理规范(GCP)》(2003年)、《药物临床试验伦理审查工作指导原则》(2010年)、卫生部《涉及人的生物医学研究伦理审查办法(试行)》(2007年)等相关法规,对人体生物医学研究项目进行科学审查和伦理审查,其目的是为保护受试者的权益和安全。中医药临床研究的伦理审查还应遵从国家中医药管理局颁布的《中医药临床研究伦理审查管理规范》(2010年)的法规文件。一般地,会议审查、加快审查和紧急会议审查是伦理委员会的审查方式,其中会议审查是主要的审查方式。会议审查也是能充分体现伦理委员会审查能力和水平的主要形式,同时会议审查也是伦理委员会依据规范操作、遵从法规、标准操作规程(SOP)的一个充分表现形式。
长期以来,笔者作为伦理委员会的秘书,参与伦理委员会审查工作,并观摩、学习了国内多家伦理委员会会议审查,如美国西部如华盛顿大学(University of Washington)、[1]西雅图儿童医院(Seattle Children's Hospital)、[2]俄勒冈州大学附院伦理委员会、[3]西雅图肿瘤联盟医院(Seattle Cancer Care Alliance)[4]以及美国西部伦理委员会(Western Institutional ReviewBoard)[5]等多家美国大学/医院伦理委员会(以下简称“美国的这些伦理委员会”)的审查会议,虽然因医疗体系各异、遵从的法规有别、文化习俗的差异,国内外伦理审查会议的审查模式和重点明显有别。美国对于伦理委员会的要求和法规,除联邦法规(CFR)[6]外,因研究的资助来源不同,还会有如美国联邦保险(FWA)、[7]人体研究保护项目办公室(OHRPP)[8]等具体的要求,所有这些伦理委员会都应具备全面、细致、严谨的SOP。通过学习、比较不同地区伦理委员会的会议审查,从而完善自身伦理委员会建设,提高伦理审查会议的效率。
会议审查重中之重是项目审查环节,也是伦理委员会审查技术的充分展现,以下将从项目审查的各个细节对比中美两国之不同,以资借鉴。一般而言,伦理审查会议的项目审查多是由项目汇报-提问与答疑-充分讨论-汇总审查意见和建议-投票决议等五个基本环节组成,以下将从这几个环节进行分析。
1 项目汇报环节
项目汇报一般要求由主要研究者或主审委员进行汇报。汇报要求需简明扼要,如主要研究者履历、试验人员配备及设备条件;阐述临床前研究概况及有关临床研究结果;临床研究方案设计;受试者及其他人员可能遭受的风险和受益;试验设计的科学性及依据;获得并证明知情同意过程的描述;向受试者提供的因参与研究而给予的任何补偿(包括交通费、检验营养费、误工补偿费和医疗保健)的说明;对受试者的保险项目;受试者因参加临床试验而受到损害的治疗费用、补偿和/或赔偿费安排的说明等内容。一般而言,这个环节时间应控制在五至十分钟之内为宜。目前国内的伦理委员会在伦理审查项目汇报环节,绝大多数情况要求主要研究者亲自到场汇报。
在与美国的伦理委员会学习交流的过程中,所接触的这些无论医院/大学伦理委员会,还是独立/中心伦理委员会,审查会议中项目汇报者都是伦理委员会委员,这个(些)委员并不完全等同于我们通常所认为的主审委员(Primary Reviewer)。一般有1~2名汇报者,一名先陈述方案,接着另一名陈述知情同意书,或者只有一人陈述。委员忠于项目资料进行陈述,但在陈述完后,可以发表自己的看法和意见。这个过程一般在5~10min左右,但也有例外,遇到比较复杂的项目,陈述时间可能延长。汇报过程非常清晰,反映了委员对方案的熟悉程度以及对项目的整体把握。特殊项目或者可能由事先约请的独立顾问通过声音外放的电话从远端(非现场)进行陈述。
较之美国的这些伦理委员会项目汇报环节,国内伦理委员会会议审查的项目汇报环节有一定的优势,主要研究者非常了解项目的情况,面对面向委员介绍,有助于委员全面了解项目情况,同时也让研究者进一步了解伦理委员会的审查现场。但也有些伦理委员会在这个环节存在不足如汇报过细、或无序、或有漏项如获取知情的过程等。实际上很多专家认为这一环节由谁陈述不是重点,重要的是把握整体、简明扼要。能够让参会委员在简短的时间内清楚了解项目重点及全貌,才是汇报项目的真正目的,也是进行高效的会议审查的一个节点。
2 提问答疑环节
陈述/报告完项目后,参会委员就项目某些方面的疑问向汇报者提问,汇报者作答,必要时邀请申办者或研制者到会就某特定问题作详细说明。根据生效的保密协定,独立顾问可应邀与会或提供书面意见。这个环节也是充分体现伦理委员会会议审查是否高效的另一节点。委员只提问,提问应有系统性/逻辑性,可按照研究方案(包括研究前期信息、数据等资料,研究方案的设计等)→知情同意书及获取过程→招募广告等有序进行。如果没有疑问,可以直接跳过此环节。回答者应准确回答提问,必要时阐明理由、依据等。委员此时为主动发问的角色。一个高效的会议,提问环节往往简洁有序。
美国的这些伦理委员会通常没有特别明确的答疑环节,往往答疑的同时就进入了讨论环节,回答者通常就是陈述者,其他的委员都可以参与,即提问答疑/讨论在与会委员间进行。必要时直接用声音外放的电话询问主要研究者,并与之交流。这对陈述者的要求非常高,需要清晰了解项目资料,也就要求所有到会委员做好充分的准备。
与国外审查会议的这个环节相比较,国内伦理委员会由研究者答疑有其明显的优势:研究者直面委员,与委员交流和沟通,不仅让委员对项目有更清晰的认识,同时也是对研究者的一个伦理培训过程,让研究者清楚得认识到伦理审查的重点和关注点所在。但也有些伦理委员会做得不够好,有时可能出现的场景是:提问持续时间过长、提问无序(对方案和知情混在一起提问)、问题重复或者提问与讨论同时进行,而这个讨论发生在委员与研究者之间。如果伦理委员会制定的会议规则严谨,同时委员对会议规则清晰掌握,参会委员、主持人的职责有明确的规定,则可以避免以上问题,使这个环节成为伦理审查高效点之一。
3 审查讨论环节
与会委员对项目不存在疑问后,主要研究者、申办者、独立顾问及有利益冲突的委员等离开会场,参会委员进入审查讨论环节。审查讨论应依据国内外相关法规和指南规定的科学性、伦理性的审查原则,对项目进行充分审查与讨论。这个环节是充分体现伦理委员会会议审查是否高效的另一个重要环节,同时伦理委员会审查水平的高低也在此环节得以展示,所以现场会议通常也是伦理委员会接受第三方评估必须展示的场景之一。
因法规中对伦理委员会的会议模式没有特别清晰的要求,中美两国的伦理委员会在这一环节也是各有所长。美国这些伦理委员会讨论时将更多的关注点放在知情同意书的文本上,以及对受试者的风险和受益、隐私保密、受试者的权益讨论的更多,而对于方案的科学性讨论较少。我国的伦理委员会在审查讨论时更多的关注的是方案设计的科学性、伦理性。美国这些伦理委员会在知情同意书(ICF)的讨论详尽程度,不尽相同,并且每个讨论的点,都会找到相关法规的支持依据;有的伦理委员会在讨论ICF时非常仔细,用“字斟句酌”来形容都不为过;而有的大学的伦理委员会、医院伦理委员会更多关注的ICF对受试者权益是否得到了足够的保护。主持人在讨论的过程中,引导委员在一个关注点达成一致时,才顺利进行到下一个关注点。并且有意思的是,有的伦理委员会对于一个项目,在不同的方面,如风险的控制、隐私的保护等都会有一个达成一致意见的环节,即委员对于讨论的每个环节可能都会投票。在观摩他们的会议时,常常看见他们对每个项目可能多达五、六次的投票,这些投票都是举手表决或者口头表决,秘书都会记录在会议记录里面。
依照我国的相关法规,伦理审查应从项目的科学性、伦理性切入,这是公众关注的焦点,是伦理审查的重点。与美国的这些伦理委员会相比,我国的伦理委员会审查的特点是科学性与伦理性并重,不仅对研究方案作全面审查和考量,同时也对知情同意书的内容作审查和讨论。讨论和决定往往并不是给出细节乃至措辞的修改意见,而是对方案、知情同意书等给出建设性的建议和意见,不仅能帮助研究者更好地完善方案和知情同意书,也留给研究者一定的修改空间和思考余地。如何控制好讨论的节奏,使讨论恰如其分地进行,既不过于粗线条流于形式,又不会过于深入成为学术大讨论,是伦理委员会提高会议审查效率的一个关键所在。
4 总结环节
在我国的伦理审查会议中,充分的讨论结束后,需要主持人(或授权者)总结会议审查讨论的内容,这需要对之前的讨论进行高度凝练、集中概况,这个总结的内容将成为伦理委员会审查决议的内容。
相对我国的审查会议,美国的这些伦理委员会并没有一个明确的总结环节,如前所述,往往在讨论的过程中对某些方面做了讨论、投票表决,意见往往已经达成一致。这种模式和我国的最大不同在于:不集中所有的问题,单个问题针对性解决。有的伦理委员会在讨论表决的同时,对知情同意书的修改意见已经落实到项目知情同意书的纸面上,有时他们会帮助修改完善知情同意书。他们的理由是:有助于研究者知道如何修改,或者什么是伦理委员会认为的正确修改。
两相比较,我国的伦理委员会审查的总结环节,更能集合伦理委员会的集体智慧和思路,汇总作出审查结论更能使研究者有意识的去完善项目、知情同意书等资料,能更充分地发挥研究者的主观能动性。
5 表决/投票环节
投票是最后的环节。只有参与审查的伦理委员会成员才有决定权,以投票方式作出决定。投票方式有多种,举手表决、投票单表决、电脑系统表决等,国内伦理委员会这几种方式都是常见的。国外往往以举手表决或电脑系统表决为主,很少有投票单表决,并且表决在讨论中、讨论后都有发生,并没有完全一致的做法。不同表决方式各有利弊,比如电脑表决系统速度很快,而举手表决可能会有从众心理的影响,投票单表决可能留给了委员思考的时间,无论哪种方式,都不建议伦理委员会请所有委员在一页投票单上签字表决,这样可以尽可能的避免从众心理。所有投票结果都应在会议现场公布这一环节,两国做法完全一致。
6 小结
通过对中美两国伦理委员会会议审查模式的比较,可以清晰的看到审查模式在有些方面或多或少的差异,具体如表1所示。
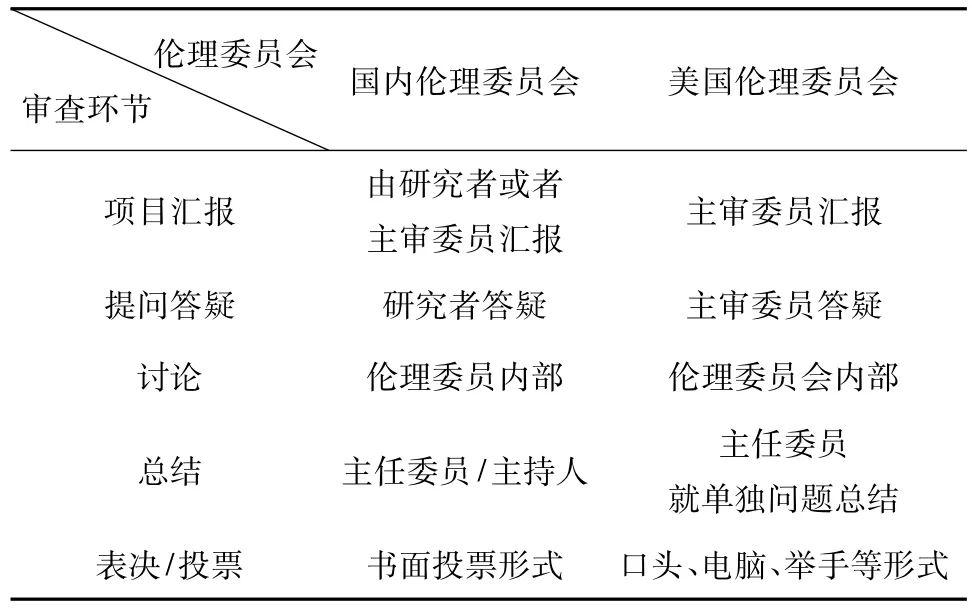
表1 国内伦理委员会与美国伦理委员会会议审查异同表
无论是什么样的模式,伦理审查会议反映出的是整个伦理委员会对法规的依从程度、整体审查的水平、伦理审查流程的执行。通过对比,也提示我们,要做好伦理审查工作,应注重每个细节的把握,从法规的依从、伦理委员会标准操作规程的完善、伦理审查会议的具体操作都将成为伦理委员会实现伦理审查、实现受试者保护的重要体现。
伦理委员会可依据法规,借鉴国内外其他伦理委员会的工作,做到有程序可依——伦理委员会制定严谨合理的程序、规则,有程序必依——准确执行,切实落实,不断完善自身建设,更好的发挥保护受试者的权益和安全的重要作用。
[1] 美国华盛顿大学.伦理委员会制度及操作流程[EB/OL].http://www.washington.edu/research/ hsd/.htm,2014-09-10.
[2] 美国西雅图儿童医院.临床研究[EB/OL].http:// www.seattlechildrens.org/.htm,2014-09-03.
[3] 美国俄勒冈州大学附属医院.伦理委员会制度及操作流程[EB/OL].http://www.ohsu.edu/ xd/health/ohsu-near-you/portland/marquamhill/ohsu-hospital.cfm.htm,2014-08-15.
[4] 美国西雅图肿瘤联盟医院.伦理委员会制度及操作流程[EB/OL].http://www.seattlecca.org/.htm,2014-09-10.
[5] 美国西部伦理委员会.制度及操作流程[EB/ OL].http://www.wirb.com/Pages/default.aspx,2014-08-07.
[6] 美国联邦法规.对于研究的相关伦理规定[EB/ OL].http://www.gpo.gov/fdsys/browse/collectionCfr.action?collectionCode=CFR.htm,2014-09-07.
[7] 美国联邦保险.关于临床研究中的保险规定[EB/OL].http://ohrp.cit.nih.gov/efile/Fwa-Start.aspx,2014-09-10.
[8] 美国人体研究保护项目办公室.关于受试者保护的原则[EB/OL].http://www.hhs.gov/ohrp/ policy/certconf.html,2014-08-12.
〔修回日期 2015-04-29〕
〔编 辑 曹欢欢〕
The Common Issues During the Meeting of Ethic Review(II)—Comparison of the ethic committee meeting between China and U.S.A
ZI Mingjie1,HE Jun2,GAO Rui3,TANG Xudong4
(1 Medical Ethics Committee,Xiyuan Hospital,China Academy of Chinese Medical Sciences,Beijing 100091,China,E-mail:drzimingjie@126.com;2 Medical Ethics Committee,China Academy of Chinese Medical Sciences,Beijing 100700,China;3 Drug Clinical Trial Institution,Xiyuan Hospital,China Academy of Chinese Medical Sciences,Beijing 100091,China;4 Xiyuan Hospital,China Academy of Chinese Medical Sciences,Beijing 100091,China)
This paper specifically elaborated the ethics committee of China and the United States review meeting in the project report,project FAQ,ethical discussion,voting and so on each link,analyzes the ethical review mode difference between the two countries,and according to the mode of ethical review meeting in China and the United States are compared,and the model helps to find their own ethical review meeting,improve their efficiency of ethical review committee meeting.
Ethic Committee;Meeting of Ethic Review;Project Review;Ethical Discussion
R-052
A
1001-8565(2015)03-0322-04
2015-01-07〕
* 资助课题:国家“重大新药创制”创新药物研究开发技术平台建设,项目编号:2012ZX09303010-002;中国中医科学院西苑医院自主选题“受试者保护体系运行机制的探索研究”
** 通讯作者,E-mail:txdly@sina.com

