Akt/GSK-3β/eNOS通路在藏红花酸保护离体大鼠心肌缺血再灌注损伤中的作用
王亚光,王鹏,陶贵周△,黄建华
Akt/GSK-3β/eNOS通路在藏红花酸保护离体大鼠心肌缺血再灌注损伤中的作用
王亚光1,王鹏2,陶贵周1△,黄建华2
目的研究藏红花酸(CRO)对离体大鼠心肌缺血再灌注损伤的保护作用,探讨其与丝氨酸/苏氨酸蛋白激酶(Akt)/糖原合成酶激酶(GSK)-3β/一氧化氮合酶(eNOS)信号通路的关系。方法SD大鼠40只,随机数字表法均分为正常(N)组、缺血再灌注(IR)组及5、10、15 mg/L加药(CRO1、CRO2、CRO3)组,比较再灌注30 min时各组心率(HR),冠脉流量(CF),左心室内压测定(LVDP、LV+dp/dtmax、LV-dp/dtmax)。灌流结束TTC心肌染色评估梗死范围,分光光度法测定肌浆乳酸脱氢酶(LDH)和肌酸激酶(CK-MB);Western blot检测各组心肌组织内Akt、磷酸化的丝氨酸/苏氨酸蛋白激酶(p-Akt)、GSK-3β、磷酸化的糖原合成酶激酶(p-GSK)-3β、eNOS、磷酸化的一氧化氮合酶(p-NOS)。结果IR组再灌注30 min时HR、CF、LVDP、LV+dp/dtmax、LV-dp/dtmax较N组及加药组降低,心肌梗死面积较加药组增大,LDH、CK-MB表达较N组及加药组增加(均P<0.05),CRO3组再灌注指标较CRO1组升高,梗死面积降低,LDH、CK-MB表达减少(P<0.05)。IR组Akt、GSK-3b及eNOS较N组及加药组的表达差异无统计学意义,但p-Akt、p-GSK-3β及p-NOS与N组及加药组降低,且CRO3组较CRO1组增加(均P<0.05)。结论藏红花酸能够减轻大鼠心肌缺血再灌注损伤,其作用机制可能与激活Akt/GSK-3β/eNOS通路并影响其磷酸化水平有关。
体外循环;再灌注损伤;蛋白激酶类;糖原合成酶激酶-3β;一氧化氮合酶;氧化磷酸化
目前,心肌缺血再灌注损伤(MIRI)成为阻碍缺血心肌从再灌注疗法获得最佳疗效的主要难题[1]。藏红花是多年生草本植物,可以调节纤维蛋白溶酶原激活剂及其抑制物之间的平衡,改善冠心病、心绞痛患者纤维蛋白的溶解功能,减少血栓形成[2]。王艳艳等[3]动物实验证实,藏红花酸(crocetin,CRO)预处理能够上调凋亡抑制蛋白(Bcl)-2、下调促凋亡蛋白(Bax),从而对损伤的心肌细胞产生保护作用。但有关CRO在体外对心肌缺血再灌注的相关研究少见。本实验旨在观察CRO对大鼠丝氨酸/苏氨酸蛋白激酶(Akt)、糖原合成酶激酶(GSK)-3β、一氧化氮合酶(eNOS)及其磷酸化形式表达的影响,探讨其对再灌注心肌的保护作用,以期为CRO改善MIRI的研究提供参考。
1 资料与方法
1.1 一般资料健康清洁级SD大鼠40只,体质量250~300 g,12~14周龄,雌雄不限,购于辽宁医学院实验动物中心。灌流装置购于美国RADNOTI公司,MP150多导生理记录分析系统购于美国BIAPOC公司,Krebs-Henseleit(K-H)试剂购于sigma公司,左室压力测定使用泰盟BL-420S生物功能实验系统,TTC试剂购于北京科博赛而科技有限公司,乳酸脱氢酶(LDH)和肌酸激酶(CK-MB)试剂盒购于南京建成生物有限公司,CRO购自济南浩化实业有限责任公司(批号为20121123)。
1.2 方法
1.2.1 实验分组与模型建立40只大鼠随机数字表法分为空白对照(N)组、缺血再灌注(IR)组、5 mg/L加药(CRO1)组、10 mg/L加药(CRO2)组、15 mg/L加药(CRO3)组,每组均为8只。大鼠干预前均自由进食,自由饮水。所有大鼠20%乌拉坦(5 μL/g)麻醉,1 000 U肝素静脉注射,迅速开胸,取出心脏,迅速移至Langendorff灌流装置,主动脉逆行插管,用KH液80 cm H2O恒压(1 cm H2O=0.098 kPa),Krebs-Henseleit(K-H)液成分NaCl 118 mmol/L,KCl 4.74 mmol/L,KH2PO41.19 mmol/L,MgSO4·7H2O 1.19 mmol/L,CaCl21.5 mmol/L,NaHCO325 mmol/L,葡萄糖10 mmol/L。调pH值为7.4。以体积分数为950 mL/L O2+50 mL/L CO2,水浴维持缺血温度37℃。心脏挂至灌流装置后,插入球囊,另一端连接换能器[4]。非循环模式下预灌流20 min后,IR组停灌30 min取K-H液再灌流45 min;CRO1组、CRO2组和CRO3组于再灌注时,灌流液中分别加入CRO 5、10及15 mg/L,余同IR组;对照组连续灌流95 min。凡由大鼠自身心脏结构决定心率(HR)<200次/min或冠脉流量<8 mL/min,予以排除[4]。再灌注30 min时测冠脉流量(CF)>5 mL/min、HR>170次/min为造模成功。
1.2.2 灌流期间观察指标在灌流稳定后缺血再灌流30 min时测各组流出K-H液冠脉流量(mL/min)、MP150测HR、BL-420S生物功能实验系统测左心室内压(LVDP)、等容收缩期左心室内压最大变化率(LV+dp/dtmax)及等容舒张期左心室内压最大变化速率(LV-dp/dtmax)。
1.2.3 TTC染色及酶谱测定在95 min灌注结束时取各组心脏于-20℃冻存1 h,N组不参与染色,由心尖至心底部横向均匀切片,1%2,3,5-氯化三苯基四氮唑(TTC)37℃染色5 min,后于10%福尔马林固定10 min,数码照相机拍照,苍白色为梗死区。采用图像分析仪Image pro plus 7.0软件处理得面积百分比。另取心尖组织0.5 g,制成10%心肌均浆,分光光度法分别在450 nm和340 nm处测定LDH、CK-MB含量。
1.2.4 Western blot取各组左室前壁心肌组织,提取蛋白,进行SDS-聚丙烯酰胺凝胶电泳。封闭液封闭,抗-Akt单克隆抗体(1∶1 500)、抗p-Akt单克隆抗体(1∶1 000)、抗-GSK-3β单克隆抗体(1∶1 000)、抗p-GSK-3β单克隆抗体(1∶1 000)、抗eNOS单克隆抗体(1∶1 000)及抗p-eNOS单克隆抗体(1∶1 000),以上抗体均为Cell Signaling公司产品,辣根过氧化酶标记的鼠抗兔为二抗,TBST洗膜后成像,Akt、GSK-3β、eNOS的水平以Akt/β-actin、p-Akt/β-actin、GSK-3β/β-ac⁃tin、p-GSK-3β/β-actin、eNOS/β-actin、p-eNOS/β-actin表示,用图像分析仪Image pro plus 7.0软件凝胶图像分析系统分析灰度值。
1.3 统计学方法采用SPSS 17.0软件统计分析。符合正态分布的计量资料以表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 CRO对各组中HR、CF、LVDP、LV+dp/dtmax、LV-dp/dtmax的影响N组、CRO1、CRO2及CRO3组CF、HR、LVDP、LV+dp/dtmax、LV-dp/dtmax均高于IR组(P<0.05)。CRO3组各项指标较CRO1、CRO2组升高(P<0.05),CRO2组、CRO1组差异无统计学意义(P>0.05),见表1。
Tab.1Comparison of CF,HR and LVDP during the period of ischemia/reperfusion between five groups表1 各组灌流期间CF、HR及LVDP等比较(n=8,)
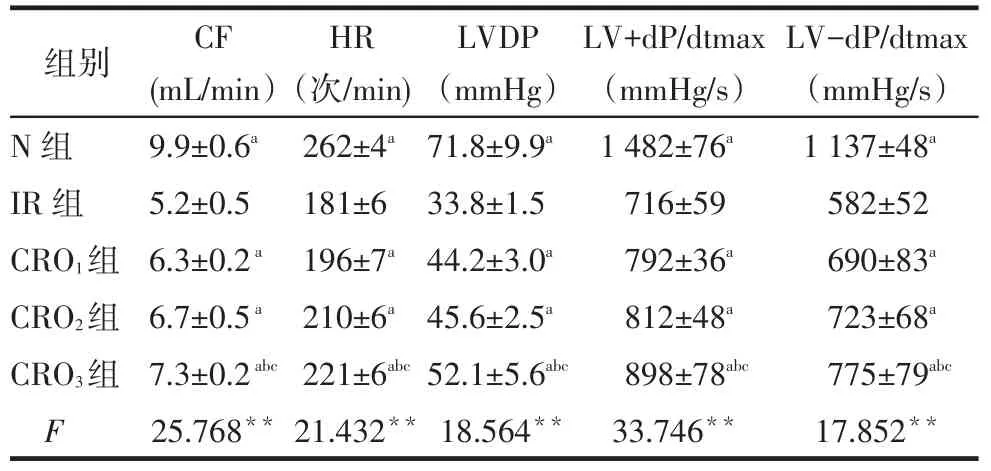
Tab.1Comparison of CF,HR and LVDP during the period of ischemia/reperfusion between five groups表1 各组灌流期间CF、HR及LVDP等比较(n=8,)
**P<0.01;a与IR组比较,b与CRO1组比较,c与CRO2组比较,均P<0.05;1 mmHg=0.133 kPa
组别N组I R组C R O1组C R O2组C R O3组F C F(m L / m i n)9 . 9 ± 0 . 6 a 5 . 2 ± 0 . 5 6 . 3 ± 0 . 2 a 6 . 7 ± 0 . 5 a 7 . 3 ± 0 . 2 a b c 2 5 . 7 6 8 * * H R(次/ m i n)2 6 2 ± 4 a 1 8 1 ± 6 1 9 6 ± 7 a 2 1 0 ± 6 a 2 2 1 ± 6 a b c 2 1 . 4 3 2 * * L V D P(m m H g)7 1 . 8 ± 9 . 9 a 3 3 . 8 ± 1 . 5 4 4 . 2 ± 3 . 0 a 4 5 . 6 ± 2 . 5 a 5 2 . 1 ± 5 . 6 a b c 1 8 . 5 6 4 * * L V + d P / d t m a x(m m H g / s)1 4 8 2 ± 7 6 a 7 1 6 ± 5 9 7 9 2 ± 3 6 a 8 1 2 ± 4 8 a 8 9 8 ± 7 8 a b c 3 3 . 7 4 6 * * L V -d P / d t m a x(m m H g / s)1 1 3 7 ± 4 8 a 5 8 2 ± 5 2 6 9 0 ± 8 3 a 7 2 3 ± 6 8 a 7 7 5 ± 7 9 a b c 1 7 . 8 5 2 * *
2.2 TTC染色梗死面积比较IR组、CRO1组、CRO2组及CRO3组的梗死面积分别为(48.7±9.8)%、(32.7± 4.2)%、(29.1±2.7)%、(21.7±4.5)%(F=34.264,P<0.01),其中IR组较CRO1组、CRO2组及CRO3组增
大,CRO3组较CRO1组减小(均P<0.05),见图1。
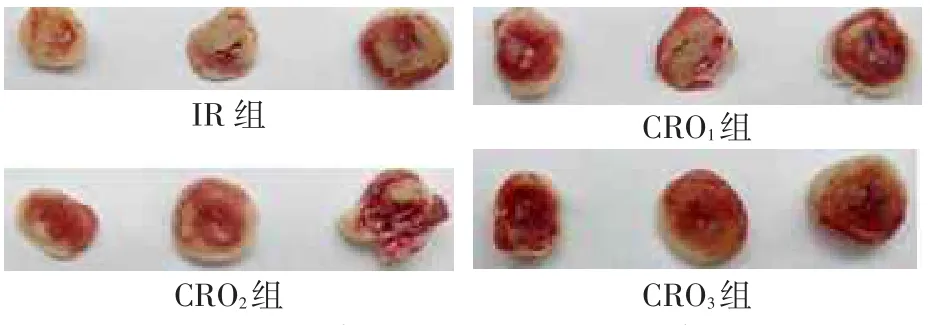
Fig.1TTC staining showing infarction area in different groups图1 各组梗死心肌TTC染色比较
2.3 各组LDH、CK-MB表达水平比较IR组较N组、CRO1、CRO2及CRO3组的LDH、CK-MB含量升高(P<0.01);CRO3组LDH、CK-MB含量较CRO1组降低(P<0.05),CRO3组LDH含量较CRO2组降低(P<0.05),见表2。
Tab.2The expressions of LDH and CK-MB in myocardial homogenate表2 心肌均浆LDH、CK-MB的检测结果(n=8,)

Tab.2The expressions of LDH and CK-MB in myocardial homogenate表2 心肌均浆LDH、CK-MB的检测结果(n=8,)
**P<0.01;a与IR组比较,b与CRO1组比较,c与CRO2组比较,均P<0.05
C K -M B(U · L -1)2 1 9 ± 1 2 a 6 2 1 ± 3 6 5 2 1 ± 4 5 a 3 5 8 ± 5 3 a b 3 3 3 ± 1 9 a b 2 2 . 5 0 8 * *组别N组I R组C R O 1组C R O 2组C R O 3组F L D H(U · g -1)1 4 9 6 . 2 ± 2 0 1 . 5 a 2 2 5 9 . 6 ± 1 7 8 . 3 2 0 3 0 . 8 ± 4 5 6 . 6 a 1 7 5 7 . 8 ± 4 7 6 . 2 a b 1 6 1 3 . 9 ± 3 5 6 . 4 a b c 1 7 . 3 5 2 * *
2.4 Western blot检测结果IR组与N组、CRO1、CRO2及CRO3组的Akt、GSK-3β、eNOS活性差异无统计学意义(P>0.05);IR组较N组、CRO1、CRO2及CRO3组的p-Akt、p-GSK-3β、p-eNOS表达降低(P<0.05),CRO3组p-Akt、p-GSK-3β、p-eNOS表达较CRO1组增加(P<0.05),见图2~4、表3。
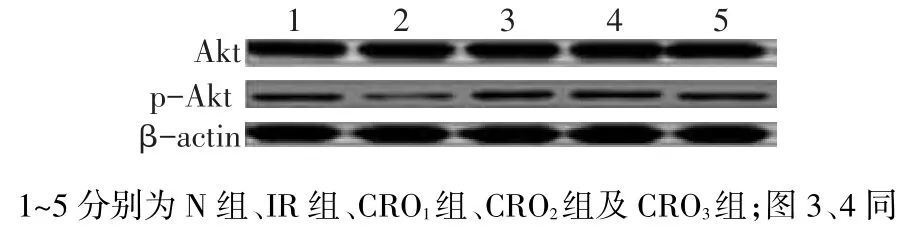
Fig.2Comparison of Akt and p-Akt activity between five groups图2 Akt与p-Akt在不同组内活性的比较

Fig.3Comparison of GSK-3β and p-GSK-3β activity between five groups图3 GSK-3β与p-GSK-3β在不同组内活性的比较

Fig.4Comparison of eNOS and p-eNOS activity between five groups图4 eNOS与p-eNOS在不同组内活性的比较
Tab.3Comparison of protein expression between five groups表3 各组蛋白表达结果的比较(n=8,)
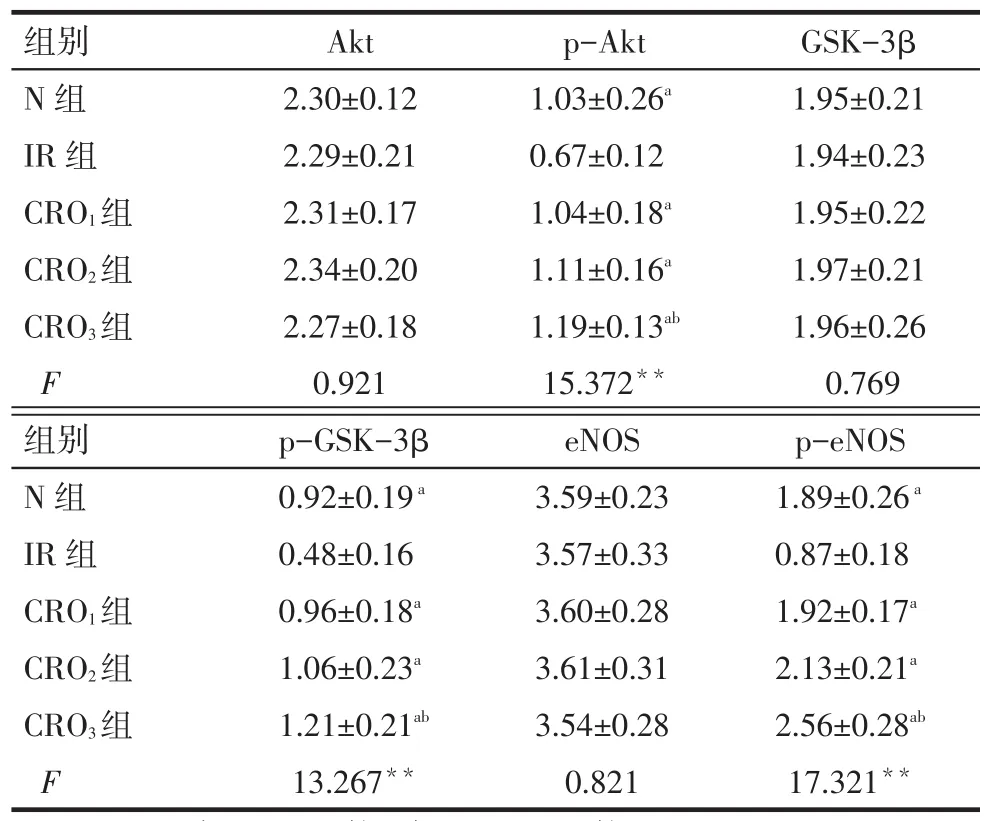
Tab.3Comparison of protein expression between five groups表3 各组蛋白表达结果的比较(n=8,)
**P<0.01;a与IR组比较,b与CRO1组比较,P<0.05
组别N组I R组C R O 1组C R O 2组C R O 3组F A k t 2 . 3 0 ± 0 . 1 2 2 . 2 9 ± 0 . 2 1 2 . 3 1 ± 0 . 1 7 2 . 3 4 ± 0 . 2 0 2 . 2 7 ± 0 . 1 8 0 . 9 2 1 p -A k t 1 . 0 3 ± 0 . 2 6 a 0 . 6 7 ± 0 . 1 2 1 . 0 4 ± 0 . 1 8 a 1 . 1 1 ± 0 . 1 6 a 1 . 1 9 ± 0 . 1 3 a b 1 5 . 3 7 2 * * G S K -3 β 1 . 9 5 ± 0 . 2 1 1 . 9 4 ± 0 . 2 3 1 . 9 5 ± 0 . 2 2 1 . 9 7 ± 0 . 2 1 1 . 9 6 ± 0 . 2 6 0 . 7 6 9组别N组I R组C R O 1组C R O 2组C R O 3组F p -G S K -3 β 0 . 9 2 ± 0 . 1 9 a 0 . 4 8 ± 0 . 1 6 0 . 9 6 ± 0 . 1 8 a 1 . 0 6 ± 0 . 2 3 a 1 . 2 1 ± 0 . 2 1 a b 1 3 . 2 6 7**e N O S 3 . 5 9 ± 0 . 2 3 3 . 5 7 ± 0 . 3 3 3 . 6 0 ± 0 . 2 8 3 . 6 1 ± 0 . 3 1 3 . 5 4 ± 0 . 2 8 0 . 8 2 1 p -e N O S 1 . 8 9 ± 0 . 2 6 a 0 . 8 7 ± 0 . 1 8 1 . 9 2 ± 0 . 1 7 a 2 . 1 3 ± 0 . 2 1 a 2 . 5 6 ± 0 . 2 8 a b 1 7 . 3 2 1**
3 讨论
藏红花是一种传统的中药材,CRO是其主要的活性成分之一。孙经武等[5]证实,CRO预处理在心肌缺血再灌注损伤中可以通过负性调节肿瘤坏死因子(TNF)-α,正性调节白细胞介素(IL)-10来减轻炎症反应并抑制心肌细胞的凋亡,发挥心肌保护作用。李玲等[6]研究证实,通过CRO对大鼠的预处理能够减轻缺血再灌注对心肌细胞的损伤,其作用机制与缺氧诱导因子-1α、血管内皮生长因子的表达有关。
本研究采用体外循环灌流装置,去除体液、神经及心脏前后负荷对再灌注的影响。结果显示,IR组与N组、各加药组比较,再灌流期间CF、HR、LVDP、LV+dp/dtmax、LV-dp/dtmax降低,TTC染色梗死面积较各加药组增大,心肌匀浆LDH、CK-MB的表达较N组、各加药组增加,表明缺血再灌注可导致心肌受损,也表明造模成功,提示CRO可以减轻离体大鼠心肌梗死模型的MIRI。再灌注期间CRO3组各项指标较CRO1、CRO2组升高,而CRO2组、CRO1组差异无统计学意义,CRO3组较CRO1组梗死面积及LDH、CK-MB的表达降低,表明高剂量的CRO发挥作用更明显,而抑制心肌细胞凋亡可能有助于CRO对心脏缺血再灌注保护作用。
细胞凋亡是组织损伤继发于缺血再灌注损伤的重要机制,心肌组织在缺血后再灌注的开始时,多种心肌保护手段均能够主动募集信号转导通路,其中Akt/GSK-3β/eNOS信号转导通路是最重要的途径之一,具有显著的抗心肌细胞凋亡、保护再灌注心肌的
作用[7]。叶强等[8]通过观察辛伐他汀对心肌梗死后心肌细胞凋亡的影响显示,辛伐他汀可改善心肌梗死后心功能,认为其可能是通过激活Akt/GSK-3β通路,抑制心肌细胞凋亡实现。刘馨骏等[9]研究表明,红景天苷可增加缺血再灌注心肌中Akt/GSK-3β的蛋白表达及磷酸化,增强对缺血再灌注损伤心肌保护作用。AKT激活后形成p-Akt,可进一步作用于相关底物发挥抗凋亡作用[10]。众多具有心肌保护作用的激酶如PKA、PKB/Akt、PKC都汇合于GSK-3β通路,导致GSK-3β磷酸化失活,最终通过抑制线粒体死亡来减轻细胞凋亡[11]。eNOS可产生NO,通过舒张血管、减轻炎症细胞及减少血小板聚集、浸润,改善冠脉血供,对心肌内皮细胞起保护作用[12]。eNOS的翻译后修饰有着复杂的模式,而磷酸化和去磷酸化网络是调节eNOS活性的主要的翻译后修饰[13]。
本研究结果显示IR组与N组及各加药组比,Akt、GSK-3β、eNOS蛋白总量未有明显变化,但其p-Akt、p-GSK-3β、p-eNOS较N组及各加药组表达量减少,CRO3组p-Akt、p-GSK-3β、p-eNOS表达较CRO1组增加,表明CRO保护心肌缺血再灌注损伤的作用机制可能与激活Akt/GSK-3β/eNOS通路有关,但不影响Akt、GSK-3β、eNOS总量的表达,而通过影响其磷酸化水平来发挥作用,与叶强等[8]研究相一致,且高剂量的CRO发挥作用更明显。因此,抑制细胞凋亡可能是CRO保护心肌、对抗缺血再灌注损伤的机制之一,证实Akt/GSK-3β/eNOS信号转导通路在MIRI保护作用中发挥重要作用,其活性调控呈现出一个复杂而精密的调控网络。目前,由于不同氨基酸残基的磷酸化对其活性调控的机制亦各异,中药及其有效活性成分在这些方面的深入研究尚较少。
[1]Xu M.Research on main mechanisms of MIRI and related drug ther⁃apy[J].Practical Pharmacy and Clinical Remedies,2014,17(8):1052-1055.[徐盟.心肌缺血再灌注损伤的主要机制与相关药物治疗的研究进展[J].实用药物与临床,2014,17(8):1052-1055].
[2]Zhang N,Li LS.Research progress on pharmacological effects of Crocus sativus and its active ingredients[J].Drug Evaluation Re⁃search,2013,36(5):394-396.[张娜,李林森.藏红花药理作用研究进展[J].药物评价研究,2013,36(5):394-396].doi:10.7501/j. issn.1674-6376.2013.05.018.
[3]Wang YY,Sun JW,Fan WN,et al.Effect of crocet in pretreatment on the expression of myocardial ischemia related proteins Bcl-2 and Bax in rats[J].Journal of Clinical Cardiology,2015,31(1):93-96.[王艳艳,孙经武,樊维娜,等.CRO预处理对心肌缺血大鼠凋亡相关蛋白与Bcl-2与Bax表达的影响[J].临床心血管病杂志,2015,31(1):93-96].doi:10.13201/j.issn.1001-1439.2015.01.025.
[4]Becker M,Goetzenich A,Roehl AB,et al.Myocardial effects of lo⁃cal shock wave therapy in a Langendorff model[J].Ultrasonics,2014,54(1):131-136.doi:10.1016/j.ultras.2013.07.005.
[5]Sun JW,Wang YY,Fang C.Effect of CRO pretreatment on inflam⁃matory reaction and ap optosis of myocardial ischemiareperfusionin⁃jury in experimentalRats[J].Chinese Circulation Journal,2015,30(2):172-175.[孙经武,王艳艳,房灿.CRO预处理对大鼠心肌缺血再灌注损伤中炎症反应和细胞凋亡的影响及其机制[J].中国循环杂志,2015,30(2):172-175].doi:10.3969/j.issn.1000-3614.2015.02.019.
[6]Li L,Wang B.Saffron on myocardial ischemia reperfusion in rats af⁃ter myocardial tissue the expression of hypoxia influenecd factor 1α,and vascular endothelial growth factor[J].Chinese Journal of Gerontology,2013,11(33):5656-5657.[李玲,王斌.藏红花对大鼠心肌缺血再灌注后心肌组织中缺氧诱导因子-1α、血管内皮生长因子表达的影响[J].中国老年医学杂志,2013,11(33):5656-5657].doi:10.3969/j.issn.1005-9202.2013.22.077.
[7]Bharti S,Sinqh R,Chauhan SS,et al.Phosphorylation of Akt/ GSK-3β/eNOS amplifies 5-HT2B receptor blockade mediated anti-hypertrophic effect in rats.[J].FEBS Lett,2012,586(2):180-185.doi:10.1016/j.febslet.2011.12.015.
[8]Ye Q,Chen HL,Liu YC.imvastatin through Akt/GSK3 beta path⁃ways inhibiting myocardial apoptosis after myocardial infarction[J]. Chinese Pharmacological Bulletin,2011,27(12):1656-1660.[叶强,陈良海,刘应才.辛伐他汀通过Akt/GSK3β通路抑制心肌梗死后心肌细胞凋亡[J].中国药理学通报,2011,27(12):1656-1660].doi:10.3969/j.issn.1001-1978.2011.12.008.
[9]Liu XJ,Gong JB,Pan T.Effect of salidroside on Akt/GSK-3β/eNOS of myocardium with ischemia-reperfusion injury in rats[J].Med Postgra,2015,28(2):146-148.[刘馨骏,宫剑滨,潘涛.红景天苷对大鼠缺血再灌注损伤心肌Akt/GSK-3β作用的研究[J].医学研究生学报,2015,28(2):146-148].
[10]Song ZF,Chen DY,Du B,et al.Poly(ADP-ribose)polymerase inhibitor reduces heart ischaemia/reperfusion injury via inflammation and Akt signaling in rats[J].Chin Med J(Engl),2013,126(10):1913-1917.
[11]Chen D,Zhang LT,Li JJ.Glycogen synthase kinase-3β in myo⁃cardial protection[J].Journal of Clinical Cardiology(China),2014,30(9):825-828.[陈丹,张丽婷,李建军.糖原合成酶激酶-3β与心肌保护研究进展[J].临床心血管病杂志,2014,30(9):825-828]. doi:10.13201/j.issn.1001-1439.2014.109.025.
[12]Ying Z,Xie X,Chen M,et al.Alpha-lipoic acid activates eNOS through activation of PI3-kinase/Akt signaling pathway[J].Vascul Pharmacol,2015,64(1):28-35.doi:10.1016/j.vph.2014.11.004.
[13]Fleming I.Molecular mechanisms underlying the activation of eNOS[J]. Pflugers Arch,2010,459(6):793-806.doi:10.1007/s00424-009-0767-7.
(2015-03-13收稿 2015-06-25修回)
(本文编辑 陆荣展)
The effect of crocetin on Akt/GSK-3β/eNOS signaling pathway in myocardial ischemiareperfusion injury of isolated rat hearts
WANG Yaguang1,WANG Peng2,TAO Guizhou1△,HUANG Jianhua2
1 Department of Cardiology,the First Affiliated Hospital of Liaoning Medical College,Jinzhou 121001,China;2 Key Laboratory of Tissue Engineering,The First Affiliated Hospital of Liaoning Medical College,Jinzhou△
ObjectiveTo study the protective effects of crocetin on myocardial ischemia-reperfusion injury,and their correlation with the signaling pathway of serine/threonine protein kinase(Akt)/glycogen synthase kinase(GSK)-3β/nitric ox⁃ide synthase(eNOS).MethodsForty healthy SD rats were divided into normal group(N),ischemia reperfusion group(IR)and 5,10 and 15 mg/L of crocetin groups(CRO1,CRO2and CRO3)by random number table method.The values of heart rate(HR),coronary flow(CF)and left ventricular pressure measurement(LVDP,LV+dp/dtmax,LV-dp/dtmax)30 minutes after reperfusion were compared between five groups.TTC staining was used to detect the infarct volume.Spectrophotometric method was used to determinate the expression of lactate dehydrogenase(LDH)and creatine kinase(CK-MB).The levels of Akt,the phosphorylation of Akt(p-Akt),GSK-3β,phosphorylation of GSK-3β(p-GSK-3β),eNOS and phosphorylation of eNOS(p-NOS)were detected by Western blot assay.ResultsThe HR,CF,LVDP,LV+dp/dtmax and LV-dp/dtmax were significantly lower 30 min after reperfusion in IR group than those of N group and crocetin groups(P<0.05).The myocardial infarction area was bigger in IR group than that of crocetin groups.The expression levels of LDH and CK-MB were signifi⁃cantly higher in IR group than those of N group and crocetin groups(P<0.05).The reperfusion index was higher in CRO3group than that of CRO1group.The infarction area,LDH and CK-MB expressions were significantly decreased in CRO3group than those of CRO1group(P<0.05).There were no significant differences in expressions of Akt,GSK-3β and eNOS between IR group,N group and crocetin groups.But p-Akt,p-GSK-3β and p-NOS were significantly decreased in IR group than those of N group and crocetin groups.The p-Akt,p-GSK-3β and p-NOS were significantly increased in CRO3group than those of CRO1group(P<0.05)。ConclusionCrocetin has protective effects on myocrdial ischemia reperfusion injury in rats,which may be involved in the enhancing the phosphorylation of signalling pathway of Akt/GSK-3β/eNOS.
extracorporeal circulation;reperfusion injury;protein kinases;glycogen synthase kinase 3β;nitric oxide synthase;oxidative phosphorylation
R965.2
A
10.11958/j.issn.0253-9896.2015.11.021
1锦州,辽宁医学院附属第一医院心内科(邮编121001),2院组织工程重点实验室
王亚光(1990),男,硕士研究生,主要从事冠心病的诊断与治疗研究
△通讯作者E-mail:tgz56789@163.com

