酶解法提取葡萄酒泥中白藜芦醇工艺研究
史秋兰 周艳春 赵俭波 刘建刚


摘 要:研究采用酶解法从葡萄酒泥中提取白藜芦醇,探索其最佳提取工艺,在单因素试验的基础上,以酶浓度、酶解温度、酶解时间为因素进行正交试验。结果表明:酶浓度、酶解时间对白藜芦醇的提取效果有显著影响,最佳提取工艺条件为pH值4.0,酶浓度1.5mg/g,酶解温度40℃,酶解时间75min,在此条件下白藜芦醇提取量为80.2μg/g。
关键词:酶解法;葡萄酒泥;白藜芦醇;工艺优化
中图分类号 O636.2 文献标识码 A 文章编号 1007-7731(2015)21-35-03
Technology for Extracting Resveratrol from Wine Mud through Enzymatic Hydrolysis
Shi Qiulan1 et al.
(1Alar Quality and Technical Supervision Bureau,Alar 843300,China)
Abstract:Resveratrol was extracted from wine mud by alcohol precipitation method with the assistance of enzymolysis,and optimum extraction was explored. The effects of enzyme concentration,enzymatic hydrolysis temperature,and time on the yields of resveratrol were studied by single factor and orthogonal array design methods. The result is that enzyme concentration and hydrolysis time have a significant impact on the effectiveness of resveratrol extract,and the optimum extraction conditions are as follows:pH value 4.0,enzyme concentration 1.5mg/g,enzymatic hydrolysis temperature 40℃ and hydrolysis time 75min. Under such conditions,the yield of resveratrol is 80.2μg/g.
Key words:Wine mud;Resveratrol;Enzymatic hydrolysis;Process optimization
白藜芦醇(resveratrol,简称Res)又称芪三酚,化学名称为3,4′,5-三羟基二苯乙烯,是植物受到病原性进攻和环境恶化时体内产生的一种次生代谢产物[1]。1963年,Nonomura等[2]提出白藜芦醇是某些草药治疗炎症、脂类代谢和心脏疾病的有效成分后,各国科研工作者陆续提出白藜芦醇具有改善心脑血管循环,抗氧化、抗衰老,抗病毒、保肝,抗肿瘤、抗癌等药理及生物学作用[3-5]。白藜芦醇的制备多从天然植物虎帐、葡萄皮、花生中提取[6-8],近期的研究发现,葡萄酒泥中含有较丰富的白藜芦醇,含量为28.63~80.48μg/g[9]。目前,大部分葡萄酒泥被当做饲料或肥料使用[10],利用率极低,更有部分被随意排放,造成环境污染。本研究以葡萄酒泥为原料,以乙醇作为提取剂,采用酶解法提取白藜芦醇,以期为白藜芦醇原料的开发和葡萄酒泥的综合利用提供依据。
1 材料与方法
1.1 材料、试剂与仪器 葡萄酒泥由新疆乡都酒业有限公司提供,为泥状物,经3 000r/min离心,弃去上层清液,沉淀物自然晾干,粉碎之后过80目筛备用;纤维素酶由上海蓝季科技发展有限责任公司提供;白藜芦醇标准品由美国Sigma公司提供;无水乙醇、甲醇、乙酸乙酯等均为AR,由天津市天津市致远化学试剂有限公司提供。UV2000紫外可见分光光度计,日本岛津;756紫外可见分光光度计,上海光谱仪器有限公司;PL303电子天平,梅特勒-托利多仪器有限公司;RE-52旋转蒸发器,上海东玺制冷仪器设备有限公司;KQ-400KDE型高功率数控超声波清洗器,昆山市超声仪器有限公司。
1.2 白藜芦醇测定方法[11] 准确称取白藜芦醇标准品0.1g,用甲醇溶解,并定容到10mL,摇匀,备用,得白藜芦醇对照品储备液。取白藜芦醇对照品储备液置于1cm比色皿中,以甲醇为参比,用紫外分光光度计在200~800nm波长间扫描,该标准溶液在306nm处有最强吸收峰。移取不同体积白藜芦醇对照品储备液置于10mL容量瓶中,配制成一系列不同浓度的标准溶液,于306nm处测定吸光度值,绘制标准曲线,以对照品浓度为横坐标,吸光度为纵坐标,得回归线方程y=0.5624x-0.0347(R2=0.994 2),线性范围为0.3~1.59μg/mL。式中:y为吸光度值,x为白藜芦醇质量浓度。
1.3 白藜芦醇提取方法 称取一定量葡萄酒泥粉末至锥形瓶中,加入适量水和纤维素酶在一定的温度、一定的pH值下酶解一定时间,酶解后加入150mL70%乙醇,于70℃恒温提取1h后抽滤,收集滤饼,得白藜芦醇粗品。然后将此粗品用甲醇溶解、定容,并稀释适当倍数后测定提取液的吸光度,由回归线性方程得出白藜芦醇提取量,公式如下:
提取量(μg·g-1)=提取液中白藜芦醇质量浓度×提取液体积/葡萄酒泥质量
经分析后确定酶解温度、酶用量和酶解时间是酶解法影响白藜芦醇提取量的主要因素,采用单因素实验和正交试验探讨白藜芦醇提取最佳实验条件。
2 结果与分析
2.1 单因素试验结果
2.1.1 酶浓度对白藜芦醇提取率的影响 在酶解温度为40℃,缓冲液pH值4.0条件下,分别添加浓度为0.5mg/g、1.0mg/g、1.5mg/g、2.0mg/g、2.5mg/g、3.0mg/g的纤维素酶,酶解60min。不同酶浓度对白藜芦醇提取量的影响如图1所示。由图1可知,随着酶浓度的增加,白藜芦醇的提取量也增大,当酶浓度为1.5mg/g时,白藜芦醇的提取量达到最大,此后随着酶浓度的增加,白藜芦醇的提取量略有下降。这可能是由于原料与酶分子的结合数量是有限的,当酶浓度较低时,酶分子与底物充分结合,酶浓度若过高,则过量的酶分子不利于分子定向运动,酶活性反而降低[12]。
2.1.2 酶解温度对白藜芦醇提取率的影响 在缓冲液pH值4.0条件下,添加浓度为1.5mg/g的纤维素酶,分别在温度30~55℃酶解60min。不同酶解温度对白藜芦醇提取量的影响如图2所示。由图2可知,随着温度的增加,白藜芦醇的提取量也增大,当酶解温度达到45℃时,提取量达到最大,此后再随着酶解温度的增加,白藜芦醇的提取量呈下降趋势。在酶解反应中,温度不仅影响反应速度,而且影响酶的活性,温度升高,酶的活性降低,且白藜芦醇是热敏性物质,高温下易被氧化[13]。
2.1.3 酶解时间对对白藜芦醇提取率的影响 在酶解温度为45℃,缓冲液pH值4.0条件下,添加浓度为1.5mg/g的纤维素酶,分别酶解20~100min。酶与原料结合发生酶解反应需要一定的时间,由图3可知,随着酶解时间的延长,白藜芦醇提取量也随之增大,酶与原料充分结合后再延长时间,提取量变化不大。因此,确定酶解时间为60min。
2.1.4 pH值对对白藜芦醇提取率的影响 在酶解温度为45℃条件下,分别在pH值为2~7的溶液中添加浓度为1.5mg/g的纤维素酶,酶解60min。不同pH值对白藜芦醇提取量的影响如图4所示。大多数的酶的活性对环境pH的影响较大,pH的改变会破坏酶的结构,从而使酶的活性降低,影响酶解反应。由图4可知,白藜芦醇提取量在pH值为4.0时最大。
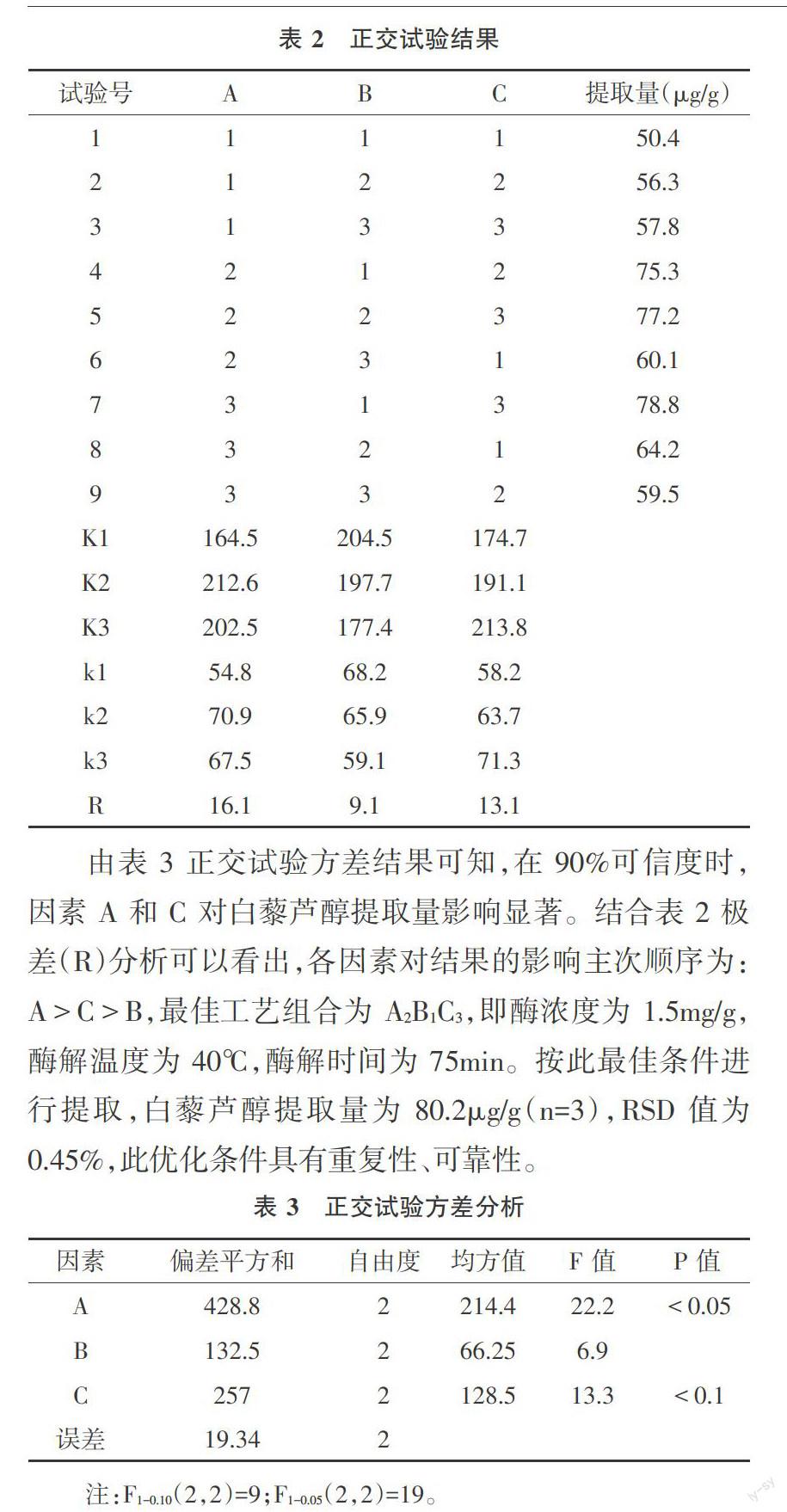
2.2 酶解法提取葡萄酒泥中白藜芦醇正交试验 根据单因素试验的研究结果,将酶浓度、酶解温度和酶解时间作为考察因素,采用L9(33)正交试验对白藜芦醇酶解工艺进行优化。试验因素与水平见表1,试验结果见表2。
由表3正交试验方差结果可知,在90%可信度时,因素A和C对白藜芦醇提取量影响显著。结合表2极差(R)分析可以看出,各因素对结果的影响主次顺序为:A>C>B,最佳工艺组合为A2B1C3,即酶浓度为1.5mg/g,酶解温度为40℃,酶解时间为75min。按此最佳条件进行提取,白藜芦醇提取量为80.2μg/g(n=3),RSD值为0.45%,此优化条件具有重复性、可靠性。
3 结论
本实验以乙醇为提取剂采用酶解法提取葡萄酒泥中的白藜芦醇,通过单因素试验和正交试验得出较佳的酶解工艺条件为pH4.0,酶浓度1.5mg/g,在40℃下酶解75min,白藜芦醇提取量为(80.2±0.33)μg/g。
参考文献
[1]韩晶晶,刘炜,毕玉平.白藜芦醇的研究进展[J].生物工程学报,2008,24(11):1851-1859.
[2]Nonomura S,Kanagawa H,Makimoto A.Chemical constituents of polygonaceous plants. I. Studies on the components of Ko-jo-kon(Polygonum cuspidatum Sieb.et Zucc.)[J].Yakugaku Zasshi,1963,83:988-990.
[3]Jang M,Pezzuto J.Effect of resveratrol on 12-Otetradecanoylphorbol-13-acetate induce oxidative evevts and gene expression in mousekin. Cancer Lett,1998,134(1):81-89.
[4]金顺姬,段链,黄梅,等.白藜芦醇和抗坏血酸对预防非典型肺炎方剂Ⅰ和Ⅵ所致小鼠外周血液淋巴细胞DNA损伤的保护作用[J].中草药,2003,34(12):114-117.
[5]罗莉,黄忆明.白藜芦醇对老年性痴呆小鼠认知功能的影响[J].中南大学学报(医学版),2006,31(4):566-569.
[6]魏萌,王水兴,陆豫.虎杖中的白藜芦醇分离、提取及HPLC 检测的研究[J].食品科技,2006,31(8):118-120.
[7]刘婷,王燕,李韵,等.响应面法优化超临界CO2萃刺葡萄酒渣中白藜芦醇工艺[J].食品工艺研究,2015,36(4):193-198.
[8]张初署,禹山林,潘丽娟,等.响应面法优化花生根中白藜芦醇提取工艺研究[J].食品科学,2009,30(6):34-38.
[9]赵俭波,沈红玲,王伟,等.葡萄酒泥与慕萨莱斯酒泥营养成分的比较分析[J].食品工业,2015,36(5):295-297.
[10]高学峰,杨继红,王华,等.葡萄及葡萄酒生产过程中副产物的综合利用研究进展[J].食品科学,2015,36(7):289-295.
[11]刘大川,刘强,吴波,等.花生红衣中白藜芦醇、原花色素提取工艺的研究[J].食品科学,2005,26(7):144-148.
[12]张圣燕.纤维素酶在天然产物提取中的应用研究[J].广东化工,2011,38(9):59-60.
[13]钱时权,石亚中,伍亚华,等.纤维素酶-超声波辅助有机溶剂提取山葡萄中白藜芦醇的研究[J].食品工业科技,2012,33(3):210-213.
(责编:张宏民)

