纳米雄黄干预肺癌A549细胞对血管内皮生长因子及缺氧诱导因子-1表达的影响
齐元富 李慧杰 于连洋 (山东中医药大学附属医院肿瘤科,山东 济南 250011)
据专家预测,到2025年我国的肺癌死亡数将达到100万/年〔1〕。因此,寻找高效、低毒新型的抗肿瘤药物已成为治疗肺癌的当务之急。雄黄具有很强的抗肿瘤作用,但其毒性较大,而采用纳米技术将其纳米化可降低毒性〔2〕。本实验从调控肿瘤血管生成的角度探讨纳米雄黄抗肿瘤作用。
1 材料与方法
1.1细胞 细胞系人肺腺癌A549细胞株,购自山东省医学科学院细胞室。
1.2主要试剂药品 雄黄原药(购自陕西康惠制药有限公司,生产批号091201);顺铂(DDP,齐鲁制药厂);RPMI1640培养液(GIBCO公司);胎牛血清(杭州四季清生物公司);胰蛋白酶(伯安生命技术有限公司);兔抗人血管内皮生长因子(VEGF)一抗、兔抗人缺氧诱导因子(HIF-1)一抗、兔抗人β-catenin一抗、浓缩型SABC试剂盒及DAB显色试剂盒(武汉博士德生物有限公司);总RNA提取试剂盒(北京Solarbio科技生物公司);VEGF上下游引物及β-actin内参:由博尚生物有限公司合成(VEGF基因上游引物序列为GGACAAGTCACCACAGGA,下游为GGAGAAAATCAAGTCGTG,片段长度为142 bp;内参β-actin上游引物序列为GACTACCTCATGAAGGTC,下游为GATCCACATCTGCTGGAA,片段长度500 bp)。
1.3主要仪器 CO2培养箱BB5060UV型(德国Heraeus公司);倒置相差显微镜1X50S8F型(日本Olympus公司);凝胶成像分析系统2200型(美国Alpha公司);梯度PCR仪T-gradient型(德国Biometro公司);PCR仪Sprint型(英国Thermo Hybaid公司)。
1.4纳米雄黄制备 由山东龙脉科技发展有限公司龙脉精研机(型号LVM-80WE)研磨纳米化,由济南微纳颗粒仪器股份有限公司光子相关纳米激光粒度分析仪(型号Winner801)测定纳米雄黄颗粒尺寸大小和粒径分布,平均粒径约72.79 nm,符合纳米药物制剂要求。KCl饱和硝酸溶液溶解纳米雄黄,配成2 mg/ml的混悬液,NaOH调pH至7.0,磷酸盐缓冲液(PBS)定容,过滤除菌,4℃保存备用。
1.5实验分组 对照组:常规培养,无药物干预;纳米雄黄组:10%纳米雄黄组、20%纳米雄黄组;DDP组:DDP终浓度为2 μg/ml;联合组(纳米雄黄+顺铂):10%联合组、20%联合组。
1.6细胞培养及其悬液制备 将人肺癌A549细胞于含10%胎牛血清的RPMI1640培养液中,37℃、5%CO2细胞培养箱中培养,细胞贴壁生长待细胞长满贴壁,即可传代,一般3 d传代一次,实验时取对数生长期细胞。制备细胞悬液时取对数期生长的人肺腺癌A549细胞株,经0.25%胰酶消化,计数后细胞加入含10%胎牛血清的RPMI1640完全培养液中培养制备待用。
1.7RT-PCR法检测 提取总RNA:培养肺癌A549细胞,平均分瓶,待细胞生长旺盛长满后,按实验分组加药,继续培养24 h,分别制成细胞悬液,分装入离心管,400 r/min离心10 min,收集细胞,按总RNA抽提试剂盒操作步骤提取各组细胞总RNA,经ND-1000检测RNA的纯度与含量用于RT-PCR检测。RT-PCR参照试剂盒说明书逐步进行实验,采用Alpha凝胶成像系统摄取图像,用该系统自带的分析软件分析各目的条带和内参的平均密度值-灰度值,用目的条带的灰度值除以内参的灰度值,即所需要的相对表达量。
1.8免疫组化测定 高温消毒盖玻片放入六孔板中,制备A549细胞悬液种板,继续培养,待细胞爬玻片成功后,按实验分组加药,继续培养24 h,弃液,PBS清洗,95%乙醇固定,0.5%Triton X-100室温孵育15 min,3%H2O2室温孵育,封闭血清室温孵育,一抗工作液湿盒37℃孵育60 min,PBS清洗,二抗工作液湿盒37℃孵育30 min,PBS清洗,SABC湿盒37℃孵育30 min,DAB染色,镜下控制反应时间,蒸馏水洗涤,苏木素轻度复染,自来水洗涤泛蓝,梯度酒精脱水,二甲苯透明,中性树胶封片,显微镜下观察,HPIAS-1000高清晰度彩色病理图文分析。
1.9统计学方法 运用SPSS17.0软件进行单因素方差分析。
2 结果
2.1RT-PCR法检测纳米雄黄对VEGF mRNA表达的影响纳米雄黄组、DDP组、联合组条带灰度低于对照组,10%、20%纳米雄黄组条带亮度依次变低,联合组条带亮度较DDP组及纳米雄黄组低,20%联合组条带亮度最低(见图1)。其中,对照组的VEGF相对表达量明显高于纳米雄黄组、DDP组与联合组(P<0.05);10%纳米雄黄组VEGF相对表达量明显高于20%纳米雄黄组(P<0.05);各纳米雄黄组与DDP组的VEGF相对表达量明显高于联合组(P<0.05);10%联合组VEGF相对表达量高于20%联合组(P<0.05)。见表1。

图1 VEGF mRNA表达凝胶电泳图
2.2免疫组化法检测纳米雄黄对HIF-1表达的影响 HIF-1阳性细胞为胞质、胞核、胞膜为棕黄色颗粒,见图2,说明纳米雄黄对A549细胞HIF-1有明显抑制作用,并随浓度增大抑制作用增强,各纳米雄黄组抑制作用均不及DDP组,相比均有显著性差异(P<0.05);而二者联合组抑制作用同单一纳米雄黄及DDP组相比均有显著性差异(P<0.05),且各药物组HIF-1表达均低于对照组,相比均有显著性差异(P<0.05或0.01)。见表1。
表1 各组VEGF、HIF-1阳性表达比较(s,%,n=6)

表1 各组VEGF、HIF-1阳性表达比较(s,%,n=6)
与对照组比较:1)P<0.05;与10%纳米雄黄组比较:2)P<0.05;与DDP组比较:3)P<0.05;与10%联合组比较:4)P<0.05
64.50±6.67 45.50±4.67 10%纳米雄黄组 53.73±5.461)3) 40.76±3.961)3)20%纳米雄黄组 44.74±4.541)2)3) 36.74±3.541)2)3)DDP组 38.97±3.581)2) 32.07±3.781)2)10%联合组 27.76±3.011)2)3) 30.76±3.011)2)3)20%联合组 20.56±2.691)2)3)4) 25.56±2.691)2)3)4)VEGF HIF-1对照组组别
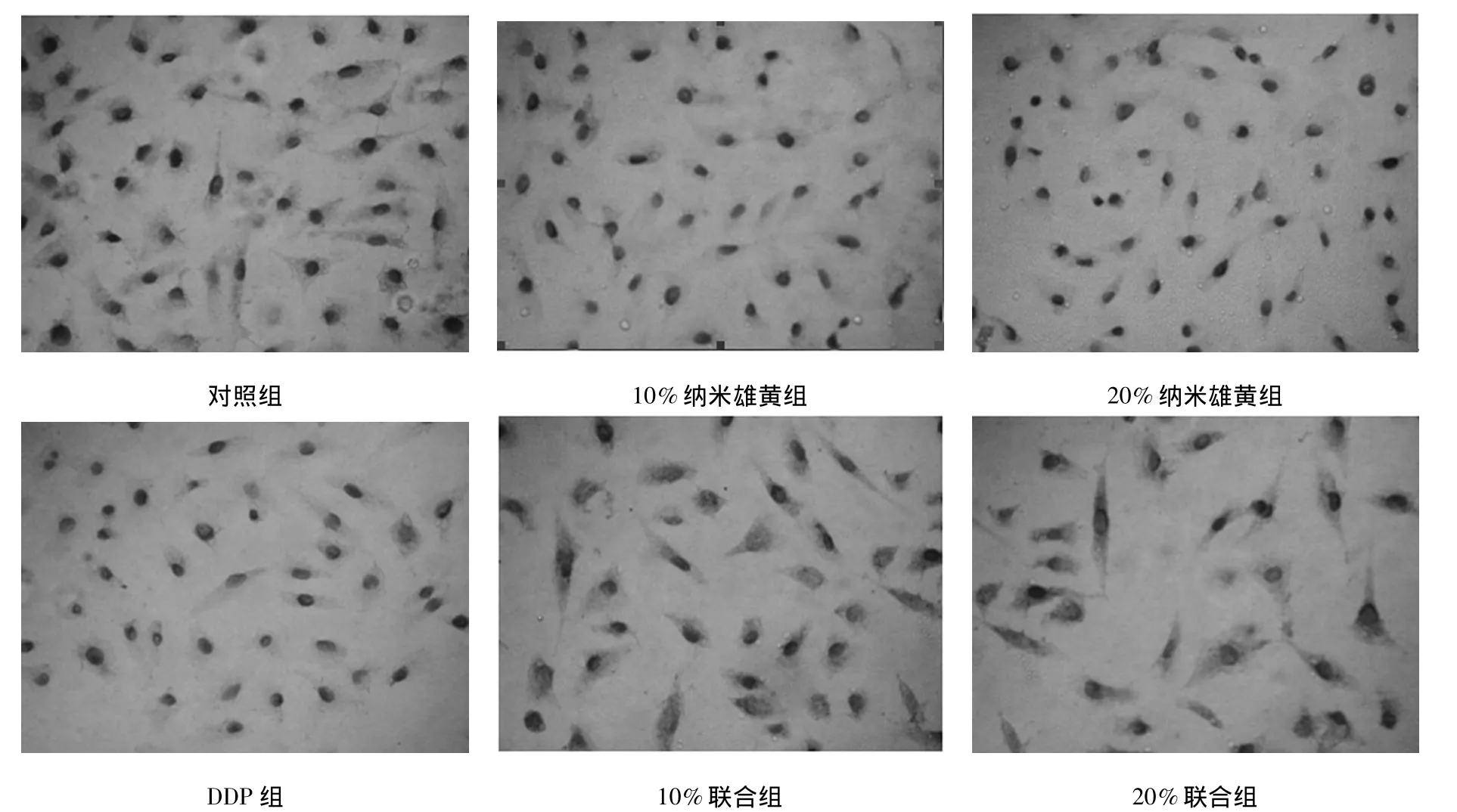
图2 HIF-1免疫组化结果(×20)
3 讨论
血管生成是肿瘤生长和转移的关键,血管生成的阻断是抑制肿瘤生长、转移的有效手段,近十年,随着人们对肿瘤血管生成机制的深入研究,实体瘤的抑制可通过抑制肿瘤血管生成来实现的说法已得到广泛认可〔3〕。目前比较受关注的血管生成促进因子有VEGF、HIF-1,二者均与诱导肿瘤微血管的形成有着密切的作用。VEGF是参与血管生成的主要正向调节因子,是目前发现肿瘤诱导产生血管网的最重要的细胞因子,它通过增加内皮细胞有丝分裂及迁移,重塑细胞外基质及增加血管通透性,从而调节病理性血管生成〔4〕。HIF-是存在于哺乳动物与人体内维持机体对缺氧的适应能力的一种转录因子,而肿瘤细胞常处于缺氧状态,HIF-1发挥转录和基因调控作用,通过诱导VEGF、EGF等肿瘤血管生成相关因子及其受体的表达,启动肿瘤新血管生成,改善组织氧供,同时也表明了HIF-1是肿瘤血管形成的核心调节因子〔5,6〕。中药具有毒性较小、用法比较灵活等优势,现代药理研究发现诸多中药具有抗肿瘤作用,雄黄是目前研究已表明具明显的抗肿瘤作用的中药之一,而采用纳米技术解决雄黄的难溶问题,不仅能提高其生物利用度和药效,还能增强对瘤细胞的靶向性及降低毒副作用〔7〕。
本实验说明纳米雄黄能显著降低VEGF与HIF-1在肺癌A549细胞中的表达,以减少肿瘤的血管生成。初步揭示纳米雄黄可能是通过下调VEGF、HIF-1的表达抑制肿瘤细胞血管生成来发挥抗肿瘤作用,其具体途径则有待进一步深入研究。
1 汤钊猷.现代肿瘤学〔M〕.上海:复旦大学出版社,2011:1070.
2 叶晓川,杨祥良,徐辉碧.纳米雄黄研究进展〔J〕.化学进展,2009;21(5):934-9.
3 曾益新.肿瘤学〔M〕.北京:人民卫生出版社,2008:516.
4 Ho QT,Kuo CJ.Vascular endothelial growth factor:biology and therapeutic applications〔J〕.Int J Biochem Cell Biol,2007;39(7):1349-57.
5 张素贞,张 凡,常永霞,等.宫颈癌不同部位HIF-1A、VEGF、p53表达对肿瘤血管生成作用的研究〔J〕.中国老年学杂志,2009;29(4):465-7.
6 Van de Sluis B,Mao X,Zhai Y,et al.COMMD1 disrupts HIF-1alpha/beta dimerization and inhibits human tumor cell invasion〔J〕.J Clin Invest,2010;120(6):2119-30.
7 杨 玥,陈 静,易 娟,等.纳米雄黄对肺癌A549细胞及其肿瘤干细胞的凋亡诱导作用〔J〕.中药药理与临床,2010;26(6):36-9.

