HO-1活性改变对肝癌细胞周期调控因子CKS1和Cyclin D的影响
高 涵 周 涛 陈宏月 张春晶 李淑艳
(齐齐哈尔医学院生物化学与分子生物学教研室,黑龙江 齐齐哈尔 161006)
细胞周期蛋白(Cyclin)D是细胞周期的启动因子,作用于G期,在细胞增殖中发挥着重要作用〔1〕。Cyclin依赖性激酶调节亚基(CKS)1是高度保守的细胞周期调节蛋白(SUCl/CDK)蛋白家族成员之一,能与其他周期蛋白依赖性激酶和磷酸化的蛋白结合,参与细胞周期的调控,与肿瘤的发生、发展密切相关〔2〕。血红素加氧酶(HO)是机体内血红素分解代谢过程中重要的限速酶,包括氧应激诱导型(HO-1)、组成型(HO-2)及尚未明确的HO-3〔3〕。HO-1与肿瘤增殖、凋亡、血管发生等生物学行为密切相关〔4〕。但是目前关于HO-1在肝癌细胞中如何调节细胞周期调控因子尚未见报道。本文对HO-1活性改变对肝癌细胞周期调控因子CKS1和Cyclin D的影响进行研究。
1 材料与方法
1.1主要材料 人肝癌细胞系HepG2细胞,由北京协和医学院细胞中心提供;脂质体Lipofectamine RNAi MAX、无血清培养基Opti-MEM,购自美国LIFE TECHNOLOGIES公司;胎牛血清,购自杭州四季青有限公司;噻唑蓝(MTT)试剂盒,购自美国Sigma公司;鼠抗人Cyclin D单抗、鼠抗人CKS1单克隆抗体、兔抗人HO-1单克隆抗体、兔抗人三磷酸甘油醛脱氢酶(GAPDH)单克隆抗体、辣根过氧化物酶标记的山羊抗兔IgG,购自美国SANTA CRUZ公司;RIPA裂解液、蛋白酶抑制剂,购自上海生工生物有限公司;二喹啉甲酸(BCA)蛋白浓度检测试剂盒,购自北京鼎国生物有限公司;Trizol试剂,购自美国PROMEGA公司;SYBR Green PCR Reagents,购自美国ABI公司。HO-1 siRNA及荧光标记的siRNA由AMBION公司化学合成(正义:5'-AACUUUCAGAAGGGCCAGGUGTT-3',反义:5'-CACCUGGCCCUUCUGAAAGUUTT-3')。HO-1、cyclin D 和 CKS1 的 PCR 引物由美国LIFE TECHNOLOGIES公司合成。HO-1引物,正义:5'-TCT CCA AAA TGC CAG AGG CG-3',反义:5'-AGG AAG TTG TTG GGG CTC CT-3',产物长度 452 bp;Cyclin D 引物,正义:5'-GGA CTT CGA GCA AGA GAT GG-3',反义:5'-AGC ACT GTG TTG GCG TAC AG-3',产物长度 196 bp;CKS1 引物,正义:5'-TAC CAC GCA GCA GAG TTT GA GT-3',反 义:5 '-AGC AAG ATG TGA GGT TCT GG TTC-3',产物长度170 bp;GAPDH引物,正义:5'-GGC ACA GTC AAG GCT GAG AA TG-3',反义:5'-ATG GTG GTG AAG ACG CCA GTA-3',产物长度 105 bp。
1.2主要仪器 CO2恒温培养箱,购自美国SHELAB;EXL808全自动酶标仪,购自美国BIO-TEK公司;ABI 7500 Real Time PCR System,购自美国ABI公司;KodaK4000 MM显像系统,购自美国CARESTREAM HEALTH公司。
1.3细胞培养 HepG2细胞在37℃、5%CO2、饱和湿度的恒温培养箱内培养,培养液为含10%胎牛血清、丙酮酸钠(20 000 U/L)、谷氨酰胺(20 000 U/L)、青霉素(200 000 U/L)和链霉素(0.02 g/L)的MEM培养基,隔天换液,胰蛋白酶消化后进行传代。
1.4细胞转染 将生长状态良好的细胞以6×105/孔接种于6孔板中,将细胞分为转染组、阴性对照组和空白对照组,每组设6个复孔。各组细胞融合度达到80% 进行转染实验,按Lipofectamine 2000试剂盒操作说明书配制质粒和脂质体复合物,转染体系为 200 μl,每孔体积为 500 μl,转染后继续放入 37℃、5%CO2、饱和湿度的恒温培养箱内进行培养,同时设空白对照组和阴性对照组,空白对照组采用培养基代替转染体系,阴性组加入阴性对照表达载体。转染6 h后换为含10%胎牛血清、丙酮酸钠(20 000 U/L)、谷氨酰胺(20 000 U/L)、青霉素(200 000 U/L)和链霉素(0.02 g/L)的MEM培养基继续培养。1.5MTT法测定各组细胞增殖情况 各组细胞转染20 h或44 h时每孔加20 μl浓度为5 mg/ml的MTT继续培养4 h,每孔加入150 μl二甲基亚砜溶解结晶,置摇床上低速振荡10 min后在酶标仪490 nmol/L处测量各孔的吸光度(A)值。
1.6RT-PCR各组细胞HO-1、CKS1和Cyclin D的表达 各组细胞转染48 h后按照说明书提取试剂盒制备总RNA。取RNA样品,用核酸分析仪进行定量,测定260 nm和280 nm的吸光度(A)值,控制 A260/A280在1.9~2.1。RT-PCR按照 SYBR Green PCR Reagents说明书应用ABI 7500 Real Time PCR System进行扩增。扩增反应条件:95℃预变性2 min,94℃ 45 s,64.5℃ 90 s,72℃ 60 s,45 个循环,最后在72℃延长10 min。使用基于内参物GAPDH的相对定量分析,目的基因mRNA表达量用2-⊿⊿Ct计算转录水平的差异。
1.7Western印迹检测CKS1的表达 各组细胞转染后48 h,0.25%胰酶消化细胞并收集至EP管并加入蛋白酶抑制剂。各孔加入RIPA细胞裂解液,收集细胞,离心10 min,用预冷磷酸盐缓冲液(PBS)洗涤,超声切割30 s后4℃ 12 000 r/min离心10 min,取上清,采用BCA蛋白定量法测各组蛋白浓度。取30 μg总蛋白进行十二烷基硫酸钠聚丙烯酰胺凝胶垂直电泳。电泳后半干转至聚丙烯酰胺凝胶,用5%脱脂奶粉室温封闭1 h后,加入HO-1、CKS1和Cyclin D抗体孵育,4℃过夜。室温下PBS洗膜3次,加入辣根过氧化物酶标记的IgG室温孵育60 min,洗膜缓冲液洗膜3次,进行化学发光,显影、定影。上述反应以β-actin作为内参照,以目标蛋白灰度值与内参灰度值的比值作为其蛋白表达量。
1.8统计学方法 应用SPSS15.0软件进行分析,计量资料以s表示,采用单因素方差分析比较各组间数据差异。
2 结果
2.1各组细胞增殖情况的比较 MTT实验结果显示,HO-1 siRNA转染组细胞转染后24 h和48 h的吸光度较空白对照组显著降低(P<0.01),而空白对照组和阴性对照组比较差异无统计学意义(P>0.05)。因此,HO-1 siRNA转染后HepG2细胞增殖能力显著降低,转染后培养24 h或48 h时增殖能力分别较空白对照组降低37.38%和40.54%。见图1。
2.2各组细胞HO-1、CKS1和Cyclin D mRNA表达的比较HO-1 siRNA转染组细胞转染后48 h的HO-1、CKS1和Cyclin D mRNA水平较空白对照组显著降低(P<0.01),而空白对照组和阴性对照组比较差异无统计学意义(P>0.05)。因此,HO-1 siRNA转染后HepG2细胞HO-1、CKS1和Cyclin DmRNA水平显著降低,转染后培养48 h时HO-1、CKS1和Cyclin D mRNA分别较空白对照组降低68.51%、21.18%和41.10%。见图2。
2.3各组细胞HO-1、CKS1和Cyclin D蛋白表达的比较 HO-1 siRNA转染组细胞转染后48 h的HO-1、CKS1和Cyclin D蛋白水平较空白对照组显著降低(P<0.01),而空白对照组和阴性对照组比较差异无统计学意义(P>0.05)。因此,HO-1 siRNA转染后HepG2细胞HO-1、CKS1和Cyclin D蛋白水平显著降低,转染后培养48 h HO-1、CKS1和Cyclin D蛋白分别较空白对照组降低65.67%、23.08%和40.47%。见图3。

图1 各组细胞增殖情况的比较
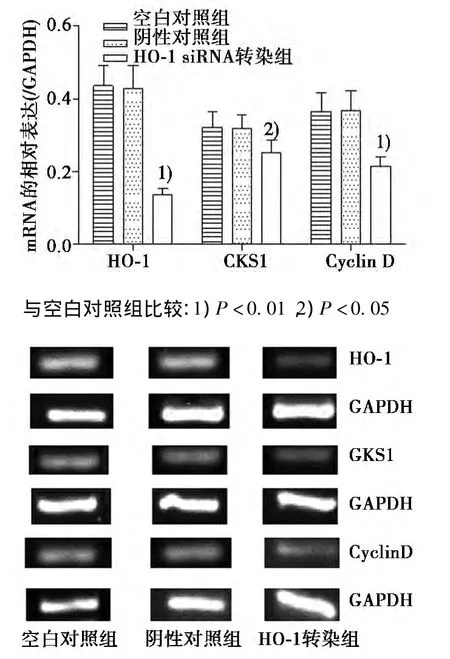
图2 各组细胞HO-1、CKS1和Cyclin D mRNA的表达

图3 各组细胞HO-1、CKS1和Cyclin D蛋白表达的比较
3 讨论
肝细胞癌(HCC)是最常见的恶性肿瘤之一,全球发病率居第5位,死亡率居第3位,我国是乙型肝炎大国,肝癌发病人数约占全球的55%,发病率居我国恶性肿瘤第2位〔5〕。由于肝癌早期诊断缺乏有效手段,导致肝癌发现时多数已是中晚期,5年生存率仅为7%〔6〕,探索更加有效的肝癌治疗方案仍是目前肝癌研究的主要目标。HCC的发生是一个多阶段、多步骤、逐渐演变的过程。近几年越来越多的研究表明HO-1参与癌症的发生发展〔7〕。HO-1 在胃腺癌、胶质瘤、乳腺癌等的高表达〔8~10〕。HO-1的过表达与恶性肿瘤的发展和预后密切相关,但目前还没有定论。现已发现癌基因和抑癌基因作用的归结点均在于对细胞周期的调控。实验研究表明,HO-1及其分解产物能影响正常细胞和某些癌细胞的细胞周期〔11〕。但是在肝癌细胞中HO-1如何调节细胞周期调控因子却鲜有报道。
CKS1是周期蛋白依赖性激酶复合物的亚基,是高度保守的细胞周期调节蛋白SUCl/CDK家族成员之一,可以与细胞周期蛋白依赖性激酶相互作用,促进泛素化Cyclin-Cdk抑制蛋白p27kipl的降解,使细胞停滞在G1期,实现其细胞调控功能,从而抑制细胞增殖并促进细胞凋亡,最终抑制肿瘤的发生。研究证明,CKS1在多种类型的肿瘤中过表达,是潜在的肿瘤细胞辐射敏感性调节靶点〔12〕。CKS1在老年HCC组织中的表达与肿瘤细胞的分化程度明显相关,提示CKS1在肝癌的发生发展中可能起着重要的协同作用〔13〕。Cyclin是参与细胞周期调控的主要因子,Cyclin D是一种重要的G1/S期正性调控分子,其基因的结构或功能异常与肿瘤的发生、发展密切相关。原癌基因Cyclin D成于G1早期,是细胞增殖G1-S期的重要控件。已发现多种肿瘤中都有Cyclin D高表达,Cyclin D过调节细胞周期使之始终处于旺盛分裂状态,细胞能够不断分裂增殖而最终形成肿瘤〔14〕。本研究说明HO-1 siRNA转染后肝癌HepG2细胞增殖能力显著降低,因此降低HO-1的活性可显著抑制HepG2细胞的增殖能力。另外,HO-1 siRNA转染可显著抑制肝癌HepG2细胞周期调控因子CKS1和Cyclin D表达,因此推测HO-1对肝癌细胞HepG2增殖作用的影响是通过调控细胞周期因子CKS1和Cyclin D表达而实现。
综上所述,HO-1的活性降低可抑制肝癌HepG2细胞的增殖,其调控作用可能通过降低HepG2细胞CKS1和Cyclin D表达而实现。
1 张有福,董秀山,闫曙光,等.熊去氧胆酸对大鼠肝再生和细胞周期蛋白D1表达的影响〔J〕.中华实验外科杂志,2010;27(7):898-9.
2 刘晓丽,马礼鸿,王全义.乳腺癌组织中CKSl和Cyclin D1的表达及相关分析〔J〕.重庆医科大学学报,2013;38(1):54-7.
3 Gozzelino R,Jeney V,Soares MP.Mechanisms of cell protection by heme oxygenase-1〔J〕.Annu Rev Pharmacol Toxicol,2010;50(3):323-54.
4 刘立青,张 黎,程 力,等.HO-1与肿瘤的发生发展〔J〕.中国现代普通外科进展,2010;13(1):57-9.
5 樊 嘉,王 征.肝移植治疗原发性肝癌的现状〔J〕.肝胆外科杂志,2011;19(5):321-3.
6 Sun Y,Yang H,Mao Y,et al.Increased golgiprotein 73 expression inhepatocellular carcinoma tissue correlates with tumor aggression but not surviva1〔J〕.J Gastroenterol Hepatol,2011;26(7):1207-12.
7 Hirai K,Sasahira T,Ohmori H,et al.Inhibition of heme oxygenase-1 by zinc protoporphyrin IX reduces tumor growth of LL/2 lung cancer in C57BL mice〔J〕.Int J Cancer,2007;120(3):500-5.
8 赵玲俊,王丽华,刘丽娜.HO-1在胃腺癌中的表达〔J〕.中国现代医生,2011;49(32):93-5.
9 Liu Y,Liang Y,Zheng T,et al.Inhibition of heme oxygenase-1 enhances anti-cancer effects of arsenic trioxide on glioma cells〔J〕.J Neurooncol,2011;104(2):449-58.
10 Hirai H,Kubo H,Yamaya M,et al.Microsatellite polymorphism in heme oxygenase-1 gene promoter is associated with susceptibility to oxidantinduced apoptosis in lymphoblastoid cell lines〔J〕.Blood,2003;102(5):1619-21.
11 Abraham NG,Scapagnini G,Kappas A.Human heme oxygenase:cell cycle-dependent expression and DNA microarray identification of multiple gene responses after transduction of endothelial cells〔J〕.J Cell Biochem,2010;90(6):1098-111.
12 张珠博,张仲健,魏 超.Cksl表达对人食管癌EC9706细胞辐射敏感性的影响〔J〕.中华放射医学与防护杂志,2013;33(6):574-7.
13 张秀梅,顾金松,刘 曙,等.Cks1在老年肝细胞癌中的表达及临床意义〔J〕.中国肿瘤外科杂志,2013;5(4):239-40.
14 Lassmann S,Schuster I,Walch A,et al.STAT3 mRNA and protein expression in colorectal cancer:effects on STAT3-inducible targets linked to cell survival and proliferation〔J〕.J Clin Pathol,2007;60(2):173-9.

