ALDH1作为卵巢癌干细胞标志物的实验研究
范秀丽 卞翠翠 董 怡 杨 雷 姜 艳 岳 清 陈涛利 刘子玲
(吉林大学第一医院肿瘤中心,吉林 长春 130021)
肿瘤干细胞(CSC)在肿瘤细胞中所占比例极少,具有自我更新和多向分化潜能、高致瘤性、放化疗抵抗性以及高侵袭性,可导致肿瘤复发转移〔1,2〕。除常用的CD44、CD117和CD133等CSC表面标志外,乙醛脱氢酶1(ALDH1)日益受到关注。近年来研究发现ALDH1可作为肺癌、视网膜母细胞瘤、胰腺癌、乳腺癌、前列腺癌、结肠癌及头颈部癌等多种 CSC 标志〔3,4〕,ALDH1作为卵巢癌干细胞的标志及其临床意义的研究较少,本研究以卵巢癌细胞株(SKOV3)细胞为研究对象,研究 ALDH1在卵巢癌中的作用。
1 材料与方法
1.1 材料 Aldefluor试剂、表皮生长因子(EGF)、成纤维生长因子(bFGF)、B27、CD133、顺铂。人卵巢癌SKOV3细胞株由本实验室传代保存。
1.2 方法
1.2.1 人卵巢癌SKOV3细胞的培养 卵巢癌 SKOV3细胞株为贴壁生长细胞,培养条件为含10%胎牛血清的RPIM-1640培养液,37℃、含5%CO2、饱和湿度的培养箱中培养,平均2~3 d换液、传代1次。取对数生长期细胞,0.25%胰蛋白酶(含0.01%EDTA)消化,当大量细胞变圆,细胞间隙变大时加入完全培养液终止消化,用吹打管轻轻吹打细胞,离心后重悬,使细胞为单细胞悬液状态,用于实验。
1.2.2 人卵巢癌悬浮细胞球的培养 取对数生长期 SKOV3细胞,0.25%胰蛋白酶(含0.01%EDTA)消化,无血清培养液(SFM)重悬,制成单细胞悬液,取2×105个细胞,接种于无血清加细胞因子(DMEM/F12+B27+EGF+bFGF)培养液。取6~7 d生长的细胞球,离心后0.25%胰蛋白酶(含0.01%EDTA)消化,进行第2、3、4代传代,观察计数。
1.2.3 四甲基偶氮唑蓝比色法(MTT)检测卵巢癌SKOV3细胞及悬浮细胞球的体外增殖能力 取对数生长期卵巢癌SKOV3细胞及第2代培养6~7 d的悬浮细胞球,0.25%胰蛋白酶消化,重悬细胞,接种于96孔板。同时设置只加培养液的空白对照孔调零。共 7 块培养板分别标记 1、2、3、4、5、6、7 d。按照标记每天取1块板,每孔加入20 μ(15 mg/ml)的MTT。37℃恒温箱中继续培养4 h后终止培养,加样器小心吸弃孔内培养基。加入二甲基亚砜(DMSO)150 μl,室温摇床振荡10 min,使结晶物充分溶解。以空白对照孔调零,酶标仪上490 nm测定各孔吸光度值(OD值),以相对应OD比值表示细胞增殖能力大小,各细胞亚群取8孔平均值。重复3次,绘制生长曲线,比较悬浮细胞球及SKOV3细胞体外增殖能力。
1.2.4 平板克隆形成实验 取SKOV3细胞及第2代培养至第6~7天的悬浮细胞球,制备单细胞悬液,每孔200个细胞接种到6孔板中,每种细胞接种2孔。十字形轻轻摇动培养板,使细胞分散均匀,加入完全培养液。将培养板置于37℃、含5%CO2、饱和湿度的培养箱中培养2 w,待出现肉眼可见的克隆时终止培养。弃去培养液,磷酸盐缓冲液(PBS)冲洗2遍,室温下干燥。甲醛固定15 min,弃去甲醛,干燥后用结晶紫染液染色5 min,流水缓慢洗去染液,干燥后显微镜下计数形成的克隆数(50个细胞为一个克隆)。实验重复3次。按公式(平板克隆形成率=形成克隆数/接种细胞数 ×100%)计算平板克隆形成率。
1.2.5 Transwell侵袭实验 用同样方法制备单细胞悬液后接种细胞:在24孔板下室中加入含10%胎牛血清的完全培养基600 μl,放入已铺胶的小室。加 200 μl细胞悬液于内室,于37℃、含5%CO2培养48 h。取出小室,用棉签轻轻擦掉未穿过膜的细胞,小室底膜下室侧附着的细胞用结晶紫染色。显微镜下随机选取5个高倍视野计数穿过膜的细胞数。重复3次。
1.2.6 Hoechst33342染液和Aldefluor染液双染 取对数生长期SKOV3细胞,0.25%胰蛋白酶(含 0.01%EDTA)消化,1 000 r/min离心后重悬。盖玻片置于6孔板中,2×105个细胞沿6孔板的侧壁缓慢将细胞接种于板中,保证细胞均匀分散,加入培养液,过夜待细胞爬满盖玻片。弃去培养液,PBS缓冲液冲洗2次,然后加入Hoechst44432染液,终浓度为10 μg/ml,避光,37℃孵育 15 min后弃去染液。Aldefluor试剂盒专用buffer冲洗 2次,加入 10 μl Aldefluor染色剂,37℃避光孵育45 min。暗室冰上弃去培养液,4℃PBS冲洗2次。封片,激光共聚焦显微镜观察。
1.2.7 流式细胞仪检测 SKOV3细胞及悬浮细胞球 ALDH1high、CD133的表达 取对数生长期SKOV3细胞及传至第2代生长至第6~7天悬浮细胞球,胰蛋白酶消化后1 000 r/min离心,4℃PBS冲洗2次,调整细胞数为1×106/ml。取 EP管,分别标记SKOV3细胞组和悬浮细胞球组及各自对应的实验组和对照组,取1×106个细胞加入相应的 EP管中,各实验组加入5 μl CD133抗体,对照组不加,室温避光,孵育 30 min后,PBS冲洗1遍,置于冰上,待流式仪检测。另外取离心后细胞,Aldefluor buffer重悬,调整细胞数为 1×106/ml,同样标 SKOV3细胞组和悬浮细胞球组,并分别标记实验组及对照组。在实验组EP管中分别加入1 ml细胞悬液,在对照组 EP管中加入5 μl对二乙氨苯甲醛(DEAB)抑制剂,迅速盖好 EP管的盖子(DEAB溶解于95%的酒精里,应防止挥发)。实验组中加入5 μl活化的 Aldefluor,混匀后,立即转移 0.5 ml混合液到对照组中(加 DEAB的试管)。因ALDH酶促反应迅速,在加入 Aldefluor试剂后应立即转移0.5ml到加DEAB的对照EP管中。将实验组和对照组EP管37℃孵育45 min后,1 000 r/min离心5 min。弃去上清液,Aldefluor缓冲液重悬细胞,后置于冰上。待流式细胞仪分析ALDH1high细胞比例。
1.2.8 体外化疗实验 取对数生长期卵巢癌SKOV3细胞,分别标记实验组和对照组,在实验组加入1 mg/ml的顺铂,培养72 h后撤药。对照组加入相同体积的 PBS。撤药后,PBS冲洗3次,0.25%胰蛋白酶消化液将细胞消化下来计数,实验组和对照组分别取1×106个细胞,接种于培养瓶,完全培养基继续培养48 h。培养结束后,0.25%胰蛋白酶(含0.01%EDTA)消化后,按1.2.7步骤进行 Aldefluor、CD133标记,流式细胞仪检测。
1.3 统计学方法 应用SPSS17.0软件进行分析,数据以s表示,两组间比较采用t检验。
2 结果
2.1 卵巢癌SKOV3细胞悬浮球 卵巢癌 SKOV3细胞,在体外贴壁上皮样生长,短梭形,可伸出不规则树突样伪足,胞浆内可见空泡样颗粒。取对数生长期卵巢癌SKOV3细胞接种于无血清加细胞因子培养基中,大多数细胞死亡,小部分细胞悬浮生长,并很少数细胞贴壁生长,但随着培养天数增加贴壁细胞消失。3~4 d可见少量细胞组成的悬浮细胞球,球体较少,其大小不等,形态不规则,细胞结合松散;第6~7天,悬浮细胞球增多,细胞结合紧密,球体增大,折光性好,形态变得规则。悬浮细胞球经0.25%的胰蛋白酶(含 0.01%EDTA)消化3min后,重悬于SFM中培养,3~4 d左右仍可见不规则细胞球形成,6~7 d细胞球形态较规则,可以多次传代培养。见图1。
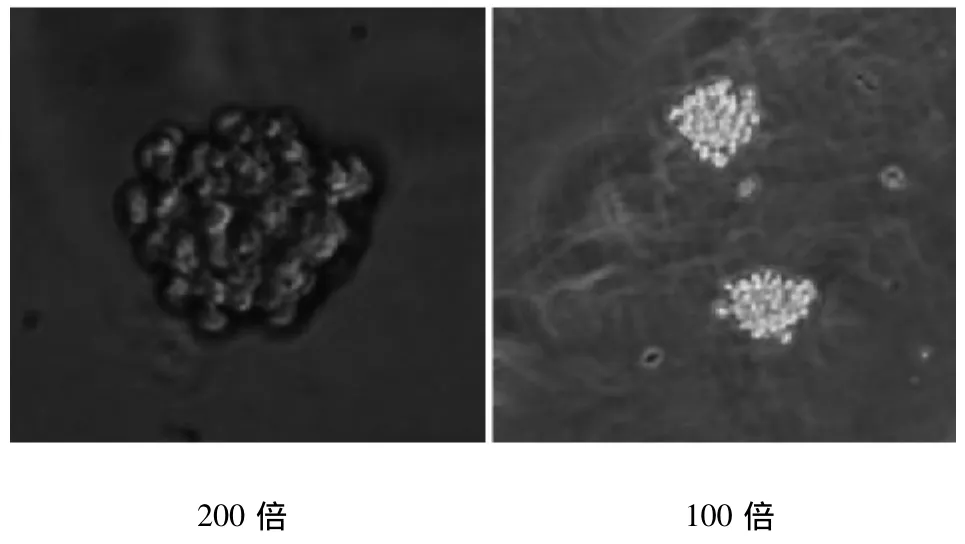
图1 无血清培养的卵巢癌SKOV3悬浮细胞球
2.2 增殖克隆能力分析 MTT实验和平板克隆实验检测卵巢癌SKOV3细胞及悬浮细胞球的自我增殖及克隆形成能力。连续检测悬浮细胞球和SKOV3细胞7 d的OD值,第1~2天,OD值差异无统计学意义(P>0.05),第3天开始OD值差异有统计学意义(P<0.05)。平板克隆实验结果:细胞在6孔板中培养约2 w后,显微镜下观察多数细胞克隆数>50,按公式:平板克隆形成率=形成克隆数/接种细胞数×100%,计算克隆形成率,悬浮细胞球和SKOV3细胞的克隆形成率分别为35.23±5.89%、20.32±6.42%。两组细胞克隆形成率差异有统计学意义(P<0.05)。见表1。
表1 MTT检测悬浮细胞球和SKOV3细胞7 d的OD值(s)
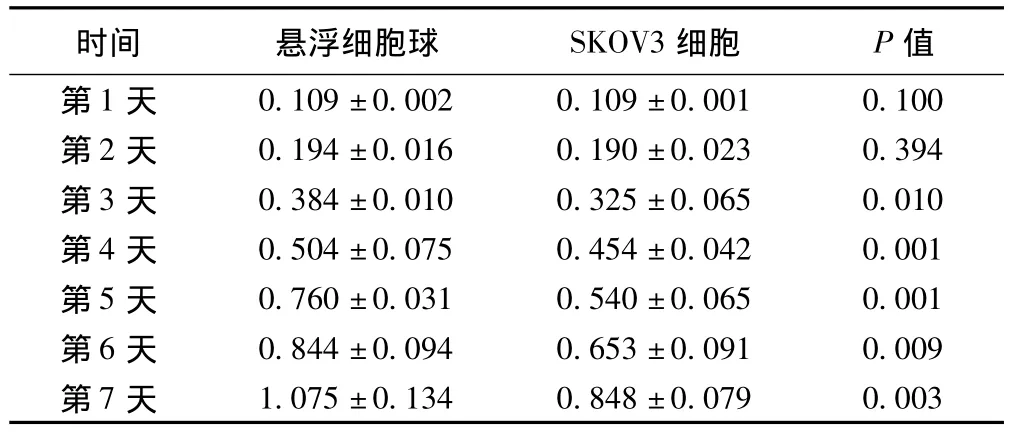
表1 MTT检测悬浮细胞球和SKOV3细胞7 d的OD值(s)
时间 悬浮细胞球 SKOV3细胞 P值0.109±0.002 0.109±0.001 0.100第2天 0.194±0.016 0.190±0.023 0.394第3天 0.384±0.010 0.325±0.065 0.010第4天 0.504±0.075 0.454±0.042 0.001第5天 0.760±0.031 0.540±0.065 0.001第6天 0.844±0.094 0.653±0.091 0.009第7天第1天1.075±0.134 0.848±0.079 0.003
2.3 侵袭能力分析 通过Transwell侵袭实验检测悬浮细胞球细胞及SKOV3细胞的侵袭能力,任选5个高倍镜视野计数结果显示:悬浮细胞球细胞穿过膜数为237±37.42,SKOV3细胞穿膜数为87.8±32.13,差异有统计学意义(P<0.05)。
2.4 激光共聚焦显微镜观察卵巢癌SKOV3细胞中的ALDH1表达 倒置显微镜下,SKOV3细胞成多角梭形,少数细胞中可见多核,核质比例增大,ALDH1定位于 SKOV3细胞的胞质,镜下可见多数 SKOV3细胞胞质为绿色荧光,但荧光强度很弱;ALDH1活性越高,其胞质内产生的荧光底物就越多,细胞荧光强度就越强。经Hoechst 33342和 Aldeflour双染后,SKOV3细胞轮廓清晰,胞质区和细胞核区荧光强弱对比明显。SKOV3细胞核经 Hoechst 33342染色后显示为蓝色荧光,而 ALDH1high细胞核不被染色。
2.5 流式细胞仪检测 ALDH1high细胞、CD133+细胞比例 应用Aldeflour试剂流式细胞技术分析卵巢癌SKOV3细胞及悬浮细胞球结果显示,ALDH1high细胞为绿色荧光,在卵巢癌SKOV3细胞中所占比例较低,仅占4.08±0.29%,CD133+细胞比例为1.21±0.34%。无血清悬浮培养传至第2代培养6~7 d悬浮细胞球流式检测结果显示,ALDH1high细胞的比例为 22.42±2.42%,CD133+细胞比例为10.34±0.17%,在悬浮细胞球中ALDH1high细胞、CD133+细胞比例明显增高,与普通培养的 SKOV3细胞相比差异有统计学意义(P<0.05)。
2.6 体外化疗实验 顺铂连续作用于卵巢癌SKOV3细胞72 h后撤药,10%胎牛血清完全培养基继续培养48 h后流式检测结果发现,ALDH1high、CD133+细胞比例明显增加,分别为17.25% ±3.26%和4.04% ±0.86%,ALDH1high细胞比例增加了3.23倍,CD133+细胞比例增加了2.34倍,与对照组相比差异有统计学意义(P<0.05)。
3 讨论
ALDH1属ALDH家族之一。人类的ALDH1基因表达存在于细胞质中,其基因定位于9q21染色体,是催化细胞内乙醛氧化为乙酸的细胞溶质酶,并通过氧化视黄醇为视黄酸参与多种组织的分化与基因表达。研究显示ALDH1在多种组织类型的CSC高表达,而高表达ALDH1的细胞具有干细胞的特性。目前,ALDH1已作为功能性标志物应用于多种实体CSC的分离和鉴定,证实了ALDH1在肿瘤生物学行为中发挥着重要作用。
Martens等〔5〕利用无血清加EGF和bFGF的培养基培养正常脑组织中神经干细胞,发现 bFGF反应性细胞在 bFGF作用下进行自我更新,并生成具有EGF反应性的干细胞,而EGF反应性干细胞在EGF作用下进行自我增殖,并通过不对称分裂来生成具有bFGF反应性的神经干细胞,因此只有干细胞才能在SFM中生长,而大部分细胞死亡。
依据卵巢癌干细胞不同的标志及干细胞特性在卵巢癌组织、腹水和卵巢癌细胞系中均分离出了干细胞样细胞,现在文献报道的可作为卵巢癌干细胞标志物有CD133、CD44、CD117、CD24等。ALDH1在多种CSC中高表达,ALDH1首先被用于白血病干细胞的分离与鉴定〔6〕。Landen等〔7〕研究证实 ALDH1在卵巢肿瘤组织及细胞系中均有表达,卵巢癌细胞系中分离出的ALDH1+细胞比阴性细胞更具有化疗抵抗性及致瘤性。另外一项研究证实在紫杉醇和顺铂耐药的细胞中 ALDH1高表达,在卵巢癌耐药A2780细胞株中分离出的ALDH1+阳性细胞的致瘤能力是ALDH1-细胞的50倍,ALDH1+细胞可产生ALDH1+和 ALDH1-细胞,而 ALDH1-细胞却不能产生 ALDH1+细胞〔7〕,这些特性与CSC的特性一致。Silva研究发现 ALDH联合CD133能更加有效的分离卵巢癌干细胞,ALDH+CD133+细胞比ALDH+CD133-细胞具有更强的异体移植成瘤能力,且ALDH+CD133+细胞可分化为 ALDH+/-CD133+/-四种类型的细胞,而无论来自肿瘤组织或者是细胞系的CD133-细胞均不能分化为CD133+细胞〔8〕。本研究结果显示ALDH1high细胞比例是CD133+细胞比例的2倍以上。悬浮细胞球高表达CSC标志CD133,因此说明了悬浮细胞球富集了大量干细胞,本研究为悬浮细胞球中干细胞数量提供了实验依据。无论是CD133+细胞还是ALDH1high细胞均在悬浮细胞球中富集,说明ALDH1high细胞和CD133+细胞一样,可作为卵巢癌干细胞的标志。
ALDH1不仅可作为CSC的标志,而且还提示预后不良,与肿瘤细胞耐药有一定的关系。Kryczek等〔9〕通过基因敲除发现,在肺癌细胞中 ALDH1A1和 ALDH3A1与环磷酞胺耐药有关。而卵巢癌细胞系中敲出ALDH1基因可以恢复肿瘤细胞对化疗的敏感性〔10〕。通过分析多种卵巢癌细胞系发现,在紫杉醇和铂类耐药细胞株中 ALDH1高表达,并且在临床标本中ALDH1阳性细胞数量与患者无进展生存期呈负相关〔7〕。本研究结果可知ALDH1high细胞和CD133+细胞比阴性细胞更具生存能力,因此化疗后 ALDH1high细胞和 CD133+细胞得到富集。ALDH1high细胞比例增加幅度高于 CD133+细胞,这可能提示ALDH1high细胞耐药性高于CD133+细胞,也可能提示在卵巢癌干细胞分化等级中 ALDH1high细胞和CD133+细胞处于不同等级,但仍需更多的研究证实。
1 Siegel R,Naishadham D,Jemal A.Cancer statistics,2012〔J〕.Ca Cancer J Clin,2012;62(1):10-29.
2 Jiang F,Qiu Q,Khann A,et al.Aldehyde dehydrogense 1 is a tumor stem cell-associated maker in lung cancer〔J〕.Mol Cancer Res,2009;7(3):330-8.
3 邹爱梅.ALDH1可能作为肺癌干细胞的功能性标志物〔D〕.广州:南方医科大学硕士论文,2008.
4 Chen YC,Chen YW,Hsu HS,et al.Aldehyde dehydrogenase1 is aputative marker for cancer stem cells in head and neck squamous cancer〔J〕.Biochem Biophys Res Commun,2009;385:307-13.
5 Martens DJ,Tropepe V,Kooy D.Separate proliferation kinetics of fibroblast growth factor responsive and epidermal growth factor-responsive neural stem cells within the embryonic forebrain germinal zone〔J〕.J Neurosci,2000;20(3):1085-95.
6 Hess DA,Meyerrose TE,Wirthlin L,et al.Functional characterization of highly Purified human hematopoietic repopulating cells isolated according to aldehyde dehydrogenase activity〔J〕.Blood,2004;104(6):1648-55.
7 Landen CN,Goodman B,Katre AA.et al.Targeting aldehyde dehydrogenase cancer stem cells in ovarian cancer〔J〕.Mol Cancer Ther,2010;9(12):3186-99.
8 Silva IA,Bai S,McLean K,et al.Aldehyde dehydrogenase in combination with CD133 defines angiogenic ovarian cancer stem cells that portend poor patient survival〔J〕.Cancer Res,2011;71(11):3991-4001.
9 Kryczek I,Liu S,Roh M,et al.Expression of aldehyde dehydrogenase and CD133 defines ovarian cancer stem cells〔J〕.Int J Cancer,2012;130(1):29-39.
10 Yip NC,Fombon IS,Liu P,et al.Disulfiram modulated ROS-MAPK and NFkappaB pathways and targeted breast cancer cells with cancer stem cell like properties〔J〕.Br J Cancer,2011;104(10):1564-74.

