经Bcl-2修饰的同种异体骨髓间充质干细胞移植对兔心肌梗死后心功能不全的影响
王 曼 李树仁 高 青 齐晓勇 党 懿 张飞飞 荀丽颖
(河北医科大学附属河北省人民医院,河北 石家庄 050051)
随着溶栓和急诊冠脉介入的广泛开展,急性心肌梗死的死亡率已降至5%左右。但是心肌梗死后心室重构和缺血性心肌病的发生严重影响了心肌梗死患者的预后。使心肌细胞再生乃至衰竭的心脏恢复功能仍是一项巨大的挑战。基础及临床试验均提示骨髓间充质干细胞(BMSCs)可参与受损心肌的重建,可以提高左室射血分数(LVEF),降低左心室收缩末期和舒张末期容积、减少梗死面积并改善左室重构〔1,2〕。但是BMSCs在梗死心肌中的长期存活仍未能解决〔3〕。心肌梗死后微环境的改变限制了干细胞的修复能力,本文采用Bcl-2基因修饰的BMSCs移植,作为提高移植细胞存活率的手段,以达到BMSCs移植进一步增强其抑制心室重构,改善心梗后心功能的作用。
1 材料方法
1.1 主要试剂和仪器 Percoll细胞分离液(Pharmacia公司,美国);低糖DMEM培养基和胎牛血清(Hyclone公司,美国);腺病毒(由汉恒生物技术有限公司合成);生物安全柜(Heal Force-1200,中国);倒置显微镜(Olympus-ck30,日本);细胞培养箱(Heraeus Fzsw-BB15,德国);荧光显微镜(Leica DMI3000,德国);超声仪(Vividi,美国);Trizol Reagent(Invitrogen公司,美国);反转录试剂盒(Promega公司,美国);荧光定量试剂盒 Hot Start Fluorescent PCR Core Reagent Kits(SYBR Green I)(BBI公司,美国);7300实时定量 PCR仪(ABI公司,美国)。
1.2 方法
1.2.1 BMSCs细胞分离、培养 无菌条件下采集兔(3月龄)股骨骨髓(4~5 ml),肝素抗凝(300 U/ml),用DMEM培养液适当稀释样品,按照1∶1的比例将上述细胞悬液缓慢滴加到Percoll细胞分离液中(密度1.073 g/ml),2 000 r/min 离心20 min。取位于中间的乳白色云雾状的单个核细胞层,加入培养液稀释混匀,离心洗涤2遍,用含10%胎牛血清的DMEM培养液重悬细胞,以2.0×105个/cm2的细胞密度接种于培养瓶中,置37℃、5%CO2饱和湿度的培养箱内培养。48 h后弃掉未贴壁细胞,更换新鲜培养液,以后每3天换液一次,细胞长到80%融合时,用0.25%的胰蛋白酶消化,按1∶2传代进行扩增培养〔4〕。
1.2.2 细胞转染
1.2.2.1 预实验 实验分为两组(腺体病毒载体和等滴度同体积的对照病毒载体)。每组均有不同梯度的感染复数(MOI),感染36~48 h观察感染情况,确定最佳MOI均为500。
1.2.2.2 Bcl-2正式转染BMSCs 取生长状态良好的第9代BMSCs,消化后以3×105个/ml细胞密度接种于培养瓶中,置于37℃、5%二氧化碳饱和湿度培养箱中培养24 h后倒掉细胞培养基,以PBS冲洗3次,于培养瓶中加入无血清培养基1 ml,再加入含Ad-EGFP-Bcl-2或Ad-EGFP的病毒液(MOI=500)转染MSCs,转染2 h内每隔15 min摇晃1次。2 h后倒掉转染的病毒液,以PBS冲洗培养瓶后加入含10%FBS培养基继续培养,细胞转染后72 h移植入动物体内。
1.2.3 心肌梗死后心功能不全模型制作 选用24只体重3.0 kg左右的新西兰家兔,雄性,河北医科大学实验动物中心提供〔动物中心许可证号为SCXK(冀)2008-1-03〕。3%戊巴比妥钠静脉麻醉(1 ml/kg),仰卧固定于手术台上,20 min后测定心电图,将针形电极插入皮下1 cm,采用针形电极插入四肢和胸部皮下,标准导联和aVR、aVL、aVF单极加压肢体导联的连接方法与人基本相同,胸导联取V1、V3、V5。定准电压为1 mV=10 mm(10小格),纸速25 mm/s。常规消毒、铺巾。剪开胸部左侧皮肤,钝性分离皮下组织及肌肉至肋骨。沿胸骨左缘切断第3、4、5肋骨。放置开胸器暴露心包。打开心包,暴露左冠状动脉前降支,在中段处用丝线结扎,可以见到心尖部及部分左室前壁心肌变紫〔5,6〕。逐层关胸。再次记录心电图。
1.2.4 细胞移植 建模14 d后再次开胸。选取心肌梗死周边区域4个注射点分别将 600 μl的含1.0 × 107个BMSCs(Ad-EGFP-Bcl-2-BMSCs和Ad-EGFP-BMSCs)悬液注入梗死灶边缘区域;DMEM组注射等体积的无血清DMEM。
1.2.5 心脏超声 采用Vivid i超声心动图仪在术前、术后14 d及细胞移植后28 d由同一专科医生进行超声心动图测量左室射血分数(LVEF)、左室缩短分数(FS)、左室舒张末内径(LVEDD)、左室收缩末内径(LVESD)。所有测量值均取3次测量的平均值。
1.2.6 心脏取材及切片 细胞移植28 d后处死动物,剪开心包膜,暴露心脏,注意心包的光泽度及心包内液体的情况,心脏的大小、外形、心外膜的情况,迅速取下心脏,冰盐水冲洗干净,在相应梗死周边区切取标本,将标本放入-80℃冰箱内保存备用。取梗死边缘区心肌制成6 μm厚冰冻切片,用荧光显微镜观察移植细胞存活情况。取左心室心肌组织,用4%多聚甲醛液固定,然后常规石蜡包埋,切片厚5 μm,HE染色后光镜观察组织学形态变化。
1.2.7 实时定量PCR法检测心肌组织Bcl-2表达 提取梗死边缘区心肌组织50 mg,按照Trizol Reagant说明书提取总RNA(其 A260/280比率高于1.9;用凝胶电泳观察是完整无损的;不含反转录或 PCR抑制剂),42℃ 反转录50 min,95℃ 5 min灭活反转录酶。GAPDH和Bcl-2基因由上海生工生物工程有限公司合成,引物序列:GAPDH:92 bp,上游5'-CAA GAA GGT GGT GAA GCA GG-3';下游5'-CAC TGT TGA AGT CGC AGG AG-3'〔5,6〕,Bcl-2:70 bp,上游 5'-ATA ACG GAG GCT GGG ATG-3',下游 5'-CAG GAG AAA TCA AAC AGA GGC-3'。荧光定量PCR热循环参数:96℃ 4 min,然后三步反应:94℃ 30 s,58℃30 s,72℃ 30 s,40个循环。以 GAPDH 为内参照基因,将目的基因表达的相对定量值RQ用于统计分析。实时定量PCR采用2-△△Ct(△Ct=目的基因 Ct值-GAPDH Ct值,△△Ct=目的基因△Ct值-参照基因△Ct值)法统计分析结果〔7〕。
1.3 统计学处理 采用 SPSS13.0统计学软件进行单因素方差分析及SNK-q检验。
2 结果

图1 BMSCs形态观察(×40)
2.1 BMSCs形态观察 图1可见,用Percoll液(1.073 g/ml)梯度离心从骨髓中分离单个核细胞,接种于培养液中,72 h后出现散在的纺锤状贴壁细胞,10~14d后形成克隆,MSC贴壁稀疏时,长梭形细胞的两极朝向不规律,细胞排列混乱,细胞之间往往通过突起相连接。约3 w出现致密的贴壁细胞层,此时细胞的两极开始有规律地排列成束状,有的呈漩涡状。每瓶单层融合的MSC用胰蛋白酶消化后平均获得(5.5±0.17)×105个细胞,将这些细胞再传代培养,传代后细胞24 h完全贴壁,3~5 d即可达80% ~90% 融合。
2.2 荧光显微镜下观察转染细胞 转染24~48 h后,在荧光显微镜下可观察到EGFP标记的BMSCs。最佳MOI为500。荧光显微镜下转染效率100%,形态比较均匀一致,但增殖速度减慢。见图2。
2.3 动物心功能不全模型结果 造模时心电图可见相应导联ST段抬高,结扎后该供血区域心肌变白,造模后存活21只,死亡的主要原因为麻醉意外、气胸。2 w后根据心脏彩超结果及造模成功判定标准(LVEF≤50%),共有18只造模成功。按照随机数字表法分为Ad-EGFP-Bcl-2组、Ad-EGFP组和DMEM组各6只。实验兔各组动物体重比较无统计学差异〔(3.409±0.103)kg,(3.418 ±0.092)kg,(3.374 ±0.133)kg,P=0.774〕。
2.4 心脏超声检查 术前心功能均正常。BMSCs移植后4 w,Ad-EGFP-Bcl-2组和 Ad-EGFP组与 DMEM组相比,均优于DMEM组,Ad-EGFP-Bcl-2组LVEF值明显高于Ad-EGFP组及DMEM组,EDD数值小于Ad-EGFP组及DMEM组。Ad-EGFP组比DMEM组LVEF提高EDD减小(P<0.05)。见表1。
2.5 PCR结果 Ad-EGFP-Bcl-2组与Ad-EGFP组及DMEM组相比,Bcl-2表达量均增加明显(P<0.05)。Ad-EGFP组与DMEM组相比,Bcl-2表达增加(P<0.05)。见表1。
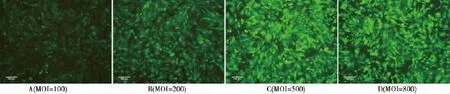
图2 不同MOI转染效果
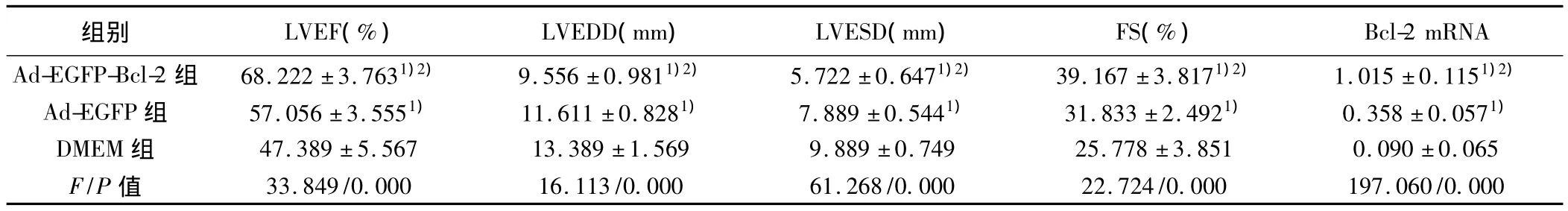
表1 移植4 w后兔心功能测定及心肌组织Bcl-2 mRNA表达(x ± s,n=6)
2.6 荧光显微镜下观察细胞存活 细胞移植28 d后,处死家兔后,取梗死周边区域心肌组织,经冰冻切片机切片后,在荧光显微镜下可观察到的经EGFP标记的移植BMSCs。Ad-EGPFBcl-2组多于Ad-EGFP组。见图3。

图3 荧光显微镜观察细胞存活(×40)
2.7 病理学变化 正常心肌细胞纤长,平行排列且整齐,包质染色均匀,核小,圆形或椭圆形,组织间隙无炎性渗出。模型组心肌有坏死,部分心肌纤维断裂,有炎性细胞浸润。见图4。

图4 心肌病理切片观察(HE,×40)
3 讨论
心肌梗死后最终引起心功能不全是患者死亡的主要原因。现行的治疗方法不能从根本上修复坏死的心肌组织〔8〕。MSC是人们研究最深入的干细胞种类之一,特别是在修复病患及损伤组织、器官方面。MSCs存在于多种成体组织内,骨髓是MSCs的主要来源。自体和异体的MSC都被证明能够参与组织再生。异体间充质干细胞移植能够发挥作用可能因其具有调节免疫系统的功能〔9〕。
本实验采用结扎家兔前降支使血管急性闭塞建立心肌梗死后心功能不全模型,移植第9代基因修饰及非基因修饰同种异体细胞进行治疗,用心脏彩超评估心衰模型及治疗效果,并试图探讨其可能机制。尽管家兔是心肌梗死后心衰的一种合适动物模型,但此造模法动物创伤大,与人类病理生理过程有一定差距,开胸时易损伤肺组织,术后纵隔内组织瘢痕愈合且容易发生粘连,为二次开胸操作带来一定的困难。
BMSCs移植改善梗死后心脏功能的机制可能与间充质干细胞可分泌多种因子,促进细胞增殖与血管再生建立侧支循环,抑制梗死区扩大与心肌细胞凋亡有关〔10〕,本实验通过检测Bcl-2mRNA表达量证实移植细胞有抗心肌细胞凋亡作用,通过基因修饰的BMSCs抗凋亡作用更强,移植效果更佳。
BMSCs易于被外源基因转染并稳定表达〔11~13〕,对其进行基因修饰可以使BMSCs具有更好的促血管再生、抗细胞凋亡、抗炎、修复心功能的作用。外源性基因导入目的细胞中有病毒载体系统和非病毒载体系统。本实验采用腺病毒转染BMSCs,转染效率高,无毒副作用。细胞移植也有多种途径〔14〕,本实验采用直接心肌内注射,使病变处有较高的细胞浓度,但需要二次开胸。
Bcl-2是具有明显抑制凋亡作用的基因,用阳离子脂质体法抗凋亡基因修饰BMSCs后,延长BMSCs存活,有助于提高其移植治疗心肌梗死的效果〔15〕。单基因修饰BMSCs虽取得较好的疗效。但由于心肌梗死心肌修复涉及多种机制,单种基因很难满足治疗需求,许多学者开始多基因修饰骨髓间充质干细胞的探索〔16~18〕,所有结果均表明,多基因联合可起到一定的治疗效果叠加。
目前对BMSC的基因修饰研究主要为单一基因的动物试验阶段,但诸多动物实验的结果令人鼓舞,基因工程在骨髓间充质干细胞治疗心肌梗死后心力衰竭中有广泛的应用前景。随着研究的深入,相信会有更多的基因靶点和基因工程技术应用于心肌梗死后心力衰竭的干细胞治疗领域。
1 Li SR,Qi XY,Hu FL,et al.Mechanisms of improvement of left ventricle remodeling by trans-planting two kinds of autologous bone marrow stem cells in pigs〔J〕.Chin Med J(Engl),2008;121(23):2403-9.
2 Williams AR,Trachtenberg B,Velazquez DL,et al.Intramyocardial stem cell injection in patients with ischemic cardiomyopathy:functional recovery and reverse remodeling〔J〕.Circ Res,2011;108(7):792-6.
3 Hoover-Plow J,Gong Y.Challenges for heart disease stem cell therapy〔J〕.Vasc Health Risk Manag,2012;8:99-113.
4 Ladage D,Turnbull IC,Ishikawa K,et al.Delivery of gelfoam-enabled cells and vectors into the pericardial space using a percutaneous approach in a porcine model〔J〕.Gene Ther,2011;18(10):979-85.
5 乔建晶,李树仁,胡 炜,等.自体骨髓间充质干细胞移植对心肌梗死后心衰家兔炎性因子表达的影响〔J〕.中国老年学杂志,2011;31(11):2048-51.
6 胡 炜,李树仁,张素巧,等.自体骨髓间充质干细胞移植对心肌梗死后兔Ryanodine受体及其稳定蛋白表达的影响〔J〕.中国老年学杂志,2012;32(1):110-3.
7 Schmittgen TD,Livak KJ.Analyzing real-time PCR data by the comparative C(T)method〔J〕.Nat Protoc,2008;3(6):1101-8.
8 Yancy CW,Jessup M,Bozkurt B,et al.2013 ACCF/AHA Guideline for the Management of Heart Failure:Executive Summary:A Report of the A-merican College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines〔J〕.Circulation,2013;62(16):1495-539.
9 Soleymaninejadian E,Pramanik K,Samadian E.Immunomodulatory properties of mesenchymal stem cells:cytokines and factors〔J〕.Am J Reprod Immunol,2012;67(1):1-8.
10 Mirotsou M,Jayawardena TM,Schmeckpeper J,et al.Paracrine mechanisms of stem cell reparative and regenerative actions in the heart〔J〕.J Mol Cell Cardiol,2011;50(2):280-9.
11 Wang S,Qin X,Sun D,et al.Effects of hepatocyte growth factor overexpressed bone marrow-derived mesenchymal stem cells on prevention from left ventricular remodelling and functional improvement in infarcted rat hearts〔J〕.Cell Biochem Funct,2012;30(7):574-81.
12 Zuo S,Jones WK,Li H,et al.Paracrine effect of Wnt11-overexpressing mesenchymal stem cells on ischemic injury〔J〕.Stem Cells Dev,2012;21(4):598-608.
13 Kim SH,Moon HH,Kim HA,et al.Hypoxia-inducible vascular endothelial growth factor-engineered mesenchymal stem cells prevent myocardial ischemic injury〔J〕.Mol Ther,2011;19(4):741-50.
14 Campbell NG,Suzuki K.Cell delivery routes for stem cell therapy to the heart:current and future approaches〔J〕.J Cardiovasc Transl Res,2012;5(5):713-26.
15 Li W,Ma N,Ong LL,et al.Bcl-2 engineered MSCs inhibited apoptosis and improved heart function〔J〕.Stem Cells,2007;25(8):2118-27.
16 Lai VK,Afzal MR,Ashraf M,et al.Non-hypoxic stabilization of HIF-Ialpha during coordinated interaction between Akt and angiopoietin-1 enhances endothelial commitment of bone marrow stem cells〔J〕.J Mol Med(Berl),2012;90(6):719-30.
17 Gao XR,Tan YZ,Wang HJ.Overexpression of Csx/Nkx2.5 and GATA-4 enhances the efficacy of mesenchymal stem cell transplantation after myocardial infarction〔J〕.Circ J,2011;75(11):2683-91.
18 Jiang J,Fan CY,Zeng BF.Experimental construction of BMP2 and VEGF gene modified tissue engineering bone in vitro〔J〕.Int J Mol Sci,2011;12(3):1744-55.

