纳米炭混悬液与美蓝在乳腺癌前哨淋巴结活检中的应用研究
陈 智 覃庆洪 练 斌 于滢华 莫钦国 韦长元
前哨淋巴结(sentinel lymph node,SLN)是指接收肿瘤区域淋巴回流的第一站淋巴结,前哨淋巴结的病理状态对乳腺癌腋淋巴结的准确分期有重要意义,同时为乳腺癌患者的预后判断及治疗方案的选择提供重要的参考依据。研究表明,对于体检SLN阴性的患者,以前哨淋巴结活检(sentinel lymph node biopsy,SLNB)替代腋淋巴结清扫术(axillary lymph node dissection,ALND)是安全有效的,同时可降低因ALND而造成的上肢水肿、麻木等术后并发症的发生率,提高患者生存质量[1-2]。SLN的示踪方法多种多样,如何能安全方便、高效准确的检出SLN是该应用的关键[3]。其中,染料法操作简单,目前应用广泛,示踪剂主要为纳米炭和美蓝。本研究对比了以纳米炭混悬液和美蓝作为淋巴结示踪剂在SLNB中的检出率及检出数量,评估了两种示踪剂在SLNB中的示踪效果,同时分析了肿瘤状况、年龄、肥胖等因素对SLNB检出情况的影响,探讨2种示踪剂在乳腺癌SLNB中的应用价值,以期为乳腺癌的临床诊疗提供参考。
1 资料与方法
1.1 一般资料
收集我院2013年1月至2014年8月间收治的303例乳腺癌患者,所有患者均以纳米炭混悬液或美蓝作为示踪剂行SLNB。病例纳入标准:①经空芯针穿刺或切除活检确诊为原发性乳腺癌患者;②无远处转移;③腋窝淋巴结检查阴性(包括可触及或影像学提示腋窝淋巴结异常,但穿刺活检阴性者)。排除标准:①炎性乳腺癌;②患者术前行新辅助化疗;③患者既往有胸壁、乳房放疗史;④患者既往有同侧腋窝手术史。依据示踪剂的不同将以上病例分为两组,其中纳米炭组138例,美蓝组165例。入组患者年龄29~85岁,中位年龄48岁。除1例患者为男性外其余均为女性。术后病理类型:浸润性导管癌262例,原位癌23例(导管内癌21例,乳头Paget病2例),黏液癌10例,其他浸润性癌8例。
1.2 材料
纳米炭混悬注射液(carbon nanoparticles suspension injection)1 ml∶50 mg,重庆莱美药业股份有限公司生产。美蓝注射液(methylene blue)2 ml∶20 mg,江苏济川制药有限公司生产。
1.3 SLNB 方法
麻醉成功后,取纳米炭混悬注射液1 ml或美蓝注射液1~2 mL,于乳晕外上皮下注射。注射前回抽,确定无回血后再将示踪剂缓慢注入,注射后稍加按摩注射点。注射后5~10 min,行前哨淋巴结活检术。取腋窝长约3 cm弧形手术切口,寻找染色淋巴管,沿染色淋巴管追踪染色淋巴结,将所有染色淋巴结予以切除,同时将腋窝区术中触诊发现的未染色的肿大质硬淋巴结作为SLN切除,将切除的淋巴结送术中冰冻连续切片HE染色病理检查。SLN阴性患者不再进行ALND;SLN阳性或SLNB失败的患者继续完成ALND,切除标本送病理常规检查。
1.4 统计学方法
应用IBM SPSS Statistics 19.0统计软件进行分析。均数比较采用t检验,率的比较采用卡方检验或Fisher精确概率法,均以P<0.05为差异有显著统计学意义。
2 结果
2.1 两组检出结果的比较
303例患者均行常规SLNB,所有患者均未发生与示踪剂相关的不良反应。纳米炭组的检出率为99.3%、平均检出SLN数5.1枚,均高于美蓝组(检出率93.9%,平均3.5 枚,P 均 <0.05),见表1。纳米炭组检出的137例患者中病理阳性者34例,美蓝组检出的155例患者中病理阳性者31例。在行SLNB的过程中,部分患者术区可触及未染色的肿大质硬淋巴结,另有部分患者出现淋巴结染色不明显现象。以上两种情况均有碍于SLN的准确判断与检出,视为示踪不理想情况,加以分析(表1),结果显示美蓝组示踪不理想发生率高于纳米炭组(P<0.05)。
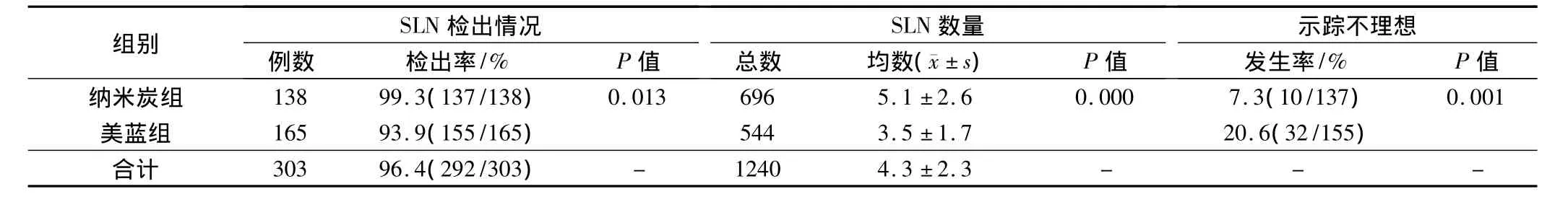
表1 两组检出结果比较
2.2 临床病理因素对检出率的影响
SLNB的检出率与患者肿瘤大小、肿瘤部位、术前腋窝淋巴结触诊情况、肿瘤分子分型、年龄、身体质量指数(body mass index,BMI)等因素进行分析。结果提示检出率与以上诸因素均无显著统计学相关(P均>0.05),见表 2。
3 讨论
在我国,乳腺癌是女性最常见的恶性肿瘤之一,对女性的健康和生命造成严重威胁。腋淋巴结是浸润性乳腺癌重要的转移途径,其转移状态对乳腺癌患者预后的判断和治疗方案的选择意义重大。过去,ALND一直是各种乳腺癌根治术的重要组成部分,但在临床研究与实践中人们发现,大部分早期乳腺癌患者并不能从ALND中获益,而ALND术后并发症如上肢淋巴水肿、麻木、疼痛,肩部活动受限等,严重影响了术后患者生存质量。自20世纪90年代以来,SLNB在早期乳腺癌患者的手术治疗中得到了广泛应用。对于早期腋淋巴结无转移的患者,在不影响预后的情况下以SLNB替代不必要的ALND,大大减少了手术创伤及术后并发症的发生,提高患者生存质量[4]。国内外大规模的临床试验已经证实,SLNB可以准确判断腋淋巴结转移状况,接受SLNB或ALND的SLN阴性患者的5年总生存率和无瘤生存率无显著差异,SLN阴性患者行SLNB替代ALND安全有效[5-7]。对于有SLNB适应证的患者,SLNB已作为规范性治疗方案[8]。
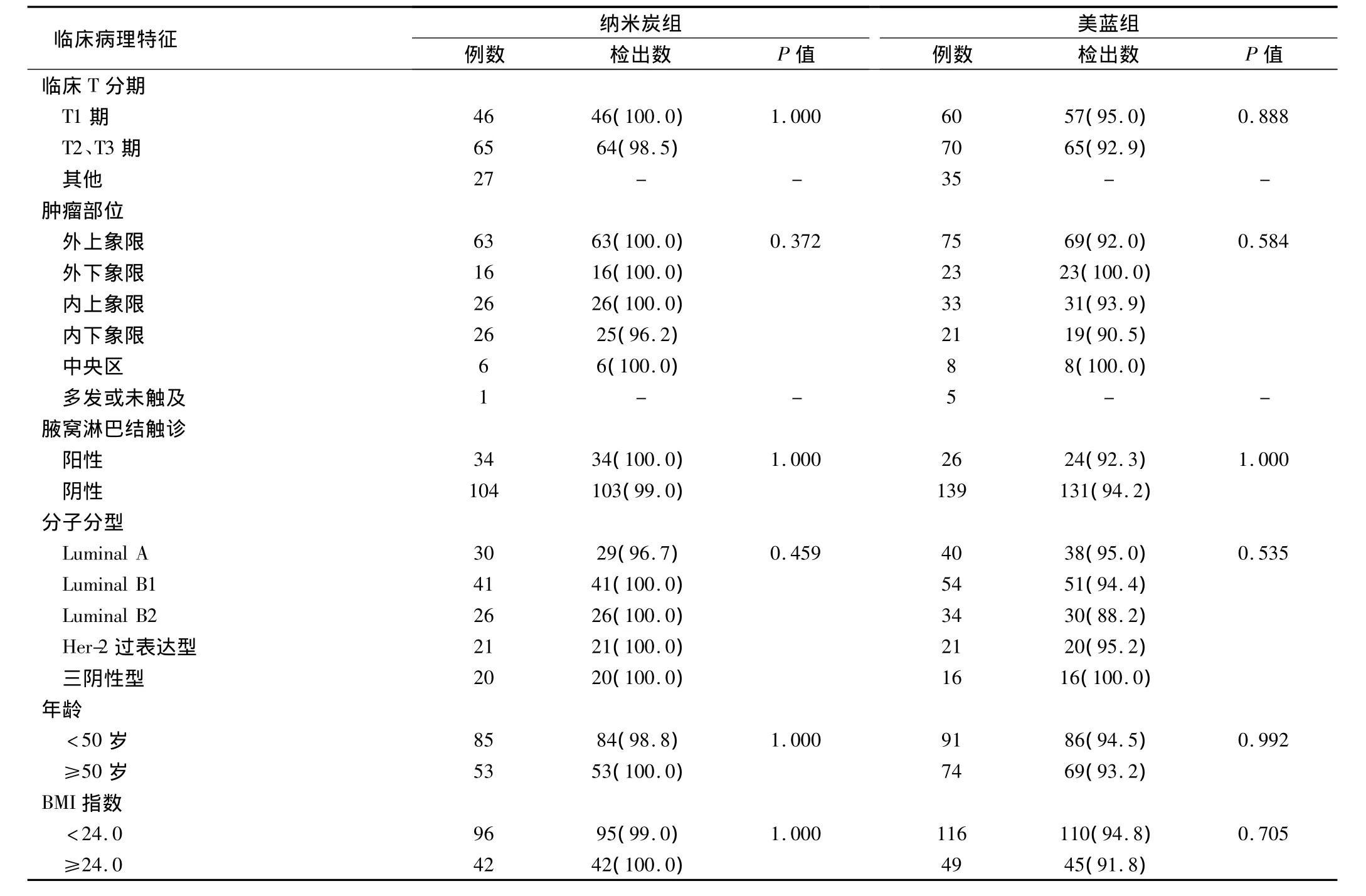
表2 临床病理特征与检出率关系(例,%)
准确找到SLN是行SLNB的关键。目前,术前应用超声、钼靶、MRI等影像学方法寻找乳腺癌转移淋巴结已取得一定成果,特别是彩色多普勒超声对乳腺癌转移淋巴结的诊断有较高的准确性[9]。术中应用示踪方法寻找SLN的主要有:染料法、核素法、荧光法以及多种方法同时使用的联合法。在各种方法中,核素法、荧光法需要额外的设备,操作相对复杂,相比之下,染料法简单易行,成本低廉,应用较多的为传统染料美蓝。目前,国内外SLNB的平均检出率已达到90%以上,在国内应用染料法的检出率为 89.84%[1,10]。染料法较核素法、荧光法的检出率相对偏低,因此,寻找更优秀的染料示踪剂是研究的热点,其中之一就是第三代染料示踪剂—纳米炭混悬液。
在本研究中,纳米炭组检出率、平均检出数量分别为 99.3%、5.1 枚,均高于美蓝组的93.9%、3.5 枚,显示出明显优势,这与纳米炭混悬液适宜的颗粒大小及特异的淋巴趋向性关系密切。一般认为,理想的示踪剂应当能快速进入淋巴管并在SLN聚积停留,清晰显示淋巴管和淋巴结,同时不被毛细血管吸收,不与周围组织结合,避免背景染色干扰。纳米炭混悬液中,碳颗粒平均粒径21 nm,具有极大的吸附活性,它们聚集成150 nm的团粒稳定在混悬液里。这些团粒无法进入正常毛细血管,但可以进入内皮细胞间隙达100~500 nm的毛细淋巴管,加上组织间液与淋巴液压力差及巨噬细胞的吞噬作用,使得碳颗粒能迅速进入淋巴管并停留于SLN内,清楚地显示出SLN[11]。使用美蓝作为示踪剂时,部分SLN不被染色或者染色不明显,检出率下降。分析原因,一方面美蓝是小分子可溶于水的化合物,注射后既可进入毛细淋巴管,又可进入毛细血管[12],淋巴管选择性差;另一方面,小分子美蓝向周围组织弥散快,不易聚积于SLN内,使SLN褪色快,同时加重术区背景干扰,影响了SLN的判断与检出。
SLNB的检出率与假阴性率是两项重要的评价指标,有研究显示[13],更多的SLN检出数量有利于降低假阴性率。本研究两组中均有检出失败的病例,纳米炭组1例,美蓝组10例,其可能的原因是肿瘤侵犯SLN过程中癌栓将淋巴管堵塞,使得染料无法进入淋巴管。由于本研究SLN阴性患者未行ALND,因此无法评估两种方法的假阴性率。
对于SLN的检出率,有资料表明其与患者肿瘤部位、年龄及BMI等因素相关[14-15],亦有研究否认以上关联[16]。从表2结果可得出,两组患者肿瘤大小、部位、分子分型、术前腋淋巴结触诊情况、年龄、BMI等因素对检出率均无统计学意义影响,此结果不排除病例数量相对不足所致,有待于更大规模的研究证实。另外,有研究表明肿瘤T分期与腋淋巴结转移率呈正相关[17]。在研究中笔者发现,肿瘤小于2 cm患者与肿瘤大于2 cm患者相比,有示踪效果理想的趋势(83.0%,112/135 vs 86.8%,92/106)。其原因为较大的肿瘤对区域淋巴管压迫、破坏更大,严重阻碍淋巴液回流,使得染料进入SLN更为困难。这提示我们对原发肿瘤T2期以上患者行SLNB时应尽量使用检出率高的示踪方法,术中注意寻找是否有未染色的SLN,以减少假阴性结果的发生。
综上,纳米炭混悬液的SLN检出率、检出数量均高于美蓝。纳米炭混悬液优异的特性使得染料示踪剂保留了使用方便、操作简单的优点,同时获得满意的检出率,弥补了传统染料示踪剂的不足,适宜在各级医疗机构中推广应用,其前景值得肯定。
[1]Kim T,Giuliano AE,Lyman GH.Lymphatic mapping and sentinel lymph node biopsy in early-stage breast carcinoma〔J〕.Cancer,2006,106(1):4-16.
[2]Giuliano AE,Han SH.Local and regional control in breast cancer:role of sentinel node biopsy〔J〕.Adv Surg,2011,45:101-116.
[3]Motomura K,Komoike Y,Nagumo S,et al.Sentinel node biopsy to avoid axillary lymph node dissection in breast cancer〔J〕.Breast Cancer,2002,9(4):337-343.
[4]Crane-Okada R,Wascher RA,Elashoff D,et al.Long-term morbidity of sentinel node biopsy versus complete axillary dissection for unilateral breast cancer〔J〕.Ann Surg Oncol,2008,15(7):1996-2005.
[5]Giuliano AE,Mccall L,Beitsch P,et al.Locoregional recurrence after sentinel lymph node dissection with or without axillary dissection in patients with sentinel lymph node metastases〔J〕.Ann Surg,2010,252(3):426-432.
[6]Harlow SP,Krag DN,Julian TB,et al.Prerandomization surgical training for the national surgical adjuvant breast and bowel project(NSABP)B-32 trial:a randomized phaseⅢclinical trial to compare sentinel node resection to conventional axillary dissection in clinically node-negative breast cancer〔J〕.Ann Surg,2005,241(1):48-54.
[7]王永胜,欧阳涛,王启堂,等.中国前哨淋巴结活检多中心协作研究CBCSG-001最新资料报告〔J〕.中华乳腺病杂志(电子版),2009,3(3):8-12.
[8]中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2013版)〔J〕.中国癌症杂志,2013,23(8):637-684.
[9]杨伟萍,丁战铃,李 航,等.彩色多普勒超声对乳腺癌转移淋巴结的诊断价值〔J〕.中国超声诊断杂志,2006,7(3):165-167.
[10]郑 刚,杨 靖,左文述,等.中国乳腺癌前哨淋巴结活检验证阶段研究结果的系统评价〔J〕.中华医学杂志,2011,91(6):361-365.
[11]瞿 欢,张亚男.纳米炭在乳腺癌治疗中的应用〔J〕.中国普通外科杂志,2009,18(5):495-497.
[12]杨 瑞,王淑君,张 颖.亚甲蓝作为淋巴示踪剂的研究与展望〔J〕.中国药剂学杂志(网络版),2009,7(2):65-71.
[13]Martin RCG,Chagpar A,Scoggins CR,et al.Clinicopathologic factors associated with false-negative sentinel lymphnode biopsy in breast cancer〔J〕.Annals of Surgery,2005,241(6):1005-1015.
[14]申郑堂,欧慧英,邬玉辉,等.乳腺癌前哨淋巴结检出率的影响因素〔J〕.中国普通外科杂志,2005,14(9):708-710.
[15]Martelli G,Miceli R,Daidone MG,et al.Axillary dissection versus No axillary dissection in ederly patients with breast cancer and no palpable axillary nodes:results after 15 years of follow-up〔J〕.Ann Surg Oncol,2011,18(1):125-133.
[16]李太玉,孙 晓,王永胜,等.单用蓝染料示踪剂在乳腺癌前哨淋巴结活检中的价值〔J〕.中国普外基础与临床杂志,2010(12):1235-1239.
[17]Bernardi S,Bertozzi S,Londero AP,et al.Nine years of experience with the sentinel lymph node biopsy in a single ltalian center:A retrospective analysis of 1,050 cases〔J〕.World J Surg,2012,36(4):714-722.

