黑曲霉(Aspergillus niger)发酵生产木聚糖酶的pH调控策略
邢亚梅,陈 勇,应汉杰
(南京工业大学 生物与制药工程学院 国家生化工程技术研究中心,江苏 南京 211800)
黑曲霉(Aspergillus niger)发酵生产木聚糖酶的pH调控策略
邢亚梅,陈 勇,应汉杰
(南京工业大学 生物与制药工程学院 国家生化工程技术研究中心,江苏 南京 211800)
为了提高黑曲霉(Aspergillus niger)D08生产木聚糖酶的能力,考察了不同pH条件对菌株生长及产酶的影响,结果发现木聚糖酶发酵过程中菌体生长的最适pH与木聚糖酶合成的最适pH不同,分别为3.5和4.5。由此针对性地提出了两阶段pH控制策略:在30 h内控制pH为3.5;30 h后pH控制为4.5。结果表明:分阶段pH调控策略的实施进一步提高了菌体合成木聚糖酶的能力,木聚糖酶比酶活(2 223.38 U/mL)和生产强度(26.47 U/(mL·h))分别比恒定pH 4.5时提高了14.3%和30.6%。该工艺对提高木聚糖酶活力具有一定的指导意义,为后续研究和生产奠定了良好的基础。
pH调控;木聚糖酶;黑曲霉
植物纤维是自然界中储存量最大、最丰富,也是最廉价的一类可再生资源,其中半纤维素约占15%~30%[1]。作为半纤维素的主要组成成分,木聚糖广泛分布于高等植物的细胞壁中,是自然界中存储量仅次于纤维素的多糖[2]。木聚糖酶是一类可以将木聚糖降解成低聚糖和木糖的水解酶类,主要由β-1,4-内切木聚糖酶(EC3.2.1.8)和β-木糖苷酶(EC3.2.1.37)组成,其功能分别是切断木聚糖主链中的木糖苷键以及将寡聚糖进一步降解为单体木糖[3]。
同时,木聚糖酶作为一种工业酶制剂,在诸多领域具有广泛应用。在植物性饲料中,添加木聚糖酶可以降解饲料中的抗营养因子非淀粉多糖(NSPS),从而提高禽畜对营养物质的利用率[4]。在食品行业,木聚糖酶可以将半纤维素含量较高的农业废弃物降解成为低聚木糖[5]。在生物能源转化领域,木聚糖酶可与纤维素酶系协同作用,将植物纤维降解为戊糖和己糖,并以其作为发酵底物,进一步通过微生物生产乙醇[6-7]。在生物制浆漂白领域,木聚糖酶可以作为生物漂白助剂应用于造纸工业[8]。
目前,木聚糖酶主要依靠微生物发酵法获得,现已知能够合成木聚糖酶的微生物主要涉及真菌、链霉菌、细菌和酵母等[1]。曲霉属菌株(Aspergillus sp.)是生产木聚糖酶的优良菌株,成为国内外木聚糖酶生产研究的重点[9]。为了提高曲霉属产木聚糖酶的能力,我国科研工作者已在菌种选育[10-11]、发酵优化[12-14]、酶学性质[10,15]等方面开展了大量的研究工作。在发酵培养过程中,pH、温度均是影响微生物合成木聚糖酶的重要因素。针对菌体生长和木聚糖酶合成的最适温度不一致这一特性,Yuan等[16]提出了一种分阶段的温度调控策略,使木聚糖酶的生产强度得到提高。受上述研究的启发,本文尝试研究pH对木聚糖酶发酵过程不同阶段的影响,并以此为基础开发新的pH控制策略,旨在提高微生物合成木聚糖酶的能力。
本文着重考察pH对黑曲霉(Aspergillus niger)D08菌株生长及产木聚糖酶能力的影响,并结合发酵动力学参数分析,导向性地采用分阶段pH调控策略,以初步实现木聚糖酶的高效生产,旨在提高微生物合成木聚糖酶的能力。
1 材料与方法
1.1 菌种
黑曲霉(Aspergillus niger)D08,由南京工业大学国家生化工程技术研究中心实验室诱变筛选并保藏。
1.2 主要试剂
山榉木木聚糖、3,5-二硝基水杨酸(DNS)(Sigma公司),马铃薯、麸皮粉和玉米芯粉均购自南京近郊(麸皮粉和玉米芯粉粉碎后过0.177 mm筛使用),其他试剂为化学纯或分析纯试剂。
1.3 主要仪器
WFJ7200型可见分光光度计,尤尼柯(上海)仪器有限公司;HVE-50型高压灭菌锅,日本Hirayama公司;PYX-DHS-40×50-BS型隔水式电热恒温箱,上海跃进医疗器械厂;ZQZY-C型震荡培养箱,上海知楚仪器有限公司;Eppendorf 5810R高速冷冻离心机,德国Eppendorf公司;BIOQ-PH12高通量生物反应器,汇合堂生物工程设备(上海)有限公司。
1.4 培养基
斜面培养基:马铃薯葡萄糖琼脂(PDA)培养基。
种子培养基(g/L):麸皮50、蔗糖10。
发酵培养基(g/L):麸皮40、玉米芯28.1、NaNO34.2、KH2PO41.0、MgSO4·7H2O 0.5、吐温-80 0.5。
以上培养基在121℃、105Pa条件灭菌15 min,待用。
1.5 培养方法
1)菌种活化 将保藏菌种接种于PDA斜面培养基中,置于30℃恒温培养箱培养3 d后,接入装有50 mL种子培养基的250 mL摇瓶中,30℃、220 r/min培养24 h。
2)菌种培养 将培养好的种子以3%(体积分数)的接种量接入12通道的1 L生物反应器中,装液量为400 mL,搅拌转速为200 r/min,通气量为0.8 vvm(1个vvm表示每分钟通气量与罐体实际料液体积的比值),温度30℃,以NaOH(1 mol/L)和稀HCl(1 mol/L)调节发酵过程的pH。
1.6 粗酶液的制备
发酵液用冷冻离心机5 000 r/min离心10 min,吸取上清液,即粗酶液。
1.7 生物量的测定
过滤法收集发酵培养物中的菌丝球,洗涤数次后移至干燥箱中,80℃恒温干燥24 h,称质量。
1.8 木聚糖酶活的测定
取适当稀释的粗酶液50 μL,加入0.45 mL的0.05 mol/L的柠檬酸缓冲液(pH 4.8)及 1 mL、1.2%(质量分数)的木聚糖底物,在50℃条件下反应30 min。木糖生成量的测定参照文献[17]进行。
酶活定义(U):在50℃条件下反应30 min,每分钟降解底物生成1 μmol木糖所需的酶量。
1.9 菌体比速率的计算
2 结果与讨论
2.1 未控制pH条件下Aspergillus niger D08发酵合成木聚糖酶的特性
在1 L高通量生物反应器中考察初始pH为6.0时菌体的发酵特征,结果如图1所示。
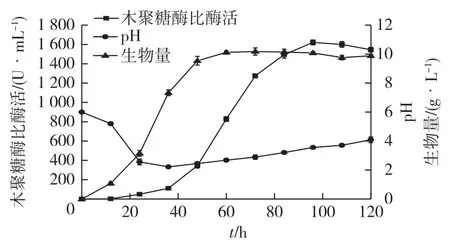
图1 初始pH为6.0时Aspergillus niger D08在发酵过程中pH、木聚糖比酶酶活及菌体生长的变化情况Fig.1 Time course of pH,xylanase activity and biomassin fermentation of Aspergillus niger D08 at initial pH of 6.0
由图1可知:菌体生长经过短暂的延滞期后很快进入指数生长期,发酵至48 h菌体生长进入稳定期。24 h内菌株产木聚糖酶的能力较弱,24 h后迅速产酶,96 h时比酶活达到最大值(1 621.22 U/mL),随后趋于稳定。木聚糖酶活力的增长趋势明显滞后于菌体生长,这再一次证明了黑曲霉合成木聚糖酶的过程属于部分生长耦联型[18]。
随后观察菌株发酵过程中pH的变化情况,可发现pH呈现先降低,后升高的趋势:在36 h内,pH由6.0下降至2.2,而后随着培养时间的延长,pH缓慢上升至4左右。这一现象可能是因为在发酵前期,菌体快速生长的过程中产生大量有机酸[16],导致pH降低;随着细胞生长逐渐进入稳定期,代谢产物积累,代谢活动降低,菌体细胞呼吸作用减弱,使得发酵体系中pH上升。
pH影响培养基中部分营养物质的解离状态、菌株细胞膜的生理功能及细胞内各种酶的活性[19],进而影响微生物的生长和产物的合成。
2.2 不同pH条件下Aspergillus niger D08发酵合成木聚糖酶的特性
为了进一步了解pH对菌株生长及产酶能力的影响,考察不同pH条件下菌体的生长和产酶情况结果见图2。

图2 不同pH对Aspergillus niger D08生长及产木聚糖酶的影响Fig.2 Effects of different pH on the cell growth and xylanase production of Aspergillus niger D08
由图2可知:pH的升高致使菌体生长及产物合成产生延迟现象;同时,随着pH的升高,菌体的生长速率及生物量呈现下降趋势,然而木聚糖酶的活性则呈现先升高后降低的趋势,在pH为4.5时最高,在pH为5.0时最低。当pH为3.5,发酵48 h时生物量达到最大值(10.45 g/L),之后细胞生长进入稳定期;木聚糖酶的合成滞后于菌体生长,在发酵至72 h时达到最大比酶活(1 487.36 U/mL)。当pH高于3.5,细胞生长缓慢,生物量下降,木聚糖酶比酶活达到最大值的时间相应向后推迟。pH 4.5条件下,木聚糖酶比酶活最高(1 945.46 U/mL);但菌体生长缓慢,发酵96 h木聚糖酶酶活才达到最大值,相比pH 3.5条件下推迟了24 h。当pH升至5.0时,细胞生长缓慢,生物量下降,合成木聚糖酶的能力也下降。
由图2分析可得,相对较高的pH更有利于菌体合成木聚糖酶,但是过高的pH又不利于菌体生长。为了进一步研究不同pH条件对菌体生长及合成木聚糖酶的影响,考察了不同pH条件下细胞比生长速率和木聚糖酶比合成速率的动力学过程曲线,结果见图3、图4。由图3和图4可知:pH 3.5时细胞最大比生长速率为0.22 h-1,菌体生长达到对数生长末期[20](比生长速率小于0.02 h-1)仅用了30 h,相比pH 4.5时缩短了34 h。当pH由3.5升至4.5,菌体合成木聚糖酶的最高比速率逐渐增大,在pH 4.5时达到最大(6.90 U/(mg·h)),但其木聚糖酶的比合成速率达到峰值的时间相比pH 3.5条件下推迟了24 h。当pH升至5.0时,菌体比生长速率,木聚糖酶比合成速率均偏低。以上结果表明,当pH控制为3.5时最适合菌体生长,而pH控制为4.5时最适合木聚糖酶的合成。
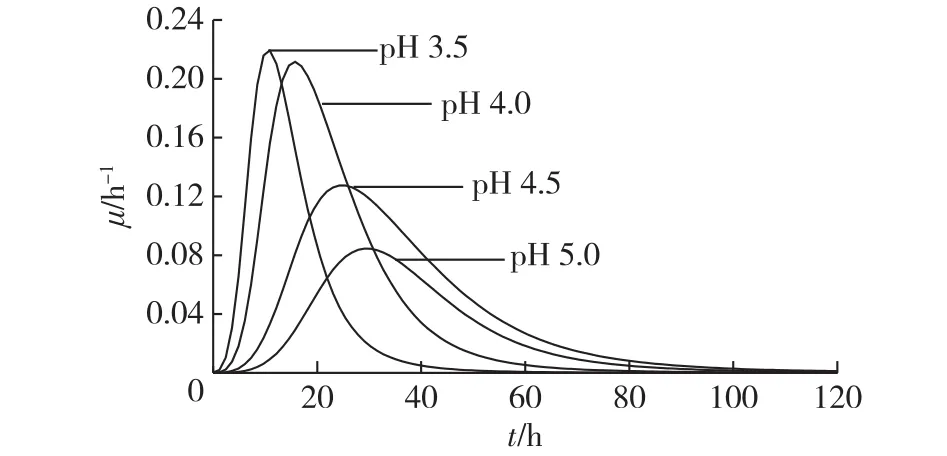
图3 pH对Aspergillus niger D08的比生长速率的影响Fig.3 Effects of pH on specific cell growth rate in Aspergillus niger D08
2.3 Aspergillus niger D08发酵合成木聚糖过程中分阶段pH控制策略的确定及验证
虽然pH对菌体的生长和产物的合成均有显著影响,但菌体在生长阶段和产酶阶段的最适pH不同,pH 3.5最适合菌体生长,pH 4.5最适合木聚糖酶的合成,而在pH 4.5条件下菌体生长和产物合成均表现出明显的延迟现象,木聚糖酶酶活达到最高值的时间过长。为了进一步提高木聚糖酶的生产水平,针对性提出两阶段pH控制策略:发酵0~30 h,控制pH为3.5,以缩短细胞生长延滞期并促进菌体生长;30 h至发酵结束控制pH为4.5,利于细胞合成木聚糖酶,从而提高木聚糖酶的活力和生产强度,结果见图5。
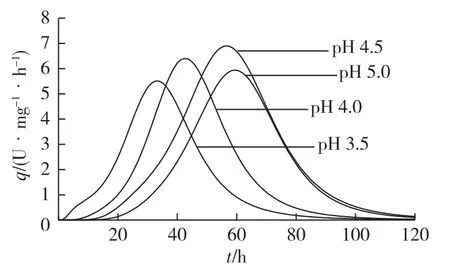
图4 pH对Aspergillus niger D08合成木聚糖酶的比合成速率的影响Fig.4 Effects of pH on specific xylanase formation rate in Aspergillus niger D08

图5 分阶段控制pH对Aspergillus niger D08产酶及生长的影响Fig.5 Effects of pH shift operation on xylanase production and cell growth of Aspergillus niger D08
由图5可知:采用分阶段pH调控策略,显著提高了菌株合成木聚糖酶的能力。在两阶段pH调控模式下,在48 h时,菌体达到生物量最大值,比恒定pH 4.5模式下提前24 h;最终,木聚糖酶比酶活(2 223.38 U/mL)和生产强度(26.47 U/(mL·h))比恒定pH 4.5模式下分别提高了14.3%和30.6%(表1)。

表1 两阶段pH控制策略与恒定pH 4.5模式下发酵参数Table 1 Fermentation properties of xylanase fermention in constant pH 4.5 and in pH control strategy
3 结论
本文详细分析了木聚糖酶发酵过程中pH对Aspergillus niger D08菌体生长及产木聚糖酶能力的影响,结果表明:菌体生长的最适pH与木聚糖酶合成的最适pH不同,分别为3.5和4.5。在此基础上,为进一步提高木聚糖酶的生产效率,针对性地提出了两阶段pH调控策略:0~30 h控制pH为3.5,30 h后控制pH为4.5。通过该策略,木聚糖酶比酶活和生产强度比恒定pH 4.5模式下分别提高了14.3%和30.6%。
基于两阶段pH控制策略,Aspergillus niger D08合成木聚糖酶的能力显著提高,为后续研究酶的分离纯化、酶学性质及酶分子的定向改造奠定了基础,并有利于木聚糖酶的规模化生产应用。
[1]Polizeli M,Rizzatti A C S,Monti R,et al.Xylanases from fungi:properties and industrial applications[J].Appl Microbiol and Biotechnol,2005,67(5):577-591.
[2]孙超,陈卫平.微生物木聚糖酶及其应用研究进展[J].中国酿造,2013,32(4):24-29.
[3]Garai D,Kumar V.A Box-Behnken design approach for the production of xylanase by Aspergillus candidus under solid state fermentation and its application in saccharification ofagro residues and Parthenium hysterophorus L[J].Ind Crops Prod,2013,44:352-363.
[4]周平发,史宝军,崔细鹏,等.木聚糖酶的研究进展及在生产上的应用[J].广东饲料,2011,20(5):24-27.
[5]Chapla D,Pandit P,Shah A.Production of xylooligosaccharides from corncob xylan by fungal xylanase and their utilization by probiotics[J].Bioresour Technol,2012,115:215-221.
[6]Öhgren K,Bura R,Saddler J,et al.Effect of hemicellulose and lignin removal on enzymatic hydrolysis of steam pretreated corn stover[J].Bioresour Technol,2007,98(13):2503-2510.
[7]He X,Miao Y,Jiang X,et al.Enhancing the enzymatic hydrolysis of corn stover by an integrated wet-milling and alkali pretreatment[J].Appl Biochem Biotechnol,2010,160(8):2449-2457.
[8]王秋影,廖美德.木聚糖酶的研究进展[J].饲料博览,2013(6):8-12.
[9]Lakshmi G S,Rao C S,Rao R S,et al.Enhanced production of xylanase by a newly isolated Aspergillus terreus under solid state fermentation using palm industrial waste:a statistical optimization[J].Biochem Eng J,2009,48(1):51-57.
[10]孙婕,郁惠蕾,李春秀,等.一株高产木聚糖酶真菌的筛选及酶学性质分析[J].生物加工过程,2013,11(1):35-40.
[11]Wu M,Li S C,Yao J M,et al.Mutant of a xylanase-producing strain of Aspergillus niger in solid state fermentation by low energy ion implantation[J].World J Microbiol Biotechnol,2005,21(6/ 7):1045-1049.
[12]Cao Y,Meng D,Lu J,et al.Statistical optimization of xylanase production by Aspergillus niger AN-13 under submerged fermentation using response surface methodology[J].Afr J Biotechnol,2008,7(5):631-638.
[13]Siedenberg D,Gerlach S R,Czwalinna A,et al.Production of xylanase by Aspergillus awamori on complex medium in stirred tank and airlift tower loop reactors[J].J Biotechnol,1997,56(3):205-216.
[14]Chapla D,Divecha J,Madamwar D,et al.Utilization of agroindustrial waste for xylanase production by Aspergillus foetidus MTCC 4898 under solid state fermentation and its application in saccharification[J].Biochem Eng J,2010,49(3):361-369.
[15]刘明启,关荣发,陈文伟.黑曲霉固体发酵产木聚糖酶的响应面优化设计及其酶学性质的研究[J].农业生物技术学报,2010,18(1):52-60.
[16]Yuan Q,Wang J,Zhang H,et al.Effect of temperature shift on production of xylanase by Aspergillus niger[J].Process Biochem,2005,40(10):3255-3257.
[17]Mandels M,Medeiros J E,Andreotti R E,et al.Enzymatic hydrolysis of cellulose:evaluation of cellulase culture filtrates under use conditions[J].Biotechnol Bioeng,1981,23(9):2009-2026.
[18]聂国兴,宋东蓥,明红等.黑曲霉C71分批发酵动力学模型的构建[J].河南师范大学学报:自然科学版,2010,38(2):148-151.
[19]王昌禄,朱汉春,张晓霞,等.pH对S-腺苷-L-蛋氨酸发酵的影响[J].生物技术通报,2007(6):154-161.
[20]张静,周景文,刘立明,等.分阶段pH调控提高2-酮基-L-古龙酸生产[J].生物工程学报,2010,26(9):1263-1268.
(责任编辑 荀志金)
Two-stage pH control strategy for xylanase production by Aspergillus niger D08
XING Yamei,CHEN Yong,YING Hanjie
(National Engineering Technique Research Center for Biotechnology,College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China)
In order to improve xylanase production of Aspergillus niger D08,effects of pH on cell growth and xylanase production were investigated.The optimum pH for cell growth was 3.5,while that for xylanase production was 4.5.Accordingly,a two-stage pH control strategy was as follows:pH was controlled at 3.5 for the first 30 h,and then raised to 4.5 for the remaining time.With this strategy,the maximal xylanase activity and productivity ofxylanase reached 2 223.38 U/mL and 26.47 U/(mL·h),respectively,which were 14.3%and 30.6%higher than those in the single pH(pH 4.5)controlled model.This pH control strategy offers a promising guideline for enhancing the production of xylanase by Aspergillus niger D08,thus making a good foundation to further research and production of xylanase.
pH control;xylanase;Aspergillus niger
Q815
A
1672-3678(2015)01-0023-05
10.3969/j.issn.1672-3678.2015.01.005
2013-12-30
国家杰出青年基金(21025625);国家高技术研究发展计划(863计划)(2012AA021203);国家科技支撑计划(2012BAI44G01);国家自然科学基金面上基金(21376118);国家自然科学基金青年基金(21106070);长江学者和创新发展计划(PCSIRT);江苏自然科学基金(SBK20150207);江苏省高校优势学科建设工程项目(PAPD)
邢亚梅(1988—),女,江苏南通人,硕士研究生,研究方向:生物催化;陈 勇(联系人),副研究员,E-mail:chenyong1982@ njtech.edu.cn

