胰蛋白酶对皮肤鳞状细胞癌A431细胞生长的影响
张捷 曹一鑫 秦婧 王建力 陈莉
胰蛋白酶对皮肤鳞状细胞癌A431细胞生长的影响
张捷 曹一鑫 秦婧 王建力 陈莉
目的 探讨胰蛋白酶对皮肤鳞状细胞癌A431细胞增殖、迁移和黏附能力等生物学行为的影响。方法 用不同浓度的胰蛋白酶处理A431细胞,通过CCK8法检测细胞活性,筛选胰蛋白酶作用的最佳浓度;流式细胞仪检测癌细胞增殖周期细胞百分率和增殖率;划痕和Transwell小室实验分别检测癌细胞在二维和三维空间的迁移能力;纤连蛋白粘附试验检测癌细胞的黏附潜能。结果 用不同浓度胰蛋白酶处理A431细胞,通过检测细胞生长活性发现,随着胰蛋白酶浓度升高,A431细胞增殖活性增加;100 nmol/L胰蛋白酶处理A431细胞后,与对照组相比,G1期细胞比例减少,S期细胞比例增高,细胞增殖指数、细胞迁移能力和黏附潜能增加,差异均有统计学意义(均P<0.05)。结论 胰蛋白酶能促进A431细胞增殖、迁移和黏附。
癌,鳞状细胞;胰蛋白酶;细胞生长过程;细胞周期;细胞运动;细胞系,肿瘤
许多恶性肿瘤中均发现有肥大细胞增生,但其意义尚不清楚。胰蛋白酶是肥大细胞的重要产物,我们用细胞生物学方法研究胰蛋白酶处理人皮肤鳞状细胞癌(鳞癌)细胞系A431细胞后,对其增殖、迁移、黏附的影响,探讨胰蛋白酶促进肿瘤生长的相关机制。
一、试剂和仪器
1.主要试剂:常规培养的A431细胞由第四军医大学西京皮肤医院高天文教授惠赠,0.1、1、10、100 nmol/L胰蛋白酶由南通大学药理教研室提供,0.1%DMEM培养基为美国Invitrogen 公司产品,Cell Counting Kit-8(CCK8)试剂盒为日本Dojindo公司产品,RNA酶A为美国Pharrnacai公司产品,Transwell小室为美国Coastar公司产品,胎牛血清为美国Invitrogen公司产品,纤连蛋白为美国BD公司产品,0.02%结晶紫为生工生物工程(上海)股份有限公司产品。
2.主要仪器:酶标仪产自美国Biorad公司,流式细胞仪产自美国BD公司。
二、方法
1.CCK8法:常规培养A431细胞,0.25%胰蛋白酶消化对数生长期A431细胞,以3×104个/ml密度、每孔100 μl接种于96孔培养板内,37℃、5%CO2培养箱中贴壁培养24 h后,分别换含0.1、1、10、100 nmol/L胰蛋白酶的0.1%DMEM培养液。药物作用 24、48、72 h 后,每孔加入CCK8 溶液 10 μl,37℃继续孵育1.5 h,选择450 nm波长,在酶标仪上测定各孔吸光度A值,每组3个复孔,实验重复3次,取均值。在各浓度组中选取胰蛋白酶与等体积DMEM培养液混合作为胰蛋白酶培养液处理实验组用于后续实验,用等体积DMEM完全培养基处理作为对照组。
2.流式细胞仪检测:取对数生长期A431细胞,以105个/ml的密度接种于6孔培养板,培养24 h后,加入含100 nmol/L胰蛋白酶培养液,继续培养48 h,消化离心细胞,以4℃预冷的75%乙醇固定过夜。细胞悬液560×g离心10 min,弃上清液,再用0.01 mol/L磷酸盐缓冲液(PBS)冲洗1次,重复离心1次后加RNA酶A 200 μl/管,混匀,4℃30 min;加碘化丙锭(PI)200 μl/管,混匀,放入 4 ℃冰箱保存 1 h,流式细胞仪检测。细胞增殖指数(PI)=(S+G2/M)/(G0/G1+S+G2/M)。
3.细胞划痕法:取对数生长期A431细胞,以105个/ml的密度接种于96孔培养板,每孔150 μl。孔板底部预先画好标记线,置37℃、5%CO2培养箱中培养24 h,待细胞间形成较紧密连接的单层后,用无菌10 μl枪头在培养孔底部中央垂直划一道痕迹,且在显微镜下可同时看到创面两侧。然后各孔加入含100 nmol/L胰蛋白酶培养液。倒置显微镜(×100)下分别测量24、48、72 h的划痕创面愈合情况。每组细胞不同时间点通过划痕区的长度占划痕区长度的百分比代表其相对迁移率。
4.Transwell小室试验:取对数生长期A431细胞,以105个/ml的密度接种于24孔板中,次日给予含100 nmol/L胰蛋白酶培养液,48 h后制备细胞悬液。将含50 μl Matrigel胶包被Transwell小室置于24孔板中,在小室膜上加入A431细胞悬液 100 μl,细胞数约为 1 × 105个,小室膜下加入 600 μl完全培养液。37℃、5%CO2条件下孵育24 h后,用棉签轻轻擦去膜上细胞,膜下细胞用结晶紫染色,倒置显微镜下分别计数每孔5个视野(×200)中的细胞,取其均值。
5.细胞黏附试验:取对数生长期A431细胞,以105个/ml的密度接种于24孔板中,次日实验组给予胰蛋白酶培养液(对照组仍常规培养)。同时用灭菌双蒸水分别配制10 g/L牛血清白蛋白(BSA)溶液,50 mg/L Matrigel胶1∶8稀释液各50 μl/孔分别加入96孔培养4℃过夜,每孔加入10 g/L BSA无血清培养液50 μl,37℃,1 h。分别消化实验组和对照组处理的A431细胞制备2×105/ml细胞悬液各100 μl分别将接种于包被胎牛血清,纤连蛋白的96孔培养板中,37℃,1 h。每组平行4个样本。70%甲醇固定10 min,洗板晾干,0.02%结晶紫染色10min,PBS洗去多余染料,再以0.2%TritonX-100溶解细胞,在酶联免疫仪上测定各孔570 nm处A值。粘附率(%)=[(实验组A值/对照组A值)-1]×100%
6.统计分析:用SPSS14.0统计学软件进行方差齐性检验与方差分析。配对计量资料采用配对t检验。率的比较用χ2检验。P<0.05为差异有统计学意义。
三、结果
1.不同浓度胰蛋白酶对A431细胞活力的影响:CCK8法检测加药各组A431细胞的增殖情况并绘制生长曲线(图1)。胰蛋白酶处理细胞48 h时除最低浓度外,其余各浓度均能促进A431细胞增殖(与对照组比较,均P<0.05),其中100 nmol/L浓度的效果最明显,因此在后续试验中选择胰蛋白酶100 nmol/L浓度。
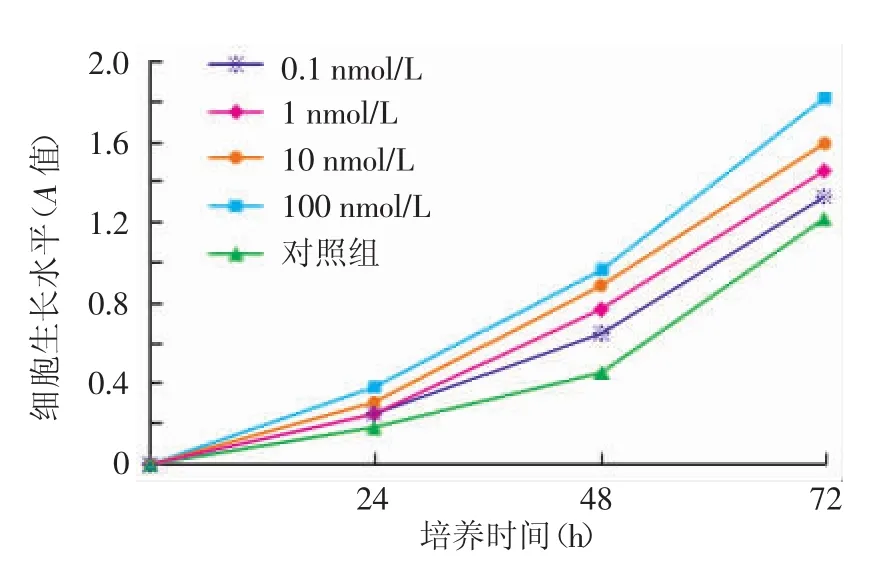
图1 CCK8法检测不同浓度胰蛋白酶作用于A431细胞的生长曲线
2.100 nmol/L胰蛋白酶对A431细胞周期的影响:流式细胞仪检测,胰蛋白酶处理组A431细胞G1期在24、48、72 h均少于对照组,S期均多于对照组;胰蛋白酶处理后24、48 h,增殖指数与对照组比较差异有统计学意义(P值分别为0.02和0.03)。见表1。
3.100 nmol/L胰蛋白酶对A431细胞迁移和黏附的影响:胰蛋白酶处理A431细胞24、48、72 h,细胞迁移和黏附能力较对照组显著增加(均P<0.05),见表2。
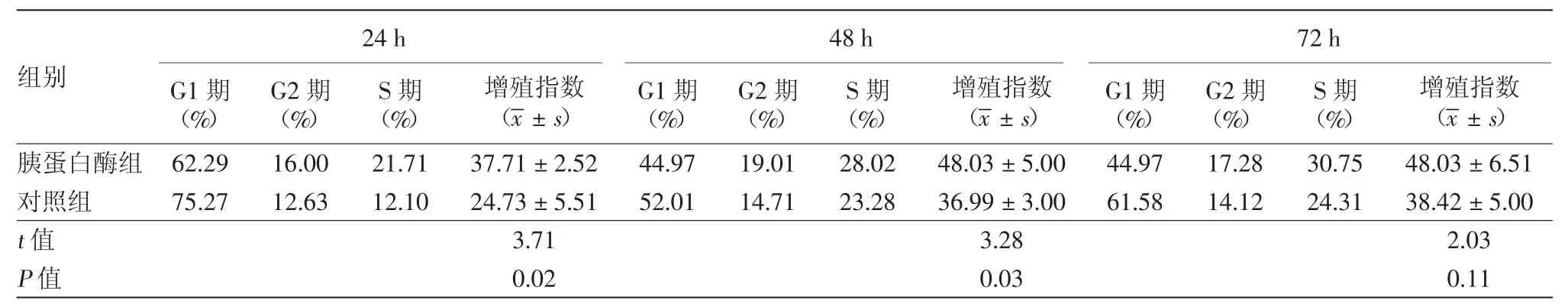
表1 胰蛋白酶作用下A431细胞各周期百分比及增殖指数
表2 胰蛋白酶对A431细胞迁移和黏附的影响(±s)

表2 胰蛋白酶对A431细胞迁移和黏附的影响(±s)
注:n=3
组别 细胞迁移率(%) 侵袭细胞数(个) 黏附细胞数(个)24 h 48 h 72 h 24 h 48 h 72 h 24 h 48 h 72 h胰蛋白酶组 0.40±0.10 0.87±0.01 0.98±0.01 232.25±2.99 367.40±8.44 335.20±3.11 63.95±0.22 77.17±0.76 92.78±0.33对照组 0.33±0.19 0.58±0.08 0.91±0.03 158.33±8.02 201.40±10.31 249.00±7.38 32.00±0.56 46.90±0.35 64.60±0.96 t值 0.56 6.23 3.83 14.96 21.58 18.64 91.98 62.66 48.08 P值 0.60 0.00 0.01 0.00 0.00 0.00 0.00 0.00 0.00
四、讨论
胰蛋白酶是肥大细胞合成和分泌的特异性活性蛋白酶[1],可活化一些与肿瘤侵袭相关的蛋白酶,如尿激酶前体、基质金属蛋白酶等,从而导致肿瘤的浸润[2]。Yamamoto 等[3]用免疫组化方法检测大肠癌标本的胰蛋白酶表达,发现胰蛋白酶表达与肿瘤侵袭深度、淋巴静脉侵袭、淋巴结及远处转移、PTNM分期及复发密切相关,胰蛋白酶阳性的患者较阴性的患者总生存期和无病生存期显著缩短,同时表达基质金属蛋白酶和胰蛋白酶的患者预后极差,因此,在大肠癌中同时检测基质金属蛋白酶和胰蛋白酶对提示大肠癌预后极有意义。Miyata等[4]报道,胰蛋白酶通过参与PAR2信号传导,促进癌细胞增殖以及黏附到纤连蛋白,进而促进肿瘤细胞生长侵袭转移。
本研究用4个不同浓度胰蛋白酶处理A431细胞,发现随着胰蛋白酶浓度升高A431细胞增殖活性增加,说明胰蛋白酶对A431的生长促进作用呈剂量依赖性。流式细胞仪观察到胰蛋白酶处理A431细胞24、48、72 h后,G1期细胞均少于对照组,S期细胞均多于对照组;胰蛋白酶处理后24、48 h细胞增殖指数与对照组比较,差异有统计学意义,表明胰蛋白酶显著促进肿瘤细胞增殖。几乎所有的肿瘤都有细胞周期调控机制破坏,导致细胞生长失控、分化受阻[5]。胰蛋白酶促进肿瘤细胞增殖的机制尚待进一步研究。
本文细胞划痕法、Transwell小室试验和细胞黏附试验结果显示,胰蛋白酶能够促进A431细胞的迁移和黏附。这一结果与文献报道的胰蛋白酶能促进癌细胞黏附到纤连蛋白的情况相似[3],胰蛋白酶与其他蛋白水解酶一样可通过对细胞外基质、基底膜的降解,促进癌细胞迁移并黏附到间质纤连蛋白上形成肿瘤的侵袭和转移。
[1]黄阗,李明才,吴名耀,等.tryptase和chymase表达与食管癌临床病理因素的相关性[J].肿瘤防治研究,2009,36(5):412-414.
[2]肖淑华,刘阳阳,魏连海,等.肥大细胞研究进展[J].生理科学进展,2011,42(2):104-107.
[3]Yamamoto H,Iku S,Adachi Y,et al.Association of trypsin expression with tumour progression and matrilysin expression in human colorectal cancer[J].J Pathol,2003,199(2):176-184.
[4]Miyata S,Koshikawa N,Yasumitsu H,et al.Trypsin stimulates integrin alpha(5)beta(1)-dependent adhesion to fibronectin and proliferation of human gastric carcinoma cells through activation of proteinase-activated receptor-2 [J].J Biol Chem,2000,275(7):4592-4598.
[5]邹向阳,李连宏.细胞周期调控与肿瘤[J].国际遗传学杂志,2006,29(1):70.
Effect of trypsin on the growth of a skin squamous cell carcinoma cell line A431
Zhang Jie*,Cao Yixin,Qin Jing,Wang Jianli,Chen Li.
*Department of Dermatovenereologoy,Affiliated Hospital of Nantong University,Nantong 226001,Jiangsu,China
s:Wang Jianli,Email:bl1@ntu.edu.cn;Chen Li,Email:guilan@ntu.edu.cn
Objective To evaluate the effect of trypsin on the proliferation,migration and adhesion of a skin squamous cell carcinoma cell line A431.Methods Cultured A431 cells were divided into several experimental groups treated with trypsin at concentrations of 0.1,1,10 and 100 nmol/L for 24,48 and 72 hours respectively,and a control group treated with DMEM complete medium only.Cell counting kit-8 (CCK8)assay was conducted to evaluate cellular proliferative activity to select the optimal concentration of trypsin.Then,some A431 cells treated with trypsin at the selected concentration for 24,48 and 72 hours respectively (or 48 hours only)served as the experimental groups(or group),and other A431 cells treated with DMEM complete medium served as the control group.Flow cytometry was performed to assess cell cycle distribution and proliferation index,fibronectin-based adhesion assay to estimate cell adhesive capacity,and wound healing assay and Transwell assay were conducted to evaluate the migratory capacity of cells in two-and three-dimensional space.Statistical analysis was carried out by using analysis of variance,paired samplesttest and chi-square test.Results The proliferative activity of A431 cells increased along with the increase of trypsin concentrations,with the strongest increasing effect observed at 100 nmol/L.After treatment with 100 nmol/L trypsin,the experimental group showed a decrease in the percentage of G1-phase cells,but an increase in the percentage of S-phase cells,proliferation index,migratory and adhesive capacity compared with the control group (allP<0.05).Conclusion Trypsin can promote the proliferation,migration and adhesion of A431 cells.
Carcinoma,squamous cell;Trypsin;Cell growth processes;Cell cycle;Cell movement;Cell line,tumor
作者单位:226001南通大学附属医院皮肤性病科[张捷、曹一鑫(现在江苏大学附属江滨医院)、王建力],病理科(秦婧、陈莉)
10.3760/cma.j.issn.0412-4030.2015.07.013
南通市社会事业科技创新与示范项目(HS2014004)
王建力,Email:bl1@ntu.edu.cn;陈莉,Email:guilan@ntu.edu.cn
2014-07-13)
(本文编辑:吴晓初)

