硒代蛋氨酸对中波紫外线致HaCaT细胞氧化损伤的保护作用
刘赛君 郭梅艳 邓列华 赵刚 胡云峰 易敏 吴实
硒代蛋氨酸对中波紫外线致HaCaT细胞氧化损伤的保护作用
刘赛君 郭梅艳 邓列华 赵刚 胡云峰 易敏 吴实
目的 研究硒代蛋氨酸对中波紫外线(UVB)致HaCaT细胞氧化损伤的影响及其可能机制。方法 培养HaCaT细胞,分为4组:①正常对照组,不做任何处理;②硒代蛋氨酸组:分别加入1、10、50、100、200 nmol/L和1 μmol/L硒代蛋氨酸预孵育24 h;③UVB组:30、60、90 mJ/cm2UVB照射;④硒代蛋氨酸+UVB组:不同浓度硒代蛋氨酸预孵育24 h后进行不同剂量UVB照射。采用噻唑蓝(MTT)法检测细胞增殖活性,流式细胞仪检测细胞凋亡率,比色法检测超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性及丙二醛(MDA)水平。采用析因设计方差分析、单因素方差分析对数据进行统计学分析,多重比较采用LSD法。结果析因设计方差分析结果显示,UVB照射对细胞增殖活性有抑制作用(F=128.04,P<0.05),且随UVB强度增加,细胞增殖活性逐渐下降,组间差异有统计学意义(P<0.05);硒代蛋氨酸预孵育对细胞增殖活性也有影响(F=5.95,P<0.05),其中10 nmol/L~1 μmol/L硒代蛋氨酸+UVB组与UVB组比较,细胞增殖活性显著升高(P<0.05);UVB照射和硒代蛋氨酸对细胞增殖活性无明显交互作用(F=1.65,P>0.05)。30 mJ/cm2UVB照射后,UVB组凋亡率(31.9% ±2.67%)较正常对照组(4.1% ±0.67%)显著升高(P<0.05);而 10、50、100、200 nmol/L和 1 μmol/L硒代蛋氨酸 +30 mJ/cm2UVB 组凋亡率[依次为:(21.9±3.72)%、(17.2±1.67)%、(4.6±0.85)%、(7.5±1.86)%、(13.5±1.95)%]均较30 mJ/cm2UVB组凋亡率显著下降(P<0.05)。30 mJ/cm2UVB组与正常对照组相比,SOD和GSH-Px活性降低,MDA含量升高(P<0.05);10 nmol/L~1 μmol/L硒代蛋氨酸+30 mJ/cm2UVB组与30 mJ/cm2UVB组比较,SOD和GSH-Px活性增高,MDA含量下降(P<0.05)。结论 硒代蛋氨酸可以减轻UVB诱导HaCaT细胞氧化损伤,其机制与增强抗氧化酶活性、减少氧自由基有关。
紫外线;角蛋白细胞;硒代甲硫氨酸;HaCaT细胞
长期、过量紫外线辐射可致皮肤日晒伤、光老化甚至皮肤肿瘤[1-2],其中中波紫外线(UVB)是造成皮肤光损伤的主要原因[3],表皮角质形成细胞为其主要靶细胞。UVB引起皮肤光损伤机制复杂,最为重要一点是通过氧化应激产生过多活性氧,破坏细胞膜、线粒体膜及使各种细胞酶类失活,影响相关细胞信号转导和基因表达,导致细胞损伤、细胞凋亡或癌变[4-6]。微量元素硒是机体重要的抗氧化酶谷胱甘肽过氧化物酶(GSH-Px)的必需组分,具有抗氧自由基的作用,与人体健康密切相关。硒代蛋氨酸是一种重要的硒化合物,可作为较安全的有机硒来源。本研究以永生化人角质形成细胞系HaCaT细胞为实验对象,观察硒代蛋氨酸对UVB致HaCaT细胞氧化损伤的影响。
一、材料与方法
1.细胞来源、主要试剂和仪器:HaCaT细胞株购自中国典型培养物保藏中心(武汉大学保藏中心)。MEM培养基(美国Gibco公司),硒代蛋氨酸、胰蛋白酶、噻唑蓝(MTT)(美国Sigma公司),胎牛血清(天津市灏洋生物制品科技有限责任公司),超氧化物歧化酶(SOD)活力测试盒、GSH-Px活力测试盒、丙二醛(MDA)测定试剂盒(南京建成生物工程研究所)。倒置相差显微镜(日本Olymps公司),UVB灯管(北京电光源研究所),紫外线辐照计(北京师范大学光电仪器厂),CO2培养箱(美国Napco公司),可见光分光光度计(德国Perkin Elmer公司),流式细胞仪(美国Coulter公司)。
2.细胞培养及分组处理:HaCaT细胞在37℃、5%CO2条件细胞培养箱中,用含10%胎牛血清的MEM培养基培养。将处于亚融和状态的细胞用0.25%胰酶和0.03%EDTA消化传代,105个/ml细胞密度接种于培养板中。HaCaT细胞分为4组:①正常对照组:不做任何处理;②硒代蛋氨酸组:加入1、10、50、100、200 nmol/L 和 1 μmol/L 硒代蛋氨酸预孵育 24 h;③UVB组:30、60、90 mJ/cm2UVB照射;④不同浓度硒代蛋氨酸+不同剂量UVB组:硒代蛋氨酸预孵育24 h后行UVB照射。每组设3个复孔,重复实验3次。
3.UVB照射:用2根平行UVB灯管,波长为308 nm,功率为8 W,光源距培养板垂直距离为6 cm,用UVB紫外线辐照计标定辐照强度为200 μW/cm2。UVB剂量分别为30、60、90 mJ/cm2。照射前吸去细胞培养液,用磷酸盐缓冲液(PBS)冲洗1次,再加入少量PBS覆盖底面。UVB照射后,弃去覆盖液PBS,加入MEM培养基继续培养24 h,检测各项指标。
4.MTT法检测细胞增殖活性:向每100 μl培养基中加入5 g/L MTT 20 μl,37℃继续孵育4 h,弃去上清液,每孔加入150 μl二甲基亚砜(DMSO)溶解,室温下振荡 15 min,使蓝紫色结晶物充分溶解,选择490 nm波长在酶联免疫检测仪上测定各孔吸光度(A值)。
5.流式细胞仪检测凋亡率:经30 mJ/cm2UVB照射后,分别检测正常对照组、30 mJ/cm2UVB组、各浓度硒代蛋氨酸+30 mJ/cm2UVB组细胞的凋亡率。将各组细胞用0.25%胰蛋白酶消化,离心收集细胞,以体积分数80%乙醇固定。PBS清洗细胞3次。于各试验管中分别加入含50 mg/L Triton的碘化丙锭200 μl,振荡成单细胞悬液,避光室温静置30 min。300目滤网过滤后,用流式细胞仪检测细胞凋亡率。
6.SOD、GSH-Px活性及MDA含量测定:HaCaT细胞接受30 mJ/cm2UVB照射后,继续培养24 h,进行SOD、GSH-Px及MDA测定,严格按照试剂盒要求步骤操作。测定管A值=(测定空白管A值)/(标准管A值-标准空白管A值)×标准品浓度×样品测试前稀释倍数。每组3个复孔,重复3次,取平均值。
7.统计学处理:应用SPSS13.0统计软件对实验数据进行析因设计的方差分析、单因素方差分析,多重比较采用LSD法,P<0.05为差异有统计学意义。
表1 不同浓度硒代蛋氨酸和不同剂量UVB照射对HaCaT细胞增殖活性的影响(A值,±s)

表1 不同浓度硒代蛋氨酸和不同剂量UVB照射对HaCaT细胞增殖活性的影响(A值,±s)
注:n=3。析因设计方差分析,UVB 主效应:F=128.04,P < 0.05;硒蛋氨酸主效应:F=5.95,P < 0.05;UVB 与硒蛋氨酸无交互作用:F=1.65,P>0.05;a:与正常对照组(1.11±0.07)比较,P< 0.05;b:与未加硒代蛋氨酸的相同剂量UVB 组比较,P<0.05
UVB剂量(mJ/cm2)1 nmol/L 10 nmol/L 50 nmol/L 100 nmol/L 200 nmol/L 1 μmol/L 0 1.11±0.07 1.12±0.02 1.11±0.05 1.10±0.06 1.12±0.04 1.09±0.06 1.10±0.06 30 0.72±0.09a 0.71±0.03 0.93±0.04b 0.96±0.12b 1.05±0.06b 1.01±0.03b 0.95±0.03b 60 0.50±0.12a 0.60±0.13 0.75±0.16b 0.82±0.04b 0.90±0.08b 0.87±0.03b 0.79±0.04b 90 0.19±0.03a 0.18±0.02 0.31±0.04b 0.46±0.03b 0.55±0.04b 0.54±0.03b 0.40±0.03b硒代蛋氨酸浓度0
二、结果
1.硒代蛋氨酸和UVB照射对HaCaT细胞增殖活性的影响(表1):析因设计方差分析结果显示,UVB照射对细胞增殖活性有抑制作用(F=128.04,P< 0.05),30、60、90 mJ/cm2UVB组HaCat细胞增殖活性均低于未照光组(P<0.05),且随UVB强度增加,细胞增殖活性下降,组间差异有统计学意义(P<0.05);硒代蛋氨酸预孵育对细胞增殖活性也有影响(F=5.95,P<0.05),其中不同浓度硒代蛋氨酸+UVB组细胞增殖活性高于UVB组,差异有统计学意义(P<0.05)。UVB照射和硒代蛋氨酸对HaCaT细胞增殖活性无明显交互作用(F=1.65,P>0.05)。见表1。
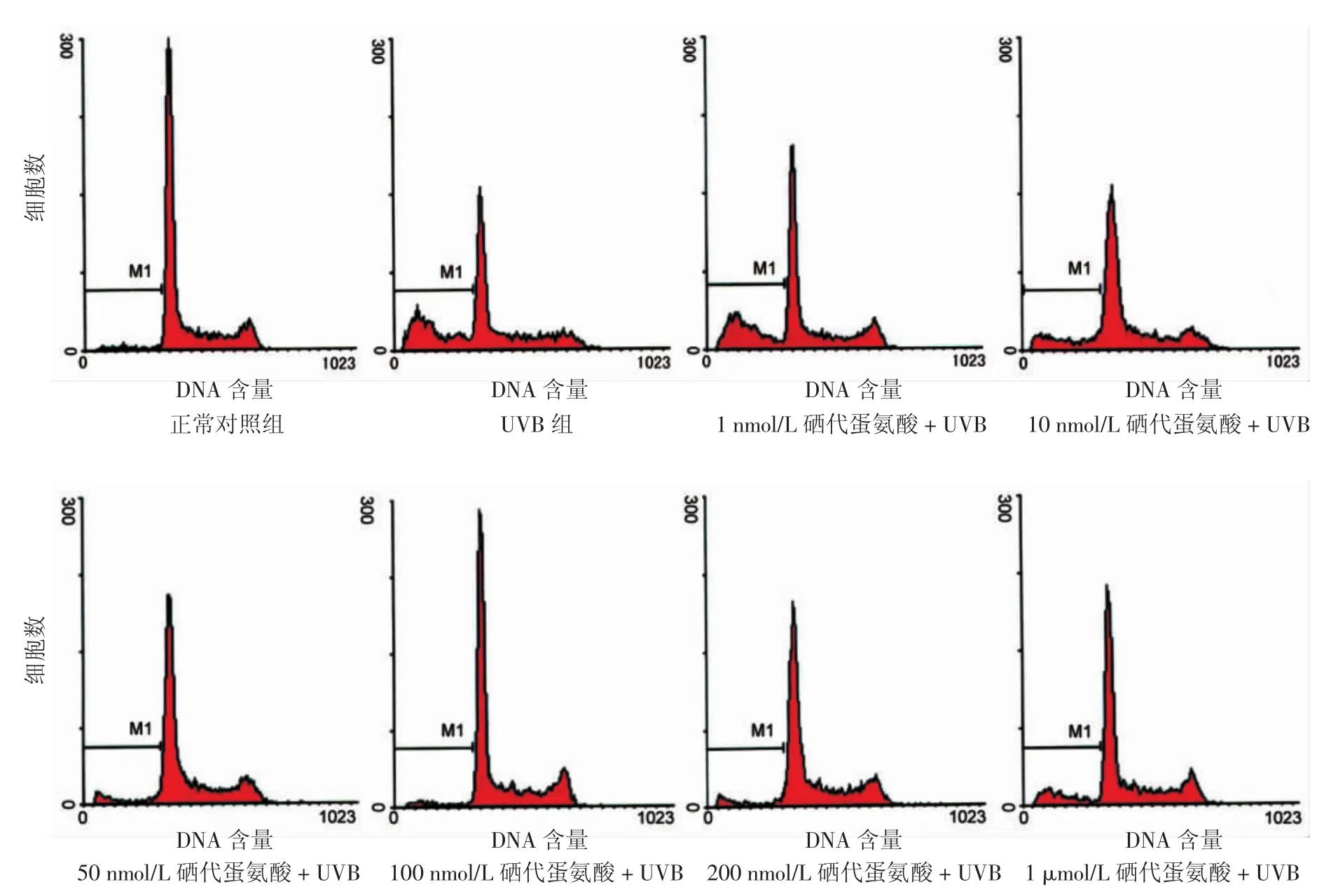
图1 不同浓度硒代蛋氨酸对30 mJ/cm2UVB诱导HaCaT细胞凋亡的影响UVB组M1区出现亚G1峰——凋亡峰;1~100 nmol/L硒代蛋氨酸+UVB组与UVB组相比,M1区凋亡细胞逐渐减少;200 nmol/L硒代蛋氨酸+UVB组和1 μmol/L硒代蛋氨酸+UVB M1区凋亡细胞逐渐增多
表2 不同浓度硒代蛋氨酸对30 mJ/cm2UVB照射后HaCaT细胞凋亡率、SOD、GSH-Px、MDA 的影响(±s)
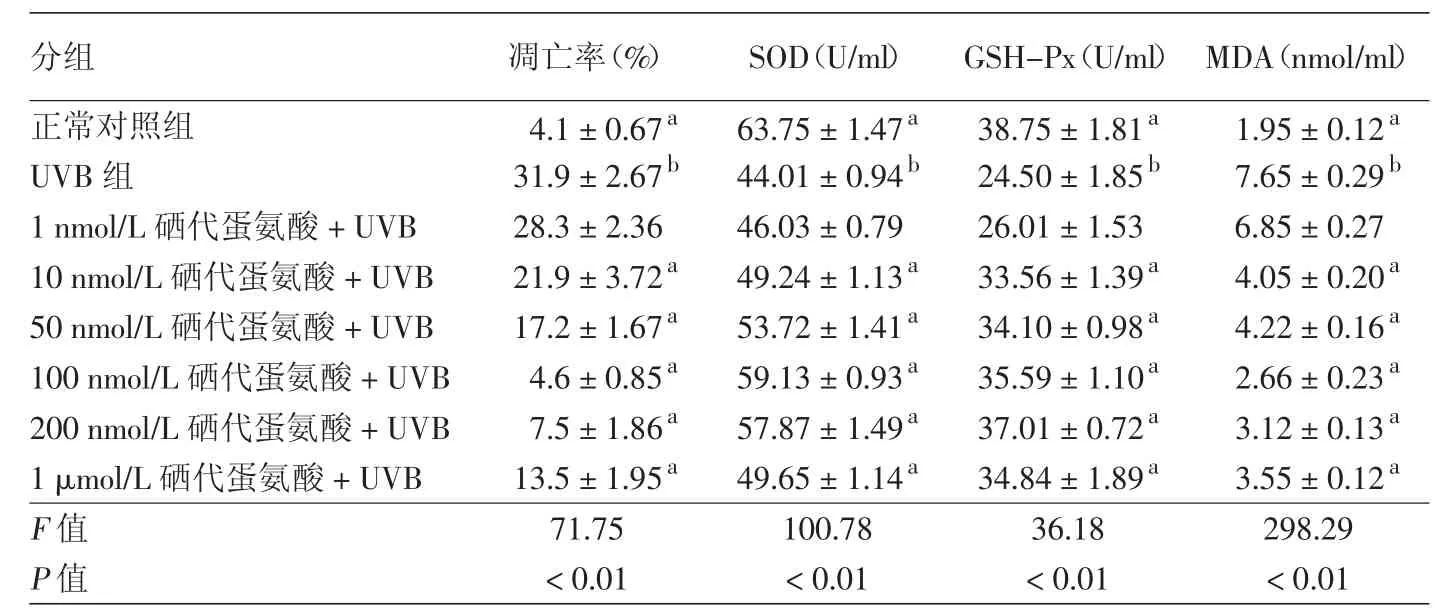
表2 不同浓度硒代蛋氨酸对30 mJ/cm2UVB照射后HaCaT细胞凋亡率、SOD、GSH-Px、MDA 的影响(±s)
注:n=3。单因素方差分析:a:与 UVB 组比较,P < 0.05;b:与正常对照组比较,P < 0.05
分组 凋亡率(%) SOD(U/ml) GSH-Px(U/ml) MDA(nmol/ml)正常对照组 4.1±0.67a 63.75±1.47a 38.75±1.81a 1.95±0.12a UVB组 31.9±2.67b 44.01±0.94b 24.50±1.85b 7.65±0.29b 1 nmol/L硒代蛋氨酸+UVB 28.3±2.36 46.03±0.79 26.01±1.53 6.85±0.27 10 nmol/L硒代蛋氨酸+UVB 21.9±3.72a 49.24±1.13a 33.56±1.39a 4.05±0.20a 50 nmol/L硒代蛋氨酸+UVB 17.2±1.67a 53.72±1.41a 34.10±0.98a 4.22±0.16a 100 nmol/L硒代蛋氨酸+UVB 4.6±0.85a 59.13±0.93a 35.59±1.10a 2.66±0.23a 200 nmol/L硒代蛋氨酸+UVB 7.5±1.86a 57.87±1.49a 37.01±0.72a 3.12±0.13a 1 μmol/L硒代蛋氨酸+UVB 13.5±1.95a 49.65±1.14a 34.84±1.89a 3.55±0.12a F值 71.75 100.78 36.18 298.29 P值 <0.01 <0.01 <0.01 <0.01
2.硒代蛋氨酸对30 mJ/cm2UVB照射后HaCaT细胞凋亡率的影响(表2):30 mJ/cm2UVB照射后,各组凋亡率差异有统计学意义(ν=7,F=71.75,P<0.01);30 mJ/cm2UVB组较正常对照组G1峰降低,出现M1区亚G1峰——凋亡峰,且凋亡率较正常对照组明显升高(P<0.05);从10 nmol/L浓度开始,各浓度硒代蛋氨酸+UVB组与UVB组比较,M1区凋亡峰均降低,凋亡率均下降(P<0.05),其中100 nmol/L硒代蛋氨酸+UVB组凋亡率最低。见图1,表2。
3.硒代蛋氨酸对30 mJ/cm2UVB照射后HaCaT细胞SOD、GSH-Px活性及 MDA含量的影响(表 2):30 mJ/cm2UVB照射后,各组SOD、GSH-Px、MDA含量比较,差异均有统计学意义;UVB组与正常对照组相比,SOD、GSH-Px的活性显著下降,MDA含量显著增加(P<0.05);从 10 nmol/L 浓度开始,硒代蛋氨酸+UVB组与UVB组比较,SOD和GSH-Px活性增高,MDA含量显著下降(P<0.05),其中100 nmol/L硒代蛋氨酸+UVB组SOD的活性最高,MDA含量最低,而200 nmol/L硒代蛋氨酸+UVB组GSH-Px的活性最高。见表2。
三、讨论
本研究发现,30、60、90mJ/cm2UVB照射后,UVB组HaCaT细胞增殖活性均显著低于未照光组,随UVB强度增加,细胞增殖活性下降,说明UVB照射损伤表皮角质形成细胞,且损伤具有辐射剂量依赖性。30 mJ/cm2UVB照射后,UVB组与正常对照组相比,细胞凋亡率升高,MDA含量增高,而抗氧化酶SOD、GSH-Px的活性显著下降,说明UVB照射诱导HaCaT细胞凋亡可能与其引起氧化损伤使氧自由基增加及降低抗氧化酶活性有关。
硒是人体必需的微量元素,适量硒化合物可减轻细胞氧化损伤,具有延缓衰老的作用[7]。硒代蛋氨酸是一种较为安全的有机硒源。Burke等[8]发现,局部外用硒代蛋氨酸可以减轻紫外线辐射引起的炎症和色素沉着,并可降低紫外线诱发的皮肤肿瘤数量。Rafferty等[9]发现,硒代蛋氨酸能抑制宽谱紫外线(包括UVB、UVA和少量UVC)辐射引起的原代培养人角质形成细胞凋亡。我们的研究发现,10 nmol/L~1 μmol/L硒代蛋氨酸具有光保护作用,能减少UVB引起的HaCaT细胞凋亡,增加细胞增殖活性,使SOD和GSH-Px活性增高,MDA含量下降。其中以100、200 nmol/L的保护作用最为显著,与Rafferty等[9]的报道基本一致。一般认为,硒化合物在体内主要通过硒蛋白介导其保护作用,人类皮肤细胞表达至少15种硒蛋白,包括谷胱甘肽过氧化物酶和硫氧还蛋白还原酶家族,均有抗氧化活性,能减缓紫外线对皮肤造成氧化损伤[10]。此外,硒代蛋氨酸可抑制UVB诱导的皮肤细胞P53激活和蛋白聚集[11],从而阻止细胞凋亡。
本研究证实,硒代蛋氨酸对UVB照射损伤人角质形成细胞具有光保护作用,能减轻UVB造成的氧化损伤,我们认为与其能增加抗氧化酶活性、减少氧自由基有关,但具体的作用机制目前仍未完全清楚,尚待进一步研究阐明。
[1]Chen H,Weng QY,Fisher DE.UV signaling pathways within the skin[J].J Invest Dermatol,2014,134(8):2080-2085.
[2]D′Orazio J,Jarrett S,Amaro-Ortiz A,et al.UV Radiation and the Skin[J].Int J Mol Sci,2013,14(6):12222-12248.
[3]Jansen R,Wang SQ,Burnett M,et al.Photoprotection:part I.Photoprotection by naturally occurring,physical,and systemic agents[J].J Am Acad Dermatol,2013,69(6):853.
[4]Chen L,Hu JY,Wang SQ.The role of antioxidants in photoprotection:a critical review [J].J Am Acad Dermatol,2012,67(5):1013-1024.
[5]康玉英,甄雅贤,顾恒.紫外线对皮肤的影响[J].中华皮肤科杂志,2007,40(12):773-775.
[6]邢卫斌,付国俊,叶文静,等.氢气对中波紫外线致皮肤成纤维细胞氧化损伤的影响[J].中华皮肤科杂志,2013,46(6):424-426.
[7]Burke KE.Photoaging:the role of oxidative stress[J].G Ital Dermatol Venereol,2010,145(4):445-459.
[8]Burke KE,Clive J,Combs GF Jr,et al.Effects of topical L-selenomethionine with topical and oral vitamin E on pigmentation and skin cancer induced by ultraviolet irradiation in Skh:2 hairless mice[J].J Am Acad Dermatol,2003,49(3):458-472.
[9]Rafferty TS,Beckett GJ,Walker C,et al.Selenium protects primary human keratinocytes from apoptosis induced by exposure to ultraviolet radiation[J].Clin Exp Dermatol,2003,28(3):294-300.
[10]Hazane-Puch F,Champelovier P,Arnaud J,et al.Long-term selenium supplementation in HaCaT cells:importance of chemical form for antagonist (protective versus toxic)activities[J].Biol Trace Elem Res,2013,154(2):288-298.
[11]Traynor NJ,McKenzie RC,Beckett GJ,et al.Selenomethionine inhibits ultraviolet radiation-induced p53 transactivation[J].Photodermatol Photoimmunol Photomed,2006,22(6):297-303.
Protective effect of selenomethionine against ultraviolet B-induced oxidative damage to a human keratinocyte cell line HaCaT
Liu Saijun*,Guo Meiyan,Deng Liehua,Zhao Gang,Hu Yunfeng,Yi Min,Wu Shi.
*Department of Dermatology,First Affiliated Hospital of Jinan University,Guangzhou 510630,China
s:Deng Liehua,Email:liehuadeng@126.com;Guo Meiyan,Email:guomei04@163.com
Objective To evaluate the effect of selenomethionine (Se-Met)against ultraviolet B(UVB)-induced oxidative damage to human HaCaT keratinocytes,and to explore its possible mechanisms.Methods Cultured HaCaT cells were divided into several groups:normal control group receiving no treatment,Se-Met groups treated with Se-Met at concentrations of 1,10,50,100,200 nmol/L and 1 μmol/L for 24 hours respectively,UVB groups irradiated with UVB of 30,60 and 90 mJ/cm2respectively,Se-Met+UVB groups treated with Se-Met at concentrations of 1,10,50,100,200 nmol/L and 1 μmol/L for 24 hours firstly,then irradiated with UVB of 30,60 and 90 mJ/cm2respectively.Subsequently,methyl thiazolyl tetrazolium (MTT)assay was performed to estimate cellular proliferative activity,flow cytometry to detect cell apoptosis,colorimetry to evaluate superoxide dismutase (SOD)and glutathione peroxidase(GSH-Px)activities and to determine malondialdehyde (MDA)levels.Statistical analysis was carried out by using factorial design analysis of variance(ANOVA),one-way ANOVA and least significant difference(LSD)test.Results Factorial design ANOVA showed that UVB radiation had an inhibitory effect on the proliferative activity of HaCaT cells(F=128.04,P<0.05),which significantly decreased along with the increase of UVB doses,with significant differences between the three UVB groups(P < 0.05).Se-Met pretreatment also affected cellular proliferative activity(F=5.95,P <0.05),which was significantly increased in Se-Met (10 nmol/L-1 μmol/L)+UVB groups compared with the UVB groups at corresponding doses(allP<0.05).There was no significant interaction effect on cellular proliferative activity between UVB radiation and Se-Met pretreatment(F=1.65,P > 0.05).The apoptosis rate of HaCaT cells in the 30-mJ/cm2UVB group was 31.9%±2.67%,significantly higher than that in the normal control group(4.1%±0.67%,P<0.05)and in the 10-,50-,100-,200-nmol/L and 1-μmol/L Se-Met+30-mJ/cm2UVB groups(21.9% ±3.72%,17.2% ±1.67%,4.6% ±0.85%,7.5%±1.86%and 13.5% ±1.95%respectively,allP<0.05).Similarly,SOD and GSH-Px activities were significantly weaker(bothP<0.05),while MDA levels were higher (allP<0.05)in the 30-mJ/cm2UVB group than in the normal control group;however,there was a significant increase in SOD and GSH-Px activities but a decrease in MDA levels in the Se-Met(10 nmol/L-1 μmol/L)+30-mJ/cm2UVB groups compared with the 30-mJ/cm2UVB group (allP< 0.05).Conclusions Se-Met can reduce UVB-induced oxidative damage to HaCaT cells,likely by enhancing antioxidase activity and decreasing oxygen radicals.
Ultraviolet rays;Keratinocytes;Selenomethionine;HaCaT cells
作者单位:510630广州,暨南大学附属第一医院皮肤科(刘赛君、邓列华、赵刚、胡云峰、易敏、吴实);河北工程大学附属医院(郭梅艳)
10.3760/cma.j.issn.0412-4030.2015.07.012
邓列华,Email:liehuadeng@126.com;郭梅艳,Email:guomei04@163.com
2014-09-05)
(本文编辑:周良佳 颜艳)

