中波紫外线诱导的提前衰老成纤维细胞上清液对人真皮成纤维细胞增殖、老化及自噬的影响
王申 周炳荣 骆丹 张家安 刘娟 张丽超 易飞 吴红巾 栗丹 胡燕燕
中波紫外线诱导的提前衰老成纤维细胞上清液对人真皮成纤维细胞增殖、老化及自噬的影响
王申 周炳荣 骆丹 张家安 刘娟 张丽超 易飞 吴红巾 栗丹 胡燕燕
目的 观察中波紫外线诱导的提前衰老的成纤维细胞条件培养液对人真皮成纤维细胞增殖、老化及自噬的影响。方法 取健康青少年男子环切术后包皮进行人真皮成纤维细胞的分离培养。将中波紫外线诱导的提前衰老的成纤维细胞条件培养液培养成纤维细胞设为实验组,并设立对照组即正常成纤维细胞条件培养液培养成纤维细胞。处理20 d后,用CCK8法检测细胞增殖活性,EDU(5-乙炔基-2,脱氧尿嘧啶核苷)法检测细胞增殖,流式细胞仪检测细胞周期,β半乳糖苷酶染色计算衰老细胞百分比,吖啶橙染色检测细胞自噬,Western印迹法及间接免疫荧光检测自噬相关蛋白LC3-B的表达水平。数据采用Graphpad Prism 5软件分析,两组间比较采用成组t检验。结果 实验组成纤维细胞增殖活力(0.831±0.017)明显低于对照组(0.973±0.017),但EDU染色及流式细胞仪检测结果均显示,实验组S期细胞百分比明显高于对照组,差异均有统计学意义(P<0.05)。β半乳糖苷酶染色显示,实验组成纤维细胞阳性率(25.710%±0.304%)高于对照组(5.257%±1.023%),差异有统计学意义(t=19.170,P<0.05)。吖啶橙染色结果显示,实验组成纤维细胞红色荧光量(14.287±2.269)低于对照组(29.614±2.650)。Western印迹及间接免疫荧光结果均显示,实验组成纤维细胞LC3-B表达量明显高于对照组,差异均有统计学意义(P<0.05)。结论 中波紫外线诱导的提前衰老成纤维细胞的条件培养液可降低成纤维细胞的自噬及增殖,并加速其老化。
紫外线;成纤维细胞;细胞衰老;自噬;细胞增殖
作者单位:210029南京医科大学第一附属医院皮肤科
体外培养的正常细胞经过紫外线照射[1]等应激刺激,能引起细胞出现提早衰老,称为应激诱导的提前衰老。近年来研究表明,经紫外线照射的、自然老化的、药物诱导的及肿瘤诱导的老化成纤维细胞均可分泌可溶性物质至培养液中,使周围成纤维细胞发生诸如增殖活性降低、DNA损伤、周期阻滞等生物学表现[2-3]。然而,对于提前衰老的成纤维细胞能否通过旁观者效应影响其周围正常成纤维细胞尚未见报道。我们已证明中波紫外线(UVB)诱导的提前衰老成纤维细胞条件培养液可对人真皮成纤维细胞造成氧化损害[4]。本研究用UVB诱导的提前衰老成纤维细胞条件培养液作用于正常人真皮成纤维细胞,观察其对后者增殖、老化及自噬的影响。
材料与方法
一、细胞来源、试剂和仪器
人皮肤成纤维细胞来自南京医科大学第一附属医院泌尿外科手术室健康青少年男子环切术后包皮。细胞计数试剂盒8(简称CCK8)、β半乳糖苷酶染色试剂盒、BCA试剂盒、间接免疫荧光封闭液、FITC标记山羊抗小鼠IgG(H+L)(上海碧云天生物技术有限公司);EDU(5-乙炔基-2,脱氧尿嘧啶核苷)细胞增殖检测试剂盒(广州市锐博生物科技有限公司);吖啶橙试剂盒(美国Sigma公司);小鼠抗人LC3-B抗体(美国Cell Signaling公司)。SS-04P型UVB台式紫外线光疗仪及UVB辐照度监示器(上海希格玛高技术有限公司)。
二、方法
1.细胞分离和培养:将包皮修剪去皮下组织,剪成小皮片后加入0.5%分散酶消化液,4℃下消化18~20 h;分离表、真皮;取真皮部分以胶原酶消化液37℃消化2 h后,200目尼龙网过滤、1 300×g离心5 min,弃培养液,加入含10%胎牛血清及1%青链霉素的培养基(dulbecco′s modified eagle medium,DMEM),混匀并转移至培养皿中,于37℃、5%CO2饱和湿度细胞培养箱中培养。将处于亚融合状态对数生长期细胞以0.02%乙二胺四乙酸和0.25%胰酶消化传代,取4~10代细胞进行实验。
2.UVB诱导提前衰老的成纤维细胞:用含10%胎牛血清及1%青链霉素的DMEM培养基将成纤维细胞稀释成1×105个/ml,每孔10 ml接种于10 cm培养皿,继续培养至40%融合时开始进行UVB照射。UVB照射前用磷酸盐缓冲液(PBS)替换培养基,照射后换含1%胎牛血清及1%青链霉素的DMEM培养基继续培养。连续培养5 d,每日同一时间照射1次UVB,每次剂量为10mJ/cm2,总剂量为50mJ/cm2,第5次照射后,将培养基换为含10%胎牛血清及1%青链霉素的DMEM,静置3 d后即可获得UVB诱导的提前衰老的成纤维细胞。
3.正常成纤维细胞及提前衰老的成纤维细胞条件培养液的收集和细胞处理:分别将UVB诱导的提前衰老的成纤维细胞及正常成纤维细胞用含10%胎牛血清及1%青链霉素的DMEM培养基稀释成1×105个/ml,每孔10 ml接种于10 cm培养皿,继续培养至70%融合时重新换含10%胎牛血清及1%青链霉素的DMEM培养基继续培养2~3 d后收集培养液。将培养液1 300×g离心5 min去除细胞碎片,用0.22 μm滤器过滤后放入-80℃冰箱中备用,用时均与新鲜培养基以1∶1混合。将成纤维细胞以1×105个/ml接种于75 cm2大培养瓶中,分为实验组即UVB诱导的提前衰老的成纤维细胞条件培养液培养成纤维细胞、对照组即正常成纤维细胞条件培养液培养成纤维细胞。待细胞融合70%时,各组加入相应培养液,连续培养20 d。
4.CCK8法检测细胞增殖活性:将上述处理后的细胞以2×103个/孔的密度重新接种于96孔板中,待细胞贴壁后,弃去原培养液,每孔加10 μl CCK8溶液及90 μl培养液。37℃继续孵育1 h后,用酶标测定仪在450 nm处测吸光度(A值)。
5.EDU法检测细胞增殖:将上述处理后的细胞以2×105个/ml细胞接种于小培养皿中,待细胞贴壁后,弃去原培养液,PBS漂洗1遍,每孔加入50μmol/L的EDU培养基500 μl,37℃孵育2 h后,弃培养基。每孔加入含4%多聚甲醛的PBS 500 μl室温固定30 min,弃固定液;加入 2 g/L 甘氨酸 500 μl,并加入含0.5%TritonX-100的PBS 500 μl破膜,然后加入1 × Apollo®染色反应液 100 μl,避光、室温、脱色摇床孵育30 min后,弃染色反应液;加入含0.5%TritonX-100 的 PBS 500 μl破膜,弃渗透剂;每孔每次加入100 μl甲醇清洗1~2次,每次5 min;PBS清洗1次,每次5 min。最后加入100×Hoechst33342反应液500 μl,避光、室温、脱色摇床孵育30 min后,弃染色反应液;PBS清洗3次,置荧光显微镜下观察。
6.流式细胞仪检测细胞周期:将上述处理好的细胞用胰酶消化,1 300×g离心5 min后收集细胞,400μl75%预冷乙醇固定24 h,振荡器振荡10 min使细胞团块与乙醇充分混合。再次1300×g离心5min后,弃培养液,加入50 mg/L碘化丙锭和50 mg/L RNA酶,避光室温30min,流式细胞仪检测细胞周期。
7.细胞β半乳糖苷酶染色检测细胞提前衰老:将上述处理好的细胞以2×105个/ml接种于小培养皿中,待细胞贴壁后,弃去原培养液,PBS洗涤1次,按照试剂盒说明书依次加入染色固定液室温固定15 min,PBS洗涤3次,加入染色工作液,37℃孵育过夜。阳性细胞的胞质被染成深蓝色,光镜下观察染色结果并进行阳性细胞计数(每皿至少计数200个细胞并计算阳性细胞所占百分比)。
8.吖啶橙染色:将处理好的细胞以2×105个/ml接种于共聚焦培养皿中,待细胞贴壁后,弃去原培养液,PBS漂洗3遍,加终质量浓度为1 mg/L的吖啶橙避光作用2 min,弃染液,用PBS洗涤3遍,每遍避光作用10 min,在荧光显微镜下观察。
9.间接免疫荧光:将处理好的细胞以2×105个/ml接种于共聚焦培养皿中,待细胞贴壁后,弃去原培养液,加入4%多聚甲醛室温固定30 min,弃固定液,加入免疫荧光封闭液封闭1 h,弃封闭液,加入1∶200稀释的LC3-B一抗4℃孵育过夜,弃染液,加入1∶200稀释的相应二抗避光室温孵育2 h,加入DAPI室温避光孵育20 min,弃DAPI,PBS漂洗后在倒置激光共聚焦荧光显微镜下观察并荧光定量。
10.Western印迹:将处理好的两组细胞以1×105个/ml接种于10 cm培养皿,继续培养至90%融合,提取各组细胞总蛋白,BCA试剂盒测定蛋白浓度,SDS-PAGE电泳,转移至硝酸纤维素膜,室温封闭2 h,与LC3-B特异性抗体及相应二抗作用后,经ECL化学发光法显色,凝胶图像分析系统分析蛋白表达,以β肌动蛋白的表达做内参。
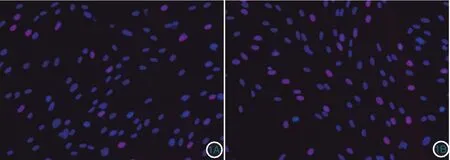
图1 EDU染色检测UVB诱导的提前衰老成纤维细胞条件培养液对成纤维细胞增殖活性的影响(荧光显微镜×100,红色细胞代表处于S期的细胞) 1A:对照组;1B:实验组。实验组S期细胞数目多于对照组
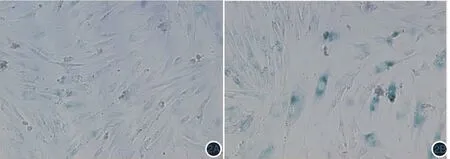
图2 β半乳糖苷酶染色检测UVB诱导的提前衰老成纤维细胞条件培养液对成纤维细胞提前衰老的影响(荧光显微镜×100,蓝绿色细胞代表衰老细胞) 2A:对照组;2B:实验组。实验组成纤维细胞染色阳性率明显高于对照组
结 果
一、UVB诱导的提前衰老成纤维细胞条件培养液对成纤维细胞增殖的影响
CCK8结果显示,实验组细胞增殖活性(A值为0.831±0.017)明显低于对照组(0.973±0.017),差异有统计学意义(t=5.850,P<0.05)。EDU染色结果显示(图 1),实验组S期细胞百分比(28.483%±0.964%)明显高于对照组(18.461%±0.580%),差异有统计学意义(t=8.904,P<0.05)。流式细胞仪检测细胞周期结果显示,实验组S期细胞百分比(16.510%±1.114%)高于对照组(9.593%±0.188%),差异也有统计学意义(t=6.127,P< 0.05)。
二、UVB诱导的提前衰老成纤维细胞条件培养液对成纤维细胞提前衰老的影响
β半乳糖苷酶染色检测显示(图2),实验组成纤维细胞染色阳性率(25.710%±0.304%)明显高于对照组(5.257%±1.023%),差异有统计学意义(t=19.170,P< 0.05)。
三、UVB诱导的提前衰老成纤维细胞条件培养液对成纤维细胞自噬的影响
正常细胞经吖啶橙染色后,在荧光显微镜下可见绿色及暗红色荧光,当细胞自噬水平降低时,红色荧光减弱。对照组的红色荧光定量(29.614±2.650)明显高于实验组(14.287± 2.269),差异有统计学意义(t=4.390,P<0.05)。间接免疫荧光结果表明,实验组成纤维细胞LC3-B表达量(10.133±0.212)明显低于对照组(17.241± 0.207),差异有统计学意义(t=23.970,P<0.05)。见图3。Western印迹结果显示,对照组的LC3-B/LC3-A(1.544±0.011)明显高于实验组(0.540±0.004),差异有统计学意义(t=87.403,P<0.05)。见图 4。
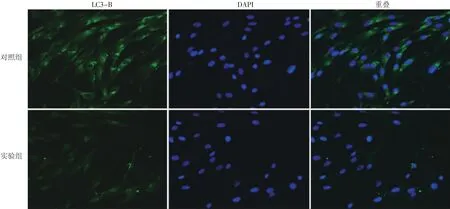
图3 激光共聚焦荧光显微镜下观察UVB诱导的提前衰老成纤维细胞条件培养液对LC3-B表达的影响(间接免疫荧光染色×200) 绿色荧光代表LC3-B表达量,绿色荧光越强,LC3-B表达量越高,自噬越强。实验组成纤维细胞LC3-B的表达量明显低于对照组
讨 论
皮肤老化包括内源性老化和外源性老化,前者由基因决定,后者由烟雾、红外线、营养不良、空气污染、紫外线等引起,其中紫外线的影响最大[5],是皮肤老化的重要机制。人真皮成纤维细胞可通过产生基质、糖化蛋白、黏附因子和多种细胞因子等,维持皮肤的完整性和修复细胞外基质,是光老化过程中的关键细胞[6]。郭娴菲等[7]证明,选择 UVB 每日10 mJ/cm2连续5 d照射成纤维细胞,可成功诱导提前衰老的成纤维细胞。本研究使用相同方法诱导建立成纤维细胞提前衰老模型,且在预实验时已通过β半乳糖苷酶染色法证明成纤维细胞已衰老。
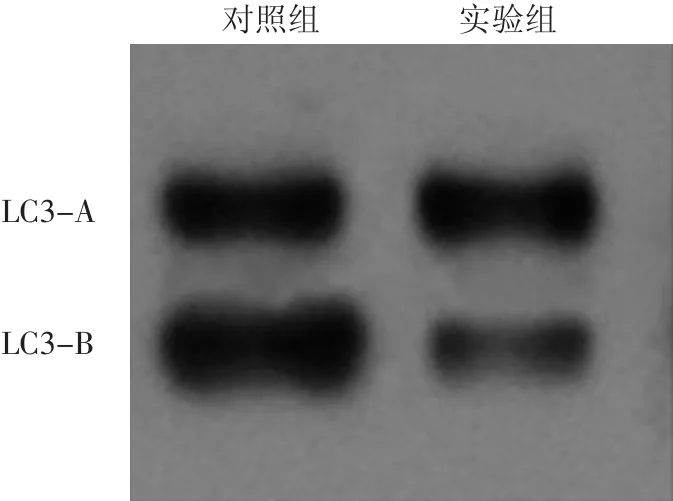
图4 Western印迹法观察UVB诱导的提前衰老成纤维细胞条件培养液对成纤维细胞LC3-B表达的影响 实验组与对照组相比,LC3-A的表达量不变,LC3-B的表达量明显降低
Widel等[3,8]提出紫外线辐射诱导的旁观者效应可能是一种普遍存在的现象。目前多个研究发现,受单次紫外线辐射的细胞分泌低分子量化学因子,这些化学因子影响了未受辐照的附近细胞,从而产生旁观者效应[3]。另有理论[2,8-9]认为,受单次紫外线辐射的细胞、自然老化的细胞分泌的小分子通过“缝隙连接”作用于邻近细胞,产生旁观者效应,这些小分子物质可以使邻近细胞发生与原细胞类似的变化,如增殖减缓、老化加剧等,表明紫外线辐射及自然老化的细胞均可通过直接作用和旁观者作用损害人类健康。Widel等[3,8]证明,接受单次紫外线辐射的成纤维细胞可通过产生氧自由基,使成纤维细胞DNA损伤,从而使成纤维细胞增殖减缓,并将成纤维细胞阻滞在G1期。本研究证明,UVB诱导的提前衰老成纤维细胞条件上清液可使成纤维细胞的增殖减缓。本研究中实验组成纤维细胞G1期细胞百分比较对照组低,S期细胞百分数明显高于对照组,且进一步行EDU细胞增殖实验显示,实验组成纤维细胞的S期细胞百分比要高于对照组。以上结果表明,UVB诱导的提前衰老成纤维细胞条件上清液可以抑制成纤维细胞的增殖,并将细胞阻滞在S期。
蔡霞等[10]证明,正常人成纤维细胞在体外培养过程中,β半乳糖苷酶的表达在老化细胞中显著增强,且这种增强与细胞衰老表型的出现和细胞增殖能力的丧失相平行,可反映细胞的老化程度。本研究中,实验组β半乳糖甘酶染色阳性率明显高于对照组,说明UVB诱导的提前衰老成纤维细胞条件上清液可促进成纤维细胞提前衰老。张青松等[11]证明,UVB诱导的人皮肤成纤维细胞光老化模型中成纤维细胞提前衰老程度越高,增殖越慢,自噬越低。
自噬是细胞利用溶酶体降解自身受损的细胞器和大分子物质的过程,是真核细胞特有的生命现象[12]。本实验采用间接免疫荧光和Western印迹法检测自噬体膜上标志性蛋白质,即微管相关蛋白1的轻链3(LC3),以及用吖啶橙染色法观察自噬细胞。LC3定位于前自噬泡和自噬泡膜表面,参与自噬体的形成。LC3有LC3-A与LC3-B,未发生自噬时,细胞内合成的LC3经过加工,成为胞质可溶性LC3-A,常规表达。当自体吞噬发生时,LC3-A经泛素样加工修饰过程,与自噬膜表面的磷脂酰乙醇胺结合,形成LC3-B。LC3-B结合并始终位于胞内自噬体的膜上,LC3-B/LC3-A比值与自噬泡数量的多少成正比[13-14]。自噬体和溶酶体融合后,可以使用吖啶橙染色法,吖啶橙在自噬溶酶体内酸性磷酸酶活性增强下显著着色,红色荧光量与自噬成正比[15]。本实验中实验组吖啶橙染色红色荧光强度低于对照组,实验组的LC3-B的表达量及LC3-B/LC3-A的比值亦显著低于对照组,表明提前衰老的成纤维细胞条件上清液使LC3-A向LC3-B转化减少,使细胞自噬泡数量减少及细胞清除衰老或损伤的细胞器等的能力明显下降,从而使细胞自噬能力明显减少,不利于细胞内稳态的维持。
综上所述,本实验证明,UVB诱导的提前衰老成纤维细胞条件上清液可以抑制成纤维细胞的增殖,使其阻滞在S期,促进其提前衰老,并使其自噬减少,但其具体机制尚需进一步探讨。
[1]Kang J,Chen W,Xia J,et al.Extracellular matrix secreted by senescent fibroblasts induced by UVB promotes cell proliferation in HaCaT cells through PI3K/AKT and ERK signaling pathways[J].Int J Mol Med,2008,21(6):777-784.
[2]Hubackova S,Krejcikova K,Bartek J,et al.IL1-and TGFβ-Nox4 signaling,oxidative stress and DNA damage response are shared featuresofreplicative,oncogene-induced,and drug-induced paracrine ′bystander senescence′[J].Aging(Albany NY),2012,4(12):932-951.
[3]Widel M.Bystander effect induced by UV radiation;why should we be interested?[J].Postepy Hig Med Dosw (Online),2012,66:828-837.
[4]王申,周炳荣,刘娟,等.中波紫外线诱导的提前衰老成纤维细胞培养液对正常人真皮成纤维细胞的氧化损害[J].中国中西医结合皮肤性病学杂志,2014,13(5):279-282.
[5] Vierkötter A,Krutmann J.Environmental influences on skin aging and ethnic-specific manifestations[J].Dermatoendocrinol,2012,4(3):227-231.
[6]Kim JH,Jung M,Kim HS,et al.Adipose-derived stem cells as a new therapeutic modality for ageing skin[J].Exp Dermatol,2011,20(5):383-387.
[7]郭娴菲,周炳荣,李巍,等.UVB诱导下早衰人皮肤成纤维细胞中miR-34c及SIRT1表达的研究[J].南京医科大学学报(自然科学版),2011,31(9):1289-1293.
[8]Widel M,Krzywon A,Gajda K,et al.Induction of bystander effects by UVA,UVB,and UVC radiation in human fibroblasts and the implication of reactive oxygen species[J].Free Radic Biol Med,2014,68:278-287.
[9]Shao C,Furusawa Y,Aoki M,et al.Role of gap junctional intercellular communication in radiation-induced bystander effects in human fibroblasts[J].Radiat Res,2003,160(3):318-323.
[10]蔡霞,高学军,冯令军,等.正常人成纤维细胞体外培养过程中β-半乳糖苷酶的变化[J].中国临床康复,2005,9(30):224-226.
[11]张青松,鞠梅,陈崑,等.培养的人皮肤成纤维细胞光老化模型中自噬水平的研究[J].中华皮肤科杂志,2010,43(8):572-574.
[12]Klionsky DJ,Emr SD.Autophagy as a regulated pathway of cellular degradation[J].Science,2000,290(5497):1717-1721.
[13] Mizushima N.Methods for monitoring autophagy[J].Int J Biochem Cell Biol,2004,36(12):2491-2502.
[14]Kabeya Y,Mizushima N,Ueno T,et al.LC3,a mammalian homologue ofyeastApg8p,islocalized in autophagosome membranes after processing[J].EMBO J,2000,19 (21):5720-5728.
[15]Martinet W,De Meyer GR,Andries L,et al.In situ detection of starvation-induced autophagy[J].J Histochem Cytochem,2006,54(1):85-96.
《皮肤性病诊疗学杂志》欢迎征订和投稿
《皮肤性病诊疗学杂志》于1994年创刊,是国内外公开发行的双月刊(刊号ISSN 1674-8468,CN 44-1671/R)。本刊为中国学术期刊综合评价数据库统计源期刊,并被中国期刊全文数据库收录,是国内皮肤性病学领域知名的专业期刊之一,目前设有彩色图谱、专题论坛、论著、经验交流、病例报告、公共卫生、护理园地、综述、继续医学教育等栏目。订阅者请在当地邮局订购:邮发代号46-247;每本10元,全年60元。如错过邮局订阅时间,可与编辑部联系办理邮购,汇款时请写清楚订阅者姓名、详细地址、邮政编码、订阅年度和份数。如投稿,请按稿约撰写后通过网上投稿系统(http://pfxbzlx.gdvdc.com)操作。编辑部联系地址:广东省广州市麓景路2号,邮编510091;收款名称:皮肤性病诊疗学杂志编辑部;联系电话020-87256677。
Effects of conditioned medium of prematurely senescent fibroblasts induced by ultraviolet B on cellular proliferation,aging and autophagy of human dermal fibroblasts
Wang Shen,Zhou Bingrong,Luo Dan,Zhang Jia′an,Liu Juan,Zhang Lichao,Yi Fei,Wu Hongjin,Li Dan,Hu Yanyan.
Department of Dermatology,First Affiliated Hospital of Nanjing Medical University,Nanjing 210029,China
s:Luo Dan,Email:daniluo2013@njmu.edu.cn;Zhou Bingrong,Email:bingrong.2002@163.com
Objective To investigate the effects of conditioned medium of prematurely senescent fibroblasts induced by ultraviolet B(UVB)on the proliferation,aging and autophagy of human dermal fibroblasts.Methods Human dermal fibroblasts were isolated from the circumcised foreskin of healthy adolescent males,and subjected to primary culture.Premature senescence was induced in some fibroblasts by UVB radiation at 10 mJ/cm2once daily for 5 consecutive days.Some fibroblasts were classified into two groups:an experimental group cultured in conditioned medium of UVB-induced prematurely senescent fibroblasts,and a control group cultured in conditioned medium of normal fibroblasts.After treatment for 20 consecutive days,cell counting kit-8 (CCK8)assay and 5-ethynyl-2′.-deoxyuridine(EDU)staining were performed to evaluate cellular proliferation,flow cytometry was conducted to estimate cell cycle,βgalactosidase staining to determine the percentage of senescent cells,accridine orange staining to detect the autophagy level,and Western blot and indirect immunofluorescence assay were carried out to determine the expression level of the autophagy-related protein LC3-B.Statistical analysis was done by using a two-samplettest with the Graphpad Prism 5 software.Results Compared with the control group,the proliferative activity of fibroblasts was significantly decreased(0.831±0.017 vs.0.973±0.017,t=5.850,P<0.05),while EDU staining and flow cytometry both showed a significant increase in the percentage of S-phase cells(bothP < 0.05),in the experimental group.The percentage of β-galactosidasepositive fibroblasts was significantly higher in the experimental group than in the control group(25.710%±0.304%vs.5.257% ±1.023%,t=19.170,P<0.05).Accridine orange staining revealed that the red fluorescence intensity of fibroblasts was significantly lower(14.287±2.269 vs.29.614±2.650,t=4.390,P<0.05),while Western blot and indirect immunofluorescence assay both showed a significant elevation in the expression level of LC3-B (bothP<0.05),in the experimental group compared with the control group.ConclusionsThe conditioned medium of prematurely senescent fibroblasts induced by UVB can downregulate autophagy and proliferation of fibroblasts,butaccelerate their aging.
Ultraviolet rays;Fibroblasts;Cell aging;Autophagy;Cell proliferation
10.3760/cma.j.issn.0412-4030.2015.07.011
国家自然科学基金(81371757、81301384、81000700)
骆丹,Email:daniluo2013@njmu.edu.cn;周炳荣,Email:bingrong.2002@163.com
2014-09-05)
(本文编辑:周良佳 颜艳)

