芹菜素抑制人恶性黑素瘤细胞株增殖及侵袭的研究
韩晓东 孟松树 程为 孙喆 倪静 张云飞 林景荣 宋智琦
·论著·
芹菜素抑制人恶性黑素瘤细胞株增殖及侵袭的研究
韩晓东 孟松树 程为 孙喆 倪静 张云飞 林景荣 宋智琦
目的 研究芹菜素对恶性黑素瘤体外抑制作用及其分子机制。方法 将人恶性黑素瘤细胞株A375和C8161分为实验组和对照组,实验组经不同浓度芹菜素处理一定时间,对照组采用二甲基亚砜处理。采用噻唑蓝(MTT)法检测A375和C8161细胞的增殖,划痕法检测细胞迁移。Matrigel侵袭实验检测细胞侵袭性,扫描电镜观察细胞树突形态,膜联蛋白V/碘化丙锭(Annexin-V/PI)法检测细胞凋亡,PI单染法检测细胞周期,Western印迹检测细胞凋亡及细胞外信号调节激酶通路相关蛋白的表达。结果 MTT显示,芹菜素在10~40 mg/L浓度范围内对A375和C8161细胞抑制作用呈量效关系,在0~48 h呈时效关系,与对照组相比差异有统计学意义(均P<0.05);24 h的半数抑制率(IC50)均为25 mg/L。体外迁移试验证实,10、20、25 mg/L芹菜素作用于A375和C8161细胞24 h后可明显抑制细胞迁移(P<0.01)。体外侵袭实验证实,10、20、25mg/L芹菜素作用于A375和C8161细胞72 h,细胞侵袭数量显著少于对照组(P<0.01)。扫描电镜示,经25 mg/L芹菜素作用24 h后,A375和C8161细胞树突均变细长,A375细胞树突长度为(23.30±2.62)μm,与对照组(12.38±2.27)μm相比差异有统计学意义(P<0.01);C8161细胞树突长度为(16.50±1.62)μm,与对照组(9.36±2.51)μm相比差异亦有统计学意义(P<0.01)。10、25 mg/L芹菜素处理24 h后,A375细胞凋亡率分别为(3.30±0.82)%、(10.00±0.60)%,与对照组[(0.40±0.07)%、(4.00±0.70)%]相比差异有统计学意义(均P<0.01);C8161细胞凋亡率分别为(13.10±1.45)%、(25.77±2.40)%,与对照组(7.27±1.31)%相比差异亦有统计学意义(均P<0.01)。25 mg/L芹菜素作用于A375和C8161细胞24 h后,细胞周期阻滞于G2/M期,其比例分别为(48.70±3.04)%、(31.10±1.90)%,与对照组[(21.30±0.75)%、(25.06±2.12)%]相比差异有统计学意义(均P<0.01)。经25 mg/L芹菜素作用24 h后,A375和C8161细胞凋亡相关蛋白活化型半胱天冬酶3(Cleaved caspase-3)和多聚腺苷二磷酸-核糖聚合酶裂解片段(Cleaved PARP)表达均增加,细胞外信号调节激酶通路均被活化。结论 芹菜素可抑制人恶性黑素瘤细胞增殖、迁移、侵袭,诱导细胞凋亡及周期阻滞,其机制可能与调节ERK信号通路相关蛋白的表达有关。
芹菜素;黑色素瘤,实验性;细胞增殖;细胞运动;细胞外信号调节MAP激酶类
由于天然药物或植物来源的药物具有副作用小、患者耐受性好、可长期应用等优势,众多学者致力于该类药物辅助治疗恶性肿瘤的研究。芹菜素是天然存在的黄酮类化合物,是芹菜中的主要生物活性成分,广泛存在于多种水果、蔬菜、豆类和茶叶中。据研究,芹菜素具有抑制离子型谷氨酸受体N-甲基-D-天冬氨酸受体(NMDAR)的作用[1-2]。近年来关于其抑癌的分子机制亦获重大发现[3-4]。本研究旨在探讨芹菜素抑制恶性黑素瘤(恶黑)细胞增殖、侵袭的作用及其分子机制。
材料与方法
一、材料
细胞系:人黑素瘤A375和C8161细胞株产自中国医学科学院基础医学研究所北京协和医学院细胞资源中心。芹菜素(编号A0113,CAS登录号520-36-5,纯度≥98%)产自成都曼斯特生物科技有限公司,用二甲基亚砜(DMSO,美国Sigma公司)溶解至浓度为40 g/L并于4℃储存备用。高糖DMEM培养基、胰蛋白酶产自美国Gibco公司,胎牛血清(FBS)产自浙江杭州天杭生物科技有限公司,噻唑蓝(MTT)、TritonX-100、N-甲基-D-天冬氨酸受体拮抗剂MK801产自美国Sigma公司,不含乙二胺四乙酸(EDTA)的胰蛋白酶产自美国Hyclone公司,Matrigel产自美国BD公司,膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)试剂盒产自南京凯基生物科技发展有限公司,碘化丙锭(PI)、核糖核酸酶(RNase)产自日本TaKaRa公司。抗ERK1/2、phospho-Erk1/2兔抗产自美国Promega公司,抗poly ADP-ribose polymerase(PARP)和半胱氨酰天冬氨酸蛋白酶3(caspase-3)兔抗产自美国Cell Signaling Technology公司;抗β肌动蛋白鼠抗产自美国Sigma公司。
二、方法
1.细胞培养:A375与C8161细胞均用含10%胎牛血清的DMEM常规37℃、5%CO2培养箱中培养,取对数生长期细胞用于实验。配制芹菜素原液于20 mg芹菜素中加入500 μl DMSO。
2.MTT法检测不同药物对细胞增殖的影响:将A375与C8161细胞(1×104/ml)接种于96孔板,每孔200 μl,每组设3个复孔,实验组每孔加入芹菜素原液,使其终浓度分别为 10、20、30、40、50、60 70 mg/L,对照组加等量 DMSO,分别于 24、48 、72 96 h加MTT,继续于培养箱孵育4 h,弃掉培养液加入200 μl DMSO充分振荡,于490 nm波长处用酶标仪检测各孔吸光度值(A)。增殖抑制率(%)=(1-实验组A值/对照组A值)×100%。
3.体外迁移实验(划痕法):将A375与C8161细胞(5 × 105/ml)接种到 24 孔板,每孔 500 μl,于培养箱中孵育24 h,待细胞生长至贴壁率70%~80%后用10 μl枪头垂直孔板轻轻直线刮除细胞,倒置显微镜下观察,照相。实验组分别加入含10、20 25 mg/L芹菜素的培养液,对照组加等量DMSO。继续于培养箱孵育24 h后,倒置显微镜下观察,照相计数各组划痕部位迁移来的细胞数。
4.体外Matrigel侵袭实验:用24孔Transwell小室,每组3个复孔。按照说明书方法进行。用DMEM调整A375和C8161细胞浓度至1×106/ml。均取100μl细胞悬液加入小室内,实验组细胞悬液含浓度为10、20、25mg/L的芹菜素,对照组加等量DMSO,下室按 500 μl/孔加入趋化液(DMEM+10%FBS)。置培养箱中孵育72 h。倒置显微镜下观察穿膜细胞数,光镜(×200)下随机选取5个视野(上、下、左、右和中间)照相,计数。
5.扫描电镜观察细胞树突形态变化:将A375与C8161细胞均按2×104/ml接种于6 cm培养皿中,经25 mg/L芹菜素作用24 h,对照组加等量DMSO。PBS冲洗贴壁细胞后用戊二醛固定,PBS冲洗,叔丁醇逐步脱水处理,借助液氮使叔丁醇结晶,气化,将样本剪至所需大小及形状后贴导电胶置于扫描电镜样品托上,Quanta200F型扫描电镜(美国FEI公司)观察、拍照。
6.Annexin-V FITC/PI双标记法检测细胞凋亡率:将A375与C8161细胞以合适密度接种于6cm培养皿,经10、25 mg/L芹菜素作用24 h,对照组加等量DMSO。用不含EDTA的胰酶消化收集处理后的A375细胞,PBS洗涤2次,调整细胞浓度至1×106/ml,用Annexin-V和PI染色,于室温下避光15 min,流式细胞仪检测凋亡细胞。
7.PI单染法检测细胞周期:将A375与C8161细胞以合适密度接种于6 cm培养皿,经10、25 mg/L芹菜素作用24 h,对照组加等量DMSO。用不含EDTA的胰酶消化收集处理后的A375细胞,PBS洗涤,用75%预冷乙醇固定细胞4 h,分别用500 μl配好的染色液[含480 μl PBS、5 μl P(I5 g/L)、5 μl RNase(10g/L)、10μlTritonX100(10%)]重悬,置 37℃30min后流式细胞仪检测分析周期变化。
8.Western印迹分析:收集经25 mg/L芹菜素或DMSO处理24 h的A375与C8161细胞,加入蛋白裂解液,混匀后冰上裂解30 min,离心后收集上清提取细胞总蛋白,考马斯亮蓝法测定蛋白浓度,均取25 μg蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后,电转至硝酸纤维素膜,5%脱脂牛奶封闭2 h后,加入相应一抗4℃孵育过夜,第2天洗膜后加人辣根过氧化物酶标记的二抗(1∶5 000)室温孵育1 h,洗膜后用ECL显色试剂盒作用1 min,后用Bio-Rad凝胶成像系统成像,用仪器自带软件Image Lab(version 4.0)分析条带灰度。实验用β肌动蛋白做内参照。
结 果
一、芹菜素对细胞增殖的影响
芹菜素对A375和C8161细胞增殖活性的抑制作用在10~40 mg/L浓度范围0~48 h内呈量效关系(F值分别为 181.96,130.37,均P<0.001),在 0~48 h内呈时效关系(F值分别为225.14,199.99,均P<0.001),24 h IC50均为25 mg/L,与对照组相比差异有统计学意义(P<0.05);且芹菜素对A375及C8161细胞的作用剂量与时间均有显著交互效应(F值分别为 11.989,37.220,P<0.01),且该交互作用存在浓度及时间限制。见图1。
二、芹菜素对细胞迁移的影响
芹菜素实验组A375和C8161细胞向划痕部位迁移的数量(个)均显著少于对照组。每视野下A375细胞迁移数量,10 mg/L芹菜素组(3.20±0.84)与20 mg/L组(1.40±0.55)均显著少于对照组(50.00±1.58),差异有统计学意义(t值分别为 58.50、64.94,均P<0.001);C8161细胞迁移数量10 mg/L芹菜素组(11.60±1.52)与 20 mg/L组(3.80±0.84)亦均显著少于对照组(81.00±9.35),差异有统计学意义(t值分别为16.38、18.38,均P< 0.001)。当芹菜素浓度为25 mg/L(IC50),24 h后观察两种细胞株迁移情况,划痕处均未发现迁移细胞。
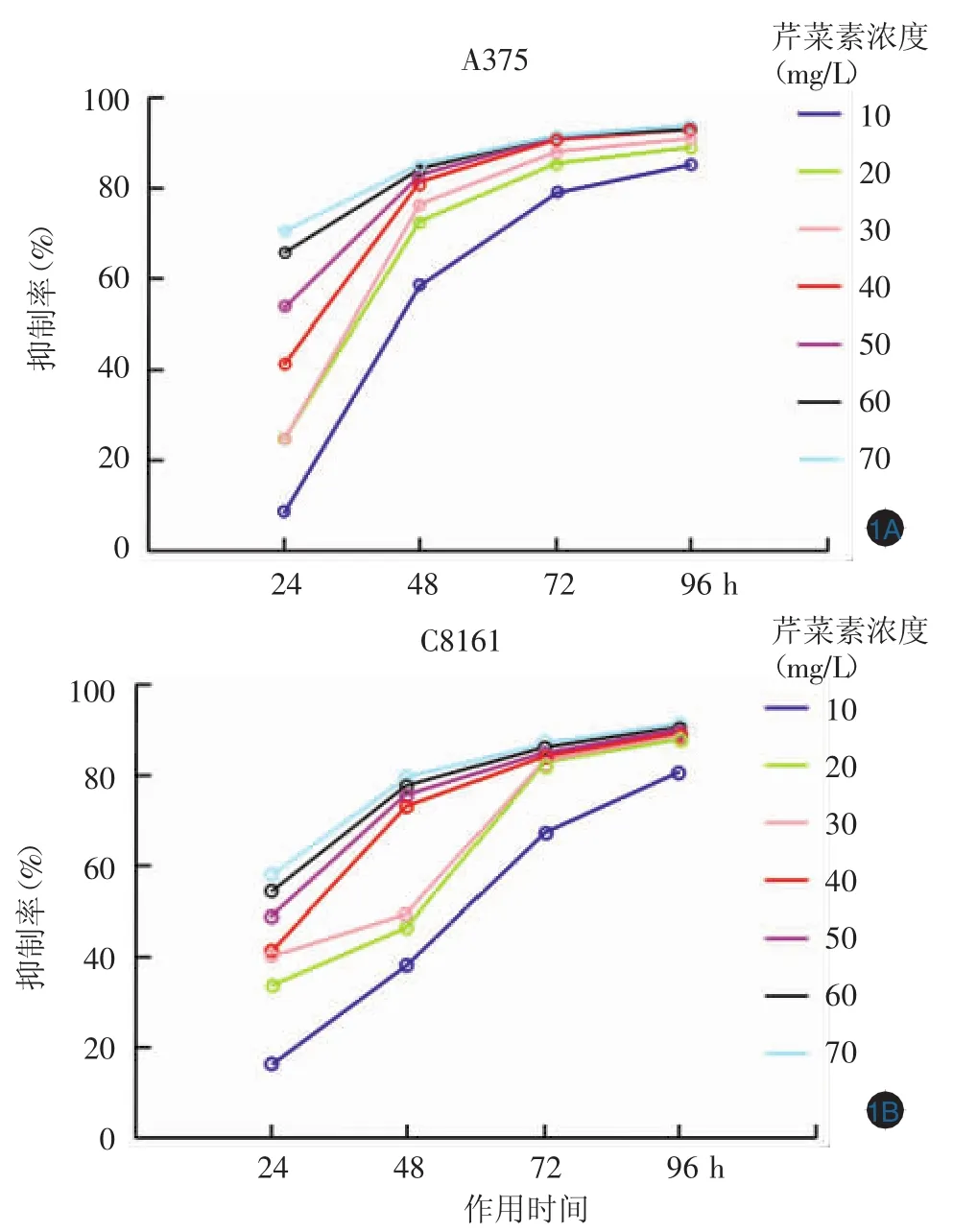
图1 不同浓度芹菜素作用不同时间对细胞增殖的抑制作用1A:A375细胞;1B:C8161细胞

图2 扫描电镜观察细胞形态变化 2A、2C:二甲基亚砜对照组;2B、2D:25 mg/L芹菜素处理组
三、芹菜素对细胞侵袭的影响
芹菜素抑制了A375细胞和C8161细胞侵袭。经芹菜素处理24h后,每视野下A375细胞侵袭数量,10 mg/L芹菜素组(53.00±3.61)显著少于对照组(120.80±7.46),差异有统计学意义(t=18.29,P<0.01);C8161细胞侵袭数量10mg/L芹菜素组(3.00±0.71)显著少于对照组(204.00±13.51),差异有统计学意义(t=33.22,P<0.01)。当芹菜素浓度增加至≥20mg/L,72h后观察两种细胞株侵袭情况,均未发现穿膜细胞。
四、芹菜素对细胞形态的影响
扫描电镜结果,经25 mg/L芹菜素处理24 h后,A375与C8161细胞形态均发生变化,主要表现为细胞树突变细变长(图2)。A375细胞树突长度在25 mg/L芹菜素组为(23.30±2.62)μm,与对照组(12.38±2.27)μm相比差异有统计学意义(P<0.01);C8161细胞树突长度在25 mg/L芹菜素组为(16.50±1.62)μm,与对照组(9.36±2.51)μm 相比差异有统计学意义(P<0.01)。
五、芹菜素对细胞凋亡的影响
10、25 mg/L芹菜素处理24 h后,A375细胞凋亡率分别为(3.30±0.82)%与(10.00±0.60)%,与对照组[(0.40±0.07)% 和(4.00±0.70)%]相比差异有统计学意义(t值分别为 6.11,11.27,均P<0.01);C8161细胞凋亡率分别为(13.10±1.45)%与(25.77±2.40)%,与对照组(7.27±1.31)%相比差异有统计学意义(t值分别为 5.17,11.73,均P< 0.01)。
表1 25 mg/L芹菜素对A375和C8161细胞周期的影响(±s)

表1 25 mg/L芹菜素对A375和C8161细胞周期的影响(±s)
注:n=3。25 mg/L芹菜素组诱导了A375和C8161细胞G2/M期阻滞,与对照组相比,P<0.05
A375 C8161 G0/G1(%) G2/M(%) G0/G1(%) G2/M(%)对照组 51.80±3.29 21.30±0.75 45.37±2.61 25.06±2.12 25mg/L芹菜素 32.30±2.86 48.70±3.04 44.63±3.23 31.10±1.90 t值 7.74 15.13 0.31 3.63 P值 0.01 <0.001 >0.05 <0.01组别
六、芹菜素对细胞周期的影响
25 mg/L芹菜素处理24 h后,可诱导A375细胞和C8161细胞周期阻滞在G2/M期。G2/M期A375细胞和C8161细胞比例在芹菜素组与对照组间差异有统计学意义(均P<0.05),G0/G1细胞比例在芹菜素组低于对照组。见表1。
七、芹菜素对caspase-3、PARP及总ERK1/2、p-ERK1/2蛋白表达的影响
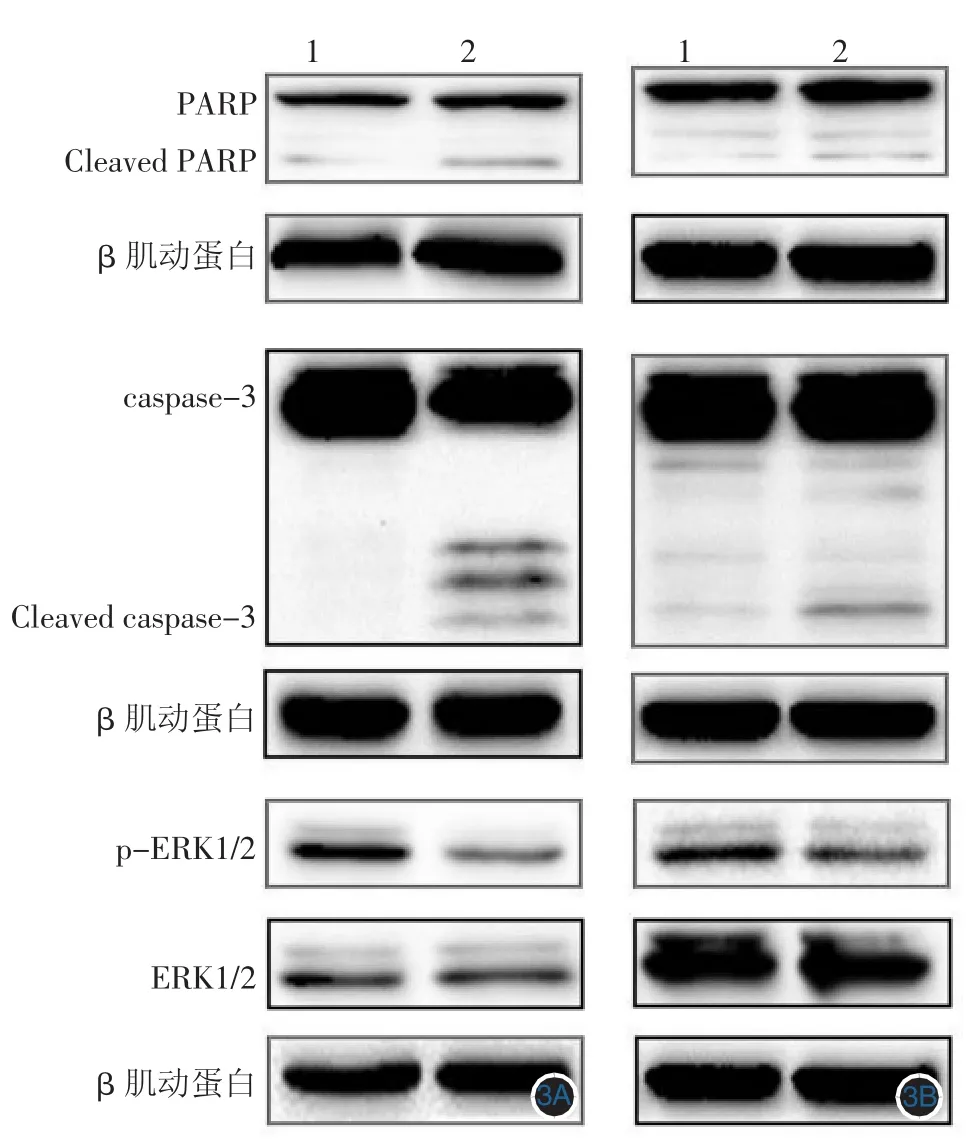
图3 Western印迹检测凋亡相关蛋白caspase-3、PARP及总ERK1/2、p-ERK1/2蛋白表达的影响 3A:A375细胞株;3B:C8161细胞株。PARP:多聚腺苷二磷酸-核糖聚合酶;Cleaved PARP:多聚腺苷二磷酸-核糖聚合酶裂解片段;caspase-3:半胱氨酸蛋白酶-3 Cleaved caspase-3:活化型半胱天冬酶-3和(Cleaved PARP);ERK1/2丝裂原活化蛋白激酶1/2;p-ERK1/2:磷酸化丝裂原活化蛋白激酶1/2。1:二甲基亚砜;2:25 mg/L 芹菜素
Western印迹结果示,经25 mg/L芹菜素作用后A375细胞(图 3A)及 C8161细胞(图 3B)Cleaved caspase-3、Cleaved PARP蛋白表达均较对照组明显增加,而p-ERK1/2蛋白表达下调,总ERK1/2表达不变 (图 3)。当设置组 Cleaved PARP、Cleaved caspase-3、p-ERK的A值为1.00时,其在芹菜素处理组A375细胞中的相对A值分别为(2.72±0.17)、(25.00±2.60)、(0.86±0.08);C8161细胞中A值分别为 (2.26 ± 0.14)、(2.55 ± 0.19)、(0.84 ± 0.09),与对照组相比差异有统计学意义(均P<0.05)。
讨 论
有研究发现,芹菜素能够降低cyclin B的表达及Cdc2的磷酸化并使细胞周期阻滞在G2-M期,从而有效地抑制胰腺癌细胞的增殖[5];并且可通过抑制p34(cdc2)激酶,降低p34与cyclin B1蛋白蓄积导致人结肠癌细胞的细胞周期阻滞于G2/M期[6]。另有报告芹菜素能够下调乳腺癌SK-BR-3细胞中的CDK1、cyclin A及cyclin B的表达,上调CDK抑制因子p21cip1表达,使SK-BR-3细胞周期阻滞于G2-M期[7]。对分别表达野生型p53和视网膜母细胞瘤肿瘤抑制蛋白(Rb)的乳腺癌细胞株MCF-7,以及p53突变与Rb阴性乳腺癌细胞株MDA-MB-468进行研究,发现芹菜素能够抑制细胞增殖、诱导细胞G2/M期阻滞,同时伴随着cyclin B1和CDK1蛋白水平的明显下降,致使CDK1激酶活力明显抑制;进一步研究发现,芹菜素抑制Rb磷酸化,但不影响cyclin E、CDK2 以及 CDK6 的蛋白水平[8]。在对突变型p53人结肠癌细胞株HT-29和人骨肉瘤细胞株MG63研究中发现,芹菜素可显著上调p21/WAF1蛋白表达,抑制细胞增殖、导致G2/M期阻滞,且呈量效与时效关系。提示芹菜素上调p21/WAF1蛋白表达及抑制细胞增殖不依赖p53途径[9]。本研究亦发现芹菜素可诱导黑素瘤A375细胞及C8161细胞周期明显阻滞于G2/M期,因此,有必要对其具体机制进行深入研究。
促进肿瘤细胞凋亡是抗肿瘤药物的主要作用机制。有报告芹菜素可通过改变Bax/Bcl-2比例促进细胞凋亡,这与细胞色素C的释放以及凋亡蛋白酶激活因子-1(Apaf-1)的诱导作用有关,并且导致caspase-3、caspase-9和多聚腺苷二磷酸-核糖聚合酶(PARP)裂解片段的产生[10]。有研究发现,芹菜素可通过促进p53的表达,经转录依赖性与非依赖性途径诱导细胞凋亡;且细胞的生存率随着芹菜素浓度的增加及作用时间的延长而逐渐降低[11]。本研究结果表明,芹菜素可诱导恶黑细胞凋亡,抑制恶黑ERK信号通路活化。
我们前期研究发现,谷氨酸受体拮抗剂MK-801及CPCCOEt可导致人恶黑细胞株WM451细胞树突变细长,其形态接近正常黑素细胞,并且可使细胞骨架蛋白重组、从而抑制WM451细胞的侵袭、迁移[12-14]。本研究表明,芹菜素亦可改变恶黑细胞的树突形态,使树突由短粗的近三角形变为长梭状或细树枝状。推测,芹菜素通过阻断谷氨酸信号通路,导致细胞骨架蛋白的重组及肿瘤细胞分化,从而影响肿瘤细胞的迁移与侵袭。
[1]Kudchadkar RR,Smalley KS,Glass LF,et al.Targeted therapy in melanoma[J].Clin Dermatol,2013,31(2):200-208.
[2]Han JH,Kim KJ,Jang HJ,et al.Effects of apigenin on glutamateinduced [Ca](i)increases in cultured rat hippocampal neurons[J].Korean J Physiol Pharmacol,2008,12(2):43-49.
[3]LakshmananA,DoseffAI,RingelMD,etal.Apigeninincombination with Akt inhibition significantly enhances thyrotropin-stimulated radioiodide accumulation in thyroid cells[J].Thyroid,2014,24(5):878-887.
[4]Shao H,Jing K,Mahmoud E,et al.Apigenin sensitizes colon cancer cells to antitumor activity of ABT-263[J].Mol Cancer Ther,2013,12(12):2640-2650.
[5]Ujiki MB,Ding XZ,Salabat MR,et al.Apigenin inhibits pancreatic cancer cell proliferation through G2/M cell cycle arrest[J].Mol Cancer,2006,5:76.
[6]Wang W,Heideman L,Chung CS,et al.Cell-cycle arrest at G2/M and growth inhibition by apigenin in human colon carcinoma cell lines[J].Mol Carcinog,2000,28(2):102-110.
[7]Choi EJ,Kim GH.Apigenin causes G(2)/M arrest associated with the modulation of p21 (Cip1) and Cdc2 and activates p53-dependent apoptosis pathway in human breast cancer SK-BR-3 cells[J].J Nutr Biochemc,2009,20(4):285-290.
[8]Yin F,Giuliano AE,Law RE,et al.Apigenin inhibits growth and induces G2/M arrest by modulating cyclin-CDK regulators and ERK MAP kinase activation in breast carcinoma cells[J].Anticancer Res,2001,21(1A):413-420.
[9]Takagaki N,Sowa Y,Oki T,et al.Apigenin induces cell cycle arrest and p21/WAF1 expression in a p53-independent pathway[J].Int J Oncol,2005,26(1):185-189.
[10]Shukla S,Gupta S.Molecular mechanisms for apigenin-induced cell-cycle arrest and apoptosis of hormone refractory human prostate carcinoma DU145 cells[J].Mol Carcinog,2004,39(2):114-126.
[11]Shukla S,Gupta S.Apigenin-induced prostate cancer cell death is initiated by reactive oxygen species and p53 activation [J].Free Radic Biol Med,2008,44(10):1833-1845.
[12]Song Z,He CD,Liu J,et al.Blocking glutamate-mediated signalling inhibits human melanoma growth and migration[J].Exp Dermatol,2012,21(12):926-931.
[13]李丽丽,单路娟,张媛,等.谷氨酸信号通路调控恶性黑素瘤侵袭与增殖的实验研究[J].中华皮肤科杂志,2011,44(3):186-190.
[14]卢平,周育森,陈万荣,等.恶性黑素瘤细胞中的谷氨酸信号通路及其与细胞骨架蛋白分子的作用机制[J].中华皮肤科杂志,2009,42(8):575-578.
Inhibitory effect of apigenin on proliferation and invasion of human malignant melanoma cells
Han Xiaodong*,Meng Songshu,Cheng Wei,Sun Zhe,Ni Jing,Zhang Yunfei,Lin Jingrong,Song Zhiqi.*Department of Dermatology,First Affiliated Hospital of Dalian Medical University,Dalian 116011,China
ObjectiveTo evaluate the inhibitory effect of apigenin on malignant melanomain vitro,and to investigate its mechanisms.MethodsHuman malignant melanoma cell lines A375 and C8161 were divided into test groups and control group separately.Cells in the test groups were treated with apigenin at different concentrations,while cells in the control group were treated with dimethyl sulfoxide,for different durations.Subsequently,methyl thiazolyl tetrazolium (MTT)assay,wound healing assay and Matrigel invasion assay were carried out to estimate cellular proliferative activity,migratory activity and invasive activity,respectively,and scanning electron microscopy(SEM)was used to observe morphology of melanocyte dendrites.Flow cytometry using annexin-V/propidium iodide (PI)staining was performed to detect cell apoptosis,propidium iodide(PI)staining to analyze cell cycle,and Western blot to measure the expressions of proteins related to apoptosis and involved in the extracellular signal-regulated kinase(ERK)signaling pathway.ResultsMTT assay showed significant differences in cellular proliferative activity between the test groups and control group (allP<0.05).The proliferation of A375 and C8161 cells was inhibited by apigenin in a dosedependent manner when the concentration of apigenin was 10-40 mg/L,and in a time-dependent manner when the treatment duration varied from 0 to 48 hours.The half-maximal inhibitory concentration (IC50)of apigenin at 24 hourswas 25 mg/L for both A375 and C8161 cells.Wound healing assay showed that the migration of A375 and C8161 cells was significantly decelerated after 24-hour treatment with apigenin of 10,20 and 25 mg/L compared with the control cells(allP<0.01).Matrigel invasion assay demonstrated that the number of invasive cells was significantly smaller in A375 and C8161 cells treated with apigenin of 10,20 and 25 mg/L for 72 hours than in the control cells(allP<0.01).SEM showed that the dendrits of both A375 and C8161 cells became thinner and longer after treatment with 25 mg/L apigenin for 24 hours,with the length of dendrits being(23.30±2.62)μm and(16.50±1.62)μm respectively,compared to(12.38±2.27)μm and (9.36±2.51)μm respectively in the control groups(bothP<0.01).After treatment with apigenin of 10 and 25 mg/L for 24 hours,a significant increase was observed in apoptosis rate in both A375 cells(3.30%±0.82%vs.0.40%±0.07%,P<0.01;10.00%±0.60%vs.4.00%±0.70%,P<0.01)and C8161 cells(13.10%±1.45%vs.7.27%±1.31%;25.77%±2.40%vs.7.27% ±1.31%;bothP<0.01)compared with the control cells.Both A375 and C8161 cells were arrested in G2/M phase after treatment with 25 mg/L apigenin for 24 hours,with the percentage of cells in G2/M phase being 48.70%±3.04%and 31.10%±1.90%respectively,compared to 21.30%±0.75%and 25.06%±2.12%respectively in the control groups(bothP<0.01).Western blot showed an increase in the expressions of apoptosis-related proteins including cleaved caspase-3 and cleaved poly ADP-ribose polymerase(PARP)with the activation of ERK signaling pathway in both A375 and C8161 cells after 24-hour treatment with 25 mg/L apigenin compared with the control groups.Conclusions Apigenin can inhibit the proliferation,migration and invasion of,but induce apoptosis and cell cycle arrest in human malignant melanoma cells,likely by regulating the expression of ERK signaling pathway-related proteins.
Apigenin;Melanoma,experimental;Cell proliferation;Cell movement;Extracellular signalregulated MAP kinases
Song Zhiqi,Email:szqdalian@163.com
10.3760/cma.j.issn.0412-4030.2015.02.015
国家自然科学基金(81472865、81171491);辽宁省自然科学基金(201102056)
116011大连医科大学附属第一医院皮肤科(韩晓东、孙喆、倪静、张云飞、林景荣、宋智琦);大连医科大学肿瘤干细胞研究院(孟松树、程为)
宋智琦,Email:szqdalian@163.com
2014-02-13)
(本文编辑:尚淑贤)

