辅助生殖技术中锌抑制精子氧化损伤作用*
陈芦地 吴金香** 王正尧 谢远志
1. 福建医科大学附属第二医院检验科(泉州 362000)
2. 福建医科大学附属第二医院生殖男科
辅助生殖技术中锌抑制精子氧化损伤作用*
陈芦地1吴金香1**王正尧1谢远志2
1. 福建医科大学附属第二医院检验科(泉州 362000)
2. 福建医科大学附属第二医院生殖男科
目的 探讨辅助生殖技术中锌对精子损伤的保护作用。方法 以辅助生殖技术中常用的密度梯度离心法优选后的精子为研究对象,以过氧化氢为损伤刺激物,应用国联精子检测系统、光学显微镜以及精子DNA碎片分析试剂盒的方法比较精子的活力与存活率,精子质膜完整性以及精子DNA碎片形成,从而分析锌抑制过氧化氢对精子的损伤作用。结果 过氧化氢刺激后精子的活动力与存活率差,精子质膜完整性破坏,大量精子DNA损伤,而锌能明显保护精子的损伤作用。结论 精子损伤与氧化刺激密切相关,在辅助生殖技术中锌可抑制精子的损伤作用。
精子; 活性氧; 生殖技术, 辅助; 锌
活性氧(reactive oxygen species,ROS)是细胞正常代谢产生的有毒物质,ROS增加影响精子质量以及精子DNA完整性,从而导致不孕,反复流产,胎儿畸形等[1,2]。辅助生育技术(assisted reproductive technology,ART)中精子体外优选处理、冷冻及复苏过程中导致的精子氧化损伤影响着精液常规的各项指标[3]。锌是男性体内精子生长发育过程中不可缺少的微量元素。大量研究表明[4-6],体内锌具有抗氧化作用,然而ART中锌能否保护精子受氧化刺激的损伤作用,目前尚无研究,本研究在优选后的精子中加入适量的锌,通过比较精子的活动力与存活率以及精子低渗肿胀实验和精子DNA碎片检测判断锌能否抑制过氧化氢的氧化损伤作用,旨在判断ART中锌能否抑制精子受氧化刺激的损伤作用。
材料和方法
一、材料
10例正常健康男性精液样品,取自本院有生育能力的青年自愿者,年龄25~30(26±2)岁。ZnCl2为瑞士Adamas-beta公司产品。30% H2O2由西陇化工股份有限公司提供。40%上层梯度离心液、80%下层梯度离心液和洗精液均为美国Quinn's公司产品。膨胀液购于北京雷根生物技术有限公司。精子DNA碎片检测试剂盒购于深圳博锐德生物科技有限公司。精子质量分析系统为北京国联医疗技术有限公司产品。 OLYMPUS. CX31型光学显微镜为日本OLYMPUS公司生产。
二、方法
本研究设计不同的浓度梯度的H2O2(0.1%,0.01%和0.001%)和ZnCl2(50,25,12.5,6.2 nmol L-1),应用国联精子检测系统检测精子的存活率和活力来选择最佳的干预浓度为0.001% H2O2和12.5 nmol L-1ZnCl2。10份正常精液标本,置37℃水浴箱待液化,分别用40%和80%高密度离心液制备梯度液,300×g,离心15min获取优质精子,Quinn's洗精液300×g,离心5min洗涤优质精子2次后将精子密度至5~10×109/L,每份0.3mL平均分为3组:(1)ZnCl2+H2O2组 含12.5 nmol L-1ZnCl2及0.001%的H2O2;(2)H2O2组 含0.001% H2O2;(3)空白组 加入等体积0.9% NaCl2。3组同时置37℃,5% CO2孵箱中孵育5h和24h后分析不同实验组之间的差异。
(一)精子活动力与存活率的分析
3组同时置37℃,5% CO2孵箱中孵育5h和24h后,用国联精子检测系统观察精子运动功能的变化,从而判断精子的活动力与存活率。
(二)精子质膜完整性的判断
应用低渗膨胀实验来评估精子质膜的完整性:3组实验分别取100μL样品置1mL膨胀液中静置37℃,5min后,各取10μL于洁净载玻片,并覆盖上盖玻片,随机选取视野观察(×400倍),计数200个精子,按以下公式计算出质膜完整精子百分率:

(三)精子DNA碎片的检测
本实验采用精子染色质扩散法进行检测:3组实验分别取60μL参照精子DNA检测试剂盒说明书进行操作。DNA完整的精子在经过变性和去掉核蛋白后DNA扩散形成特征性的光晕,而存在DNA碎片的精子不会产生这种特征性的光晕。根据光晕的有无和大小判断精子DNA的完整程度。精子DNA碎片判断标准:精子头部仅产生较小的光晕或无光晕,单侧光晕的厚度不超过精子头部最小直径的1/3,(如图1)。随机选取视野观察(×400倍),计数500个精子,按以下公式计算出存在DNA碎片精子百分率:

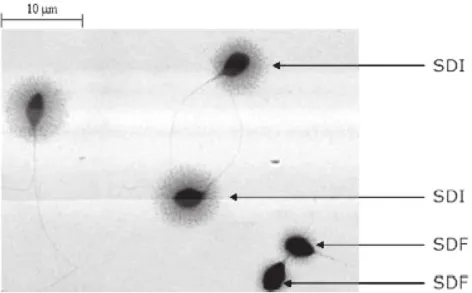
图1 精子DNA碎片检测示意图SDF: 精子DNA碎片(Sperm DNA fragmentation); SDI:精子DNA完整(Sperm DNA integrity)
(四)统计学分析
应用SPSS 20.0软件进行统计分析,多组的均数比较采用随机区组设计的方差分析,组间两两比较采用LSD法,双侧检验,P<0.05认为差异有统计学意义。
结 果
一、锌对过氧化氢影响优选后精子活力与存活率的保护作用
10例正常健康男性精液经ART中精液优化处理后在H2O2作用下精子运动能力显著下降,明显低于同时加入适量ZnCl2的实验组,结果见表1。
表1 3组精子孵育5h和24h后活力与存活率的比较(n=10,s, %)

表1 3组精子孵育5h和24h后活力与存活率的比较(n=10,s, %)
与空白组比较, *为P<0.05; 与H2O2组比较, #P<0.05; 与5h比较, △为P<0.05
活力 存活率5h 24h 5h 24h空白组 84.25 78.61 94.2 92.14 H2O2组 3.43* 0*△ 23.24* 0*△ZnCl2+ H2O2组 26.14*# 0.79*△# 61.32*# 6.35*△#
二、锌对优选后精子抑制过氧化氢损伤精子质膜的作用
10例正常健康男性精液经ART中精液优化处理后H2O2具损伤精子质膜的作用,且损伤程度明显高于同时加入适量ZnCl2的实验组,结果见图2。
三、锌对优选后精子保护过氧化氢损伤精子DNA的作用
10例正常健康男性精液经ART中精液优化处理后在H2O2刺激下精子DNA完整性严重破坏,DNA损伤程度明显高于同时加入适量ZnCl2的实验组,结果见图3。
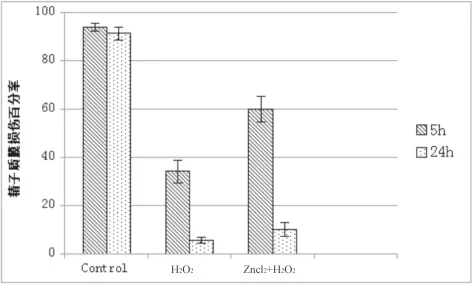
图2 3组精子质膜完整度比较(n=10,s, %)
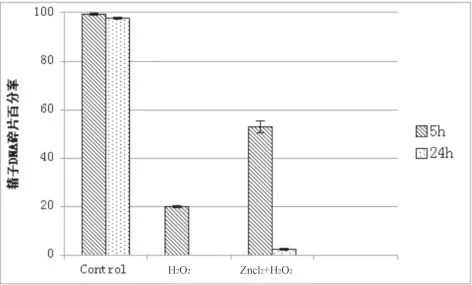
图3 3组精子DNA损伤程度比较(n=10,s, %)
讨 论
锌是人体内必需的200多金属-酶的作用微量营养素之一,它在男性的生育能力至关重要的作用。锌的缺乏可影响精子发生和降低血清睾酮水平[7]。有研究表明,它在正常睾丸的生长、精子发生和精子生理学中的作用。精浆中的锌由前列腺分泌,其作为精浆中的一种微量元素,对精子的发生、成熟和获能具有一定的作用[8]。
辅助生殖技术是治疗不孕症的主要方法。然而辅助生殖技术精子体外操作过程中密度梯度离心的精子优选方法以及冻结和复苏等技术会导致精子的氧化损伤,影响精液参数。精浆是抗氧化剂的天然环境,精子抗氧化作用依赖于精浆中提供的天然抗氧化系统如维生素C和E,超氧化物歧化酶,谷胱甘肽等直接作用的自由基清除剂[9]。然而在辅助生殖技术操作过程中使精子失去精浆的保护作用以及抗氧化能力。在现代辅助生殖技术和不孕不育的诊疗过程中,如何改善不孕患者体内抗氧化应激功能以及提高男性生育能力,已经得到了相当的重视[10]。
人体在正常情况下,精子中活性氧的产生和清除存在动态平衡,不会对精子的结构和功能产生不利的影响。目前国内外大量的研究表明:精子DNA碎片化形成可能与炎症、凋亡、氧化损伤以及环境因素等多种因素作用相关[11-13]。当男性生殖系统发生缺氧、炎症以及ART前期对精子的离心、冷冻及复苏等会产生高水平的ROS,超过了精子自身抗氧化系统的清除能力,从而导致精子质膜的过氧化和DNA损伤。男性精子DNA碎片化的形成造成精子内部遗传信息的不完整,严重影响生育情况,会导致不孕,反复流产,胎儿畸形,造成胎儿发育停滞,辅助生殖失败等。
本研究主要采用ART中优选的精子为实验对象,以过氧化氢为氧化刺激物,通过适量的ZnCl2进行干预,通过国联精子软件分析、低渗肿胀实验以及精子DNA碎片的检测判断锌能否抑制过氧化氢对精子的氧化损伤作用,实验结果表明,在ART中适量的锌是能保护精子抗氧化刺激作用,不仅能提高精子的活动力与存活率,还抑制过氧化氢对精子质膜的损伤作用,同时降低过氧化氢对精子DNA的损伤作用。锌抗氧化作用的具体机制还有待进一步研究,该实验为将来的进一步机制研究以及动物实验打下基础;在本研究中发现体外培养基中Zn2+浓度远低于精浆中的Zn2+浓度,主要是Zn2+在体内不同部位的浓度分布不一,ART中应用的培养基主要是参照输卵管液,可见在输卵管位置Zn2+的量明显少于精浆。
1 Gharagozloo P, Aitken RJ. The role of sperm oxidative stress in male infertility and the signifi cance of oral antioxidant therapy. Hum Reprod 2011; 26(7): 1628-1640
2 Lombardo F, Sansone A, Romanelli F, et al. The role of antioxidant therapy in the treatment of male infertility:an overview. Asian J Androl 2011; 13 (5): 690-697
3Fatma BA, Nozha CF, Ines D,, et al. Sperm quality improvement after date seed oil in vitro supplementation in spontaneous and induced oxidative stress. Asian J Androl 2009; 11 (3): 393-398
4 Ebisch IM, Thomas CM, Peters WH, et a1.The importance of folate, zinc and antioxidants in the pathogenesis and prevention of subfertility. Hum Reprod Update 2007; 13(2): 163-174
5 Sankako MK, Garcia PC, Piffer RC, et a1. Possible mechanism by which zinc protects the testicular function of rats exposed to cigarette smoke. Pharmacol Rep 2012;64(6): 1537-1546
6 Kotdawala AP, Kumar S, Salian SR, et a1. Addition of zinc to human ejaculate prior to cryopreservation prevents freeze-thaw-induced DNA damage and preserves sperm function. J Assist Reprod Genet 2012; 29(12):1447-1453
7 Wong WY, Merkus HM, Thomas CM, et al. Effect of folic acid and zinc sulphate on male factor sub fertility, a double blind, randomized placed controlled trial. Fertil Steril 2002; 77(3): 491-498
8 Elgazar V, Razanov V, Stoltenberg M, et al. Zincregulating proteins, ZnT-1, and metallothionein I/II are present in different cell populations in the mouse testis. J Histochem Cytochem 2005; 53(7): 905-912
9 Niki E. Action of ascorbic acid as scavenger of active and stable oxygen radicals. Am J Clin Nutr 1991; 54(6 Suppl): 1119S-1124S
10 Donnelly ET, McClure N, Lewis SE. The effect of ascorbate and α-tocopherol supplementation in vitro on DNA integrity and hydrogen peroxide-induced DNA damage in human spermatozoa. Mutagenesis 1999; 14(5):505-512
11 Dupont C, Faure C, Sermondade N, et a1. Obesity leads to higher risk of sperm DNA damage in infertile patients. Asian J Androl 2013; 15(5): 622-625
12 López G, Lafuente R, Checa MA, et a1. Diagnostic value of sperm DNA fragmentation and sperm highmagnification for predicting outcome of assisted reproduction treatment. Asian J Androl 2013;15(6): 790-794
13 Zhang HB, Lu SM, Ma CY, et a1. Early apoptotic changes in human spermatozoa and their relationships with conventional semen parameters and sperm DNA fragmentation. Asian J Androl 2008; 10(2): 227-235
(2015-08-18收稿)
Zinc protects sperm from being damaged by reactive oxygen species in assisted reproductive technology*
Chen Ludi1, Wu Jinxiang1**, Wang Zhengyao1, Xie Yuanzhi2
1. Department of Clinical Laboratory, Second Hospital Affi liated to Fujian Medical University, Quanzhou 362000, China 2. Department of Reproductive of Andrology, Second Hospital Affi liated to Fujian Medical University Corresponding author: Wu Jinxiang, E-mail: pursuer@163.com
Objective To explore the protective action of zinc insperm damage during assisted reproductive technology. Methods Preferring the sperm samples which were selected by density gradient centrifugation in assisted reproductive technology were used for the study. Uder stimulation of hydrogen peroxide, sperm motility, viability, sperm membrane integrity and DNA fragmentation were detected by Goodline sperm detection system, optical microscopy and sperm DNA fragmentation assay kit respectively, and the effect of Zinc on sperm damage from hydrogen peroxide was evaluated. Results The motility and vitality of sperms were decreased, the membrane integrity was destroyed and lots of sperm DNA were damaged under hydrogen peroxide stimulation. However, Zinc could protect sperm from damage obviously. Conclusion Sperm injury is closely associated with oxidative stimulation. Zinc could induce sperm damage in assisted reproductive technology.
spermatozoa; reactive oxygen species; reproductive techniques, assisted; Zinc
10.3969/j.issn.1008-0848.2015.10.002
R 321. 1
资助: 福建省卫生厅青年科研基金资助项目(NO.2011-1-36); Project supported by the Youth Research Foundation of Fujian Provincial Department of Health(NO.2011-1-36)
**通讯作者, E-mail: pursuer@163.com

