重组鱼腥藻脂肪氧合酶定点突变及突变酶酶学性质研究
刁含文,张 充,吕凤霞,别小妹,陆兆新(南京农业大学食品科学与技术学院,江苏南京210095)
重组鱼腥藻脂肪氧合酶定点突变及突变酶酶学性质研究
刁含文,张充,吕凤霞,别小妹,陆兆新*
(南京农业大学食品科学与技术学院,江苏南京210095)
重组鱼腥藻脂肪氧合酶(Ana-LOX)基因来自于Anabaena sp.PCC 7120。利用定点突变技术将Ana-LOX的421位和40位的缬氨酸(Val)突变为丙氨酸(Ala),获得突变体V421A、V40A和V421A/V40A。野生型Ana-LOX在50℃下半衰期为3.8 min。而突变酶V421A和V40A在50℃的半衰期分别为4.4 min和7.0 min。突变酶V421A/V40A的半衰期为8.3 min,与野生型Ana-LOX相比,提高了1.18倍。相对于野生酶,突变酶V421A、V40A和V421A/V40A的比活力分别提高了4.83%、41.58%、80.07%。突变酶的最适反应温度均比野生酶(35℃)高5℃。改造后的突变酶更能适合工业生产的需要,对于实际应用具有重要价值。
脂肪氧合酶,定点突变,酶学性质
脂肪氧合酶(Lipoxygenase,EC1.13.11.12,LOX)是一类含有非血红素铁的蛋白,能够催化具有顺,顺-1,4-戊二烯结构的多元不饱和脂肪酸的双加氧反应[1],形成具有共轭双键的脂肪酸氢过氧化物。LOX在食品工业、医药工业[2]和化工领域[3-4],具有广泛的应用。食品方面,LOX能够将面粉中的不饱和脂肪酸催化氧化成相应的氢过氧化物。这些氢过氧化物能够破坏β-胡萝卜素的双键结构,并且能够将面粉蛋白中的巯基(-SH)氧化成为二硫键(-S-S-),从而起到提高面粉白度,增强面筋蛋白的强度的作用[5];化工方面,LOX早已被用于造纸业[3]和纺织工业[4]的脱色,市场需求巨大。脂肪氧合酶广泛存在于植物、动物[6-7]中,在微生物中鲜有发现。近年来,Anabaena sp.PCC 7120已被证实为能够生产脂肪氧合酶的微生物[2,8-9]。但是Ana-LOX的热稳定性较差,无法直接用于工业生产中。因此,为了使Ana-LOX获得更为广泛的工业应用,提高Ana-LOX的热稳定性是非常必要的。本实验室张充等[10]已成功对Anabaena sp.PCC 7120 LOX(Ana-LOX)基因进行克隆表达,但是未对其性质进行改造。
定点突变常作为用于提高酶分子催化特性的策略[11-12]。Wennman等[13]通过定点突变替换Gly332,Leu336和Phe337单个氨基酸研究锰型脂肪氧合酶和铁型脂肪氧合酶的催化特性。通过序列比对和同源建模,获得合适的目标位点,再对这些位点进行定点突变以提高酶分子热稳定性[14-15]。这种基于理性设计的方法相较随机突变等非理性设计方法更加方便、高效和可行[16]。目前国内外未有关于定点突变提高Anabaena sp.PCC 7120的重组鱼腥藻脂肪氧合酶热稳定性和酶活的报道,本研究对来源于Anabaena sp. PCC 7120的重组鱼腥藻脂肪氧合酶进行定点突变,提高了其热稳定性和酶活,拓展重组鱼腥藻脂肪氧合酶在工业方面的应用前景。
1 材料与方法
1.1材料与仪器
具有编码鱼腥藻(Anabaena sp.PCC 7120)脂肪氧合酶基因的表达载体pET-32a(+)/Ana-LOX由本实验室构建[2];Escherichia coli DH5α(△LacU169(Φ80 LacZ△M15)克隆宿主、E.coli BL21(DE3)pLysS(F-ompT hsdSB(rB-mB-)gal dcm(DE3)pLysS Camr) 为本实验室保藏;DNA Marker、IPTG购自TaKaRa公司;氨苄青霉素购自Amresco;琼脂糖、胰蛋白胨和酵母粉为Oxoid公司生产;其他常规试剂均为分析纯;突变试剂盒(Fast Mutagenesis Kit and Taq Master Mix)购自诺唯赞Vazyme(Nanjing,China);DNA凝胶回收试剂盒(Gel Extraction Kit)、质粒提取试剂盒(Bacterial DNA Kit)购自OMEGA(Shanghai,China);LB培养基胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g。加水溶解后,用5 mol/L NaOH将pH调到7.0。加水定容到1000mL。配制固体培养基时,按每100 mL加入琼脂粉1.5 g。
SWCJ1FD型单人单面净化工作台苏州净化设备有限公司;培英HYLA全温摇瓶柜太仓实验设备厂;UV2600紫外可见分光光度计日本岛津公司;5804 R高速冷冻离心机Eppendorf德国基因公司;EPs6o4稳压水平电泳仪南京科宝仪器公司;手提式蒸汽压力灭菌器上海医用核子仪器厂;PTC100TM PCR仪MJ Research公司;JC380c全自动数码凝胶成像分析仪上海培清科技有限公司;JY91ⅡDN超声波破碎仪宁波新芝生物科技股份有限公司。
1.2实验方法
1.2.1Ana-LOX基因多序列比对和同源建模将Ana-LOX基因序列经BLAST(http://blast.ncbi.nlm. nih.gov/BLAST.cgi)与GenBank中的非冗余蛋白数据库进行同源性比对,选择相似性较高的基因序列以作为同源建模的模板。再利用Swiss-Model软件(http://swissmodel.expasy.org/)[17]进行同源建模,预测重组Ana-LOX的三维结构,采用Rasmol对其三维结构进行进一步分析以获得合适的突变位点。
1.2.2Ana-LOX基因的定点突变通过以上多序列比对和同源建模分析,我们选择421位点和40位点作为定点突变靶位点。利用定点突变试剂盒(Mut Express II Fast Mutagenesis Kit)获得突变型脂肪氧合酶重组表达载体。根据其使用说明书,对野生型脂肪氧合酶重组表达载体pET-32a(+)/Ana-LOX的DNA进行扩增,获得线性形式的重组表达载体DNA,再利用同源重组酶进行环化获得完整的突变型脂肪氧合酶重组表达载体。所有突变基因都送至Invitrogen Life Technologies(Shanghai,China)基因序列测序验证,通过测序验证后,将正确突变的重组表达载体转化入E.coli BL21(DE3)进行蛋白表达。用于定点突变的引物如下:V421A-f:TACAACTCAgctGCAGTATATG GATCGGATTTACTCAAACA;V421A-r:ATATACTGC agcTGAGTTGTATCGAATTGATGAAAGTACCC;V40A-f:CCCTCTCCCAgcgACTGAAATTCCTTCTAAAAGATT CC;V40A-r:GAATTTCAGTcgcTGGGAGAGGGAAAT AAACTGGTTTTC。
如上所示,我们利用两对寡核苷酸引物进行定点突变获得了两个重要的突变体(V421A和V40A)。
1.2.3重组脂肪氧合酶的诱导表达分别挑取含有重组表达载体的野生菌和突变菌E.coli BL21(DE3)接种于20 mL含100 μg/mL氨苄青霉素的LB液体培养基中,37℃、180 r/min摇床培养12 h获得种子液。分别取100 μL种子液接种于100 mL含100 μg/mL氨苄青霉素的LB液体培养基中,37℃、180 r/min摇床培养至发酵液菌体浓度达到OD600=0.6时,加IPTG至100 μg/mL,16℃、180 r/min进行低温诱导表达16 h。4℃、9000 r/min离心5 min,收集菌体。
1.2.4重组脂肪氧合酶的分离纯化将诱导表达收集到的菌体,用磷酸缓冲液(50 mmol/L PBS+0.3 mol/L NaCl+0.5%Triton X-100)重悬菌体,超声波破碎菌体(400 W,超声5 s,间歇10 s,共超声15 min),4℃、9000 r/min离心10 min,收集上清液作为粗酶液[10]。将处理得到的粗酶液按照Ni-NTA His Tag Kit说明书依次用含不同浓度咪唑(50、100、150、200 mmol/L)的洗脱液洗脱Ni-NTA柱,收集洗脱峰,测定相应的酶活。
1.2.5SDS-PAGE分析SDS-PAGE电泳参照Lorenzi等[6]报道的方法,将纯化前后的野生型和突变型Ana-LOX进行SDS-PAGE电泳(SDS聚丙烯酰胺凝胶电泳),浓缩胶浓度为5%,分离胶浓度为10%,胶厚1.0 mm。电泳完毕后,取出凝胶,固定、考马斯亮蓝R-250染色、脱色后观察并拍照。
1.2.6重组脂肪氧合酶酶活测定脂肪氧合酶活性分析用亚油酸钠作为底物。酶反应体系中含有:pH9.0的Tris-HCl缓冲液2.79 mL,酶液10 μL,亚油酸钠200 μL,混匀后放入35℃水浴中并开始计时,反应3 min后测定吸光度[18]。酶活单位定义:在上述条件下以1 min内3 mL反应体系在234 nm的吸光度增加0.001作为一个酶活力单位U[19]。
1.2.7重组脂肪氧合酶酶学性质研究重组脂肪氧合酶的最适反应温度:将缓冲液分别在25、30、35、40、45、50、55、65℃水浴中保温10 min,加入10 μL待测酶液,在不同温度下反应3 min,在234 nm下测定吸光值,以不加酶的溶液作对照。以温度为横坐标,酶活力为纵坐标作图,得到该酶的最适反应温度。
重组脂肪氧合酶的半衰期:将待测酶液分别在50℃的水浴中保温,每隔5 min取出一组样品,迅速置于冰水中,待保温结束后统一进行酶活力测定,以未处理酶液做为对照。以温度为横坐标,酶活力为纵坐标,得到温度对酶活力的影响曲线。
重组脂肪氧合酶的最适pH:以亚油酸钠为底物,分别用浓度为50 mmol/L的柠檬酸-柠檬酸钠(pH4~6)、磷酸盐(pH6~8)、Tris-HCl(pH7.5~9)、硼酸/硼酸钠(pH8~11)的缓冲液作为Ana-LOX催化反应的条件,按酶活力测定方法中所述,进行酶活测定。
表观动力学参数(Km和kcat):以0.15 mol/L Tri-HCl Buffer(pH9.0)为缓冲液,以浓度梯度为0.01、0.015、0.025、0.05、0.075、0.1、0.125 mmol/L的亚油酸为底物,进行酶活测定。所有测定重复三次,利用获得的数据绘制双倒数曲线图对动力学参数进行评估。
2 结果与分析
2.1定点突变和突变体表达
根据多序列比对和同源建模,选取421位点和40位点作为突变位点。通过定点突变利用丙氨酸(Ala)替换重组表达载体上野生型Ana-LOX基因中421位点和40位点的缬氨酸(Val),获得了突变体V421A和V40A。而突变体V421A/V40A是以pET-32a(+)/Ana-LOX-V421A为模板,利用V40A的引物进行定点突变获得的。将突变型Ana-LOX重组表达载体转入E.coli BL21大肠杆菌工程菌,对野生型和突变型脂肪氧合酶进行相同条件下的发酵表达。
2.2重组Ana-LOX分离纯化
利用Ni-NTA His Tag Kit对重组Ana-LOX进行分离纯化。如图1所示,对纯化前后野生型和突变型重组Ana-LOX进行SDS-PAGE检测,SDS-PAGE分析显示所有的重组Ana-LOX(左)均能被E.coli表达系统分泌表达,而且分泌表达的重组Ana-LOX经纯化后(右)条带单一,结果显示纯化效果较好。
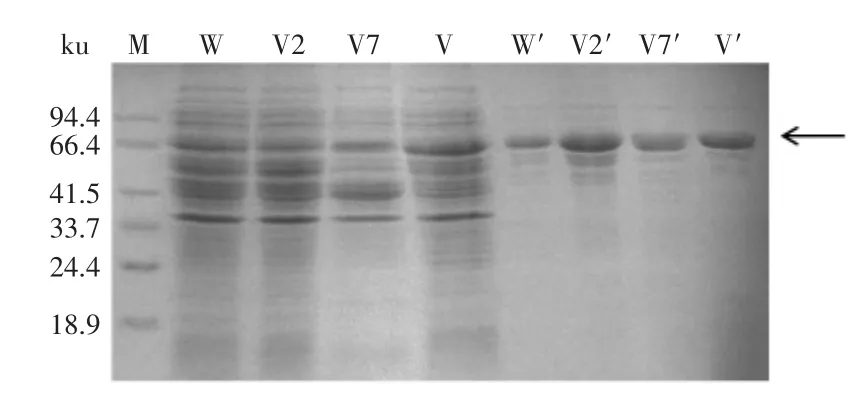
图1 SDS-PAGE电泳分析纯化前后野生型和突变型Ana-LOXFig.1 SDS-PAGE analysis for unpurified and purified wildtype Ana-LOX and mutants
2.3野生型和突变型Ana-LOX活力测定
经过对野生型和突变型Ana-LOX发酵表达和活力测定,突变体V40A,V421A以及它们的组合体V421A/V40A均表现出比野生型Ana-LOX更高的比活力。值得注意的是,突变体V40A和V421A的比活力相对于野生型Ana-LOX分别提高了4.83%和41.58%。而其组合体V421A/V40A的比活力提高80.07%(图2,表1),分析可知组合体V421A/V40A是对突变体V40A和V421A的优势组合,产生了协同作用。以上结果显示用丙氨酸(Ala)替换重组Ana-LOX基因中421位点和40位点的缬氨酸(Val)能够提高重组Ana-LOX的比活力。

图2 野生型和突变型Ana-LOX相对酶活Fig.2 Comparative activity of the wild-type Ana-LOX and the mutant enzymes
2.4重组Ana-LOX的性质研究
2.4.1重组脂肪氧合酶的最适反应温度将纯化后的重组酶在不同的温度条件下,以相同的酶蛋白浓度和底物浓度的作为反应体系进行反应,测定各条件下的活力。结果表明野生型重组脂肪氧合酶的最适反应温度为35℃(图3)。而突变酶V421A、V40A和V421A/V40A的最适反应温度均较野生酶提高了5℃,达到40℃。观察图3,还可以发现20~55℃温度区间里,突变酶V421A、V40A和V421A/V40A的相对酶活均高于野生酶。
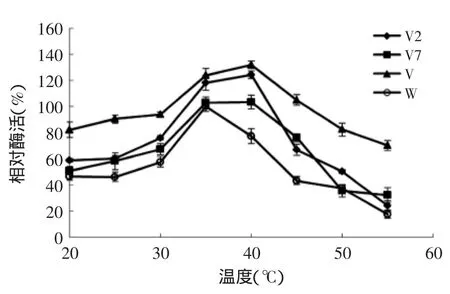
图3 野生型和突变型Ana-LOX最适反应温度Fig.3 Optimal reaction temperatures of the wild-type Ana-LOX and the V2,V7 and V mutants
2.4.2重组脂肪氧合酶的热稳定性对重组Ana-LOX的热稳定性进行了研究。如图4和表1所示,野生酶在50℃下的半衰期(T1/2)为3.8 min。而突变酶V421A和V40A的T1/2分别为4.4 min和7.0 min。他们的优势组合体V421A/V40A的T1/2则达到了8.3 min,显示出组合体V421A/V40A除了在活力方面具有协同作用外,在热稳定性方面也存在着优势累加的协同作用。以上结果表明用Ala替换重组Ana-LOX基因中421位点和40位点的缬氨酸Val能够提高重组Ana-LOX的热稳定性。
2.4.3重组脂肪氧合酶的最适pH将纯化的重组酶在不同的pH条件下,以相同的酶蛋白浓度和底物浓度的作为反应体系进行反应,测定各条件下的活力。不同pH对重组脂肪氧合酶活力的影响。如图5所示,野生型和突变型重组脂肪氧合酶的最适反应pH均为9。
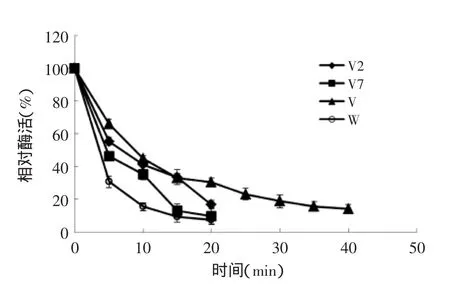
图4 野生型和突变型Ana-LOX 50℃下半衰期Fig.4 The half-life(T1/2)of the wild-type Ana-LOX and the V2,V7 and V mutants at 50℃
2.4.4重组脂肪氧合酶的动力学分析野生型和突变型脂肪氧合酶的催化特性,通过测定不同底物浓度下的反应速率获得。如表1所知,突变酶V421A/V40A的Km相对野生酶显著降低,而突变酶V421A和V40A没有显著的变化。酶分子的Km越低,其与底物的亲和力越高,因此突变酶V421A/V40A相对野生酶与底物更具有亲和力。kcat与Km的比值(kcat/Km)表示酶分子的催化效率,如表1所示,重组Ana-LOX的催化效率与其比活力有着相同的变化趋势。突变酶的催化速率(kcat)均高于野生酶,并且突变体V421A具有最高的催化速率,达到了野生型的1.65倍。
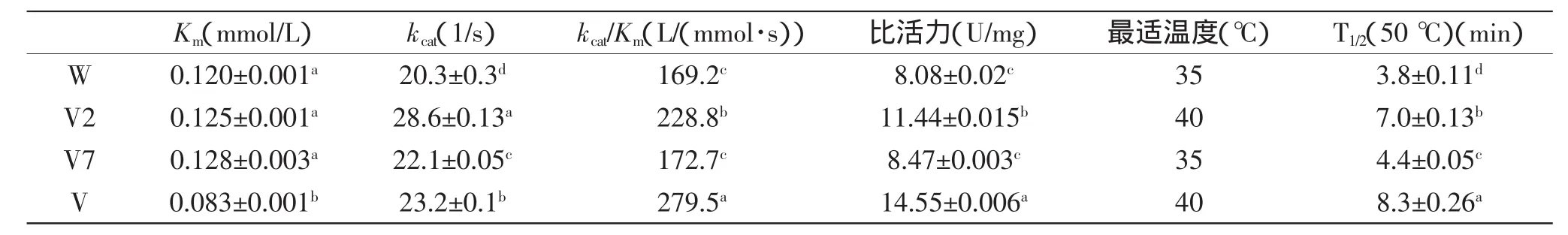
表1 野生型和突变型Ana-LOX的酶学性质Table 1 Enzymatic properties of the wild-type LOX and the mutants
2.5突变位点结构分析
通过多序列对比对Ana-LOX基因序列进行同源性分析。利用Swiss-Model,以来自Pseudomonas aeruginosa的脂肪氧合酶三维结构(PDB:4g33)[20]为模板,进行同源建模。通过观察分析Ana-LOX预测的三维结构发现,421位的缬氨酸位于某段α螺旋中(图6),而40位的缬氨酸位于酶分子表面的氮末端的Loop环中。本研究以Ana-LOX基因序列中421位点和40位点作为突变靶位点。利用定点突变将421位点和40位点的Val替换为Ala,获得突变体V421A、V40A和V421A/ V40A。再次利用Swiss-Model对突变体进行同源建模,获得突变体的模拟三维结构。
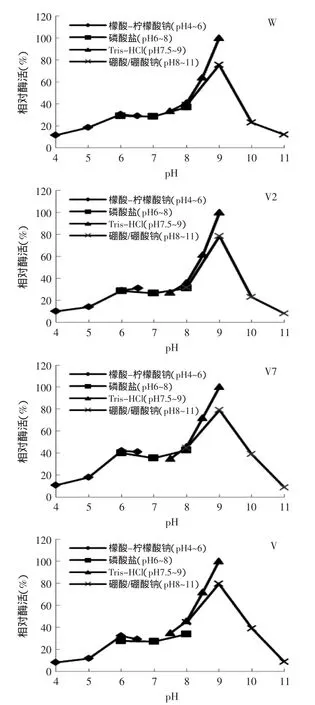
图5 野生型和突变型Ana-LOX最适pHFig.5 Optimal reaction pH of the wild-type Ana-LOX and the mutant enzymes
实验发现,氨基酸替换后的突变体在热稳定性和酶活方面均有所提高。一方面,通过稳定α螺旋来实现的。研究证实,具有较大β侧链的氨基酸(如Val,Ile,Thr)不利于α螺旋的稳定[21]。而与缬氨酸相比,丙氨酸具有较小的β侧链,并且丙氨酸比缬氨酸更具有形成α螺旋的倾向[22]。图5(A)的Ana-LOX三维结构所示,421位的缬氨酸破坏了V421所处的整个α螺旋的完整性。因此利用Ala替换掉α螺旋中β侧链较大的缬氨酸提高了Ana-LOX酶分子的稳定性。另外值得注意的是,在突变体V421A的三维结构中,在55位到70位形成了一段新的α螺旋(图6B)。由于具有较大β侧链的缬氨酸在421位处所占的空间位置较大,迫使420位的丝氨酸向外扩展,因此妨碍了55位到70位α螺旋的形成。因此突变体V421A为421位相邻的侧链形成α螺旋提供了一定的空间,同时也为Ana-LOX酶分子生成了一个新的稳定的二级结构。因为比那些松散无序的结构更能够稳定蛋白质。作为结果,突变体V421A在热稳定性和比活力方面均有所提高。
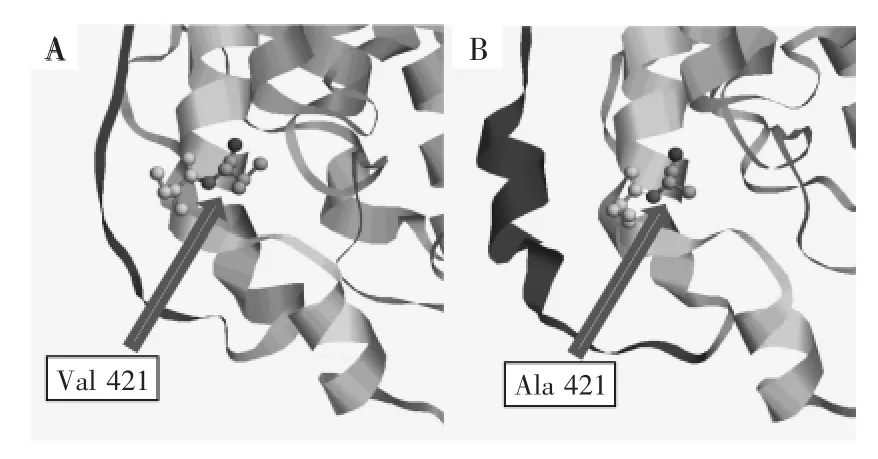
图6 Ana-LOX 421位氨基酸突变前后三维结构模拟图Fig.6 Three-dimensional homology model of Ana-LOX before(A)and after(B)substitution
另一方面,有研究报道降低蛋白表面与溶剂接触的氨基酸的疏水性,是稳定蛋白质的一个有效策略[23-24]。缬氨酸和丙氨酸都是非极性氨基酸,但是,丙氨酸是所有非极性氨基酸中疏水性最小的。因此利用定点突变将40位的缬氨酸替换为丙氨酸,降低了Ana-LOX表面氨基酸的疏水性,最终提高了Ana-LOX的热稳定性。
3 结论
分别通过以上两种策略将位点421和40上的缬氨酸突变为丙氨酸提高了Ana-LOX的热稳定性和活力。而优势组合突变体V421A/V40A将这两种策略同时结合,达到协同提高的作用。本研究通过定点突变对重组鱼腥藻脂肪氧合酶进行改造,提高了重组脂肪氧合酶的热稳定性和酶活。为脂肪氧合酶广泛的工业应用,提供更多可行性。尤其是在食品工业,同时有关Ana-LOX食品级应用是我们进一步研究的重点方向。
[1]Casey R,Hughes R K.Recombinant lipoxygenases and oxylipin metabolism in relation to food quality[J].Food Biotechnol,2004,18(2):135-170.
[2]Zhang C,Tao T T,Ying Q,et al.Extracellular production of lipoxygenase from Anabaena sp PCC 7120 in Bacillus subtilis and its effect on wheat protein[J].Appl Microbiol Biot,2012,94(4):949-958.
[3]Onysko K A.BIOLOGICAL BLEACHING OF CHEMICAL PULPS-A REVIEW[J].Biotechnology Advances,1993,11(2):179-198.
[4]Ramsay J A,Goode C.Decoloration of a carpet dye effluent using Trametes versicolor[J].Biotechnol Lett,2004,26(3):197-201.
[5]张守文,李丹.应用混合酶制剂进行面粉品质改良的基础研究[J].中国粮油学报,2002(1):16-21.
[6]Lorenzi V,Maury J,Casanova J,et al.Purification,product characterization and kinetic properties of lipoxygenase from olive fruit(Olea europaea L.)[J].Plant Physiol Biochem,2006,44(7-9):450-454.
[7]Kuo J M,Hwang A,Yeh D B,et al.Lipoxygenase from banana leaf:Purification and characterization of an enzyme that catalyzes linoleic acid oxygenation at the 9-position[J].J Agric Food Chem,2006,54(8):3151-3156.
[8]Kaneko T,Nakamura Y,Wolk C P,et al.Complete genomic sequence of the filamentous nitrogen-fixing Cyanobacterium anabaena sp strain PCC 7120[J].DNA Res,2001,8(5):205-213.
[9]Wang X M,Lu F X,Zhang C,et al.Peroxidation Radical Formation and Regiospecificity of Recombinated Anabaena sp Lipoxygenase and Its Effect on Modifying Wheat Proteins[J].J Agr Food Chem,2014,62(7):1713-1719.
[10]张充,周孝伟,吕凤霞,等.重组鱼腥藻脂肪氧合酶基因的克隆表达、分离纯化及活性分析[J].生物工程学报,2012,28(4):440-456.
[11]Zhang S,Wu G,Feng S,et al.Improved thermostability of esterase from Aspergillus fumigatus by site-directed mutagenesis[J].Enzyme Microb Tech,2014,64-65:11-16.
[12]Ghollasi M,Ghanbari-Safari M,Khajeh K.Improvement of thermal stability of a mutagenised alpha-amylase by manipulation of the calcium-binding site[J].Enzyme Microb Tech,2013,53(6-7):406-413.
[13]Wennman A,Jernerén F,Hamberg M,et al.Catalytic convergence of manganese and iron lipoxygenases by replacement of a single amino acid[J].Journal of Biological Chemistry,2012,287(38):31757-31765.
[14]Ben Mabrouk S,Aghajari N,Ben Ali M,et al.Enhancement of the thermostability of the maltogenic amylase MAUS149 by Gly312Ala and Lys436Arg substitutions[J].Bioresource Technol,2011,102(2):1740-1746.
[15]Mollania N,Khajeh K,Ranjbar B,et al.Enhancement of a bacterial laccase thermostability through directed mutagenesis of a surface loop[J].Enzyme Microb Tech,2011,49(5):446-452.
[16]Parikh M R,Matsumura I.Site-saturation mutagenesis is more efficient than DNA shuffling for the directed evolution of beta-fucosidase from beta-galactosidase[J].J Mol Biol,2005,352(3):621-628.
[17]Arnold K,Bordoli L,Kopp J,et al.The SWISS-MODEL workspace:a web-based environment for protein structure homology modelling[J].Bioinformatics,2006,22(2):195-201.
[18]侯美玲,苗华荣,陈静,等.花生种子脂肪氧化酶的活性测定研究[J].安徽农业科学,2008(32):14033-14035.
[19]Szymanowska U,Jakubczyk A,Baraniak B,et al.[20]Garreta A,Val-Moraes S P,Garcia-Fernandez Q,et al. Structure and interaction with phospholipids of a prokaryotic lipoxygenase from Pseudomonas aeruginosa[J].Faseb J,2013,27(12):4811-4821.
Characterisation of lipoxygenase from pea seeds(Pisum sativum var.Telephone L.)[J].Food Chem,2009,116(4):906-910.
[21]Piela L,Nemethy G,Scheraga H A.Proline-Induced Constraints in Alpha-Helices[J].Biopolymers,1987,26(9):1587-1600.
[22]Daopin S,Baase W A,Matthews B W.A Mutant T4 Lysozyme(Val 131-]Ala)Designed to Increase Thermostability by the Reduction of Strain within an Alpha-Helix[J].Proteins,1990,7(2):198-204.
[23]Schwehm J M,Kristyanne E S,Biggers C C,et al.Stability effects of increasing the hydrophobicity of solvent-exposed side chains in staphylococcal nuclease[J].Biochemistry,1998,37(19):6939-6948.
[24]Strub C,Alies C,Lougarre A,et al.Mutation of exposed hydrophobic amino acids to arginine to increase protein stability[J].BMC Biochemistry,2004(5):9.
Site-directed mutagenesis of lipoxygenase from Anabaena sp. PCC 7120 and enzymatic properties of the mutants
DIAO Han-wen,ZHANG Chong,LV Feng-xia,BIE Xiao-mei,LU Zhao-xin*
(College of Food Science and Technology,Nanjing Agriculture university,Nanjing 210095,China)
The thermostability and specific activity of lipoxygenase(Ana-LOX)from Anabaena sp.PCC 7120 were improved with replacing valine with alanine by site-directed mutagenesis.Compared to the wild-type enzyme which had a half-life(T1/2)of inactivation of 3.8 min at 50℃,the T1/2of mutant enzymes with V421A and V40A substitution increased to 4.4 and 7.0 min,respectively.The double mutant V421A/V40A showed a synergistic effect with a T1/2value of 8.3 min,resulting in a 1.18-fold improvement compared to the original Ana-LOX. V421A,V40A and V421A/V40A also obtained 4.83%,41.58%and 80.07%increase in specific activity,respectively. And,the mutant enzymes obtained 5℃ increase in optimum temperature than the wild-type enzyme(35℃). This study provided useful theoretical reference for enzyme molecular modification and application in vitro.
lipoxygenase;site-directed mutagenesis;enzymatic properties
TS201.3
A
1002-0306(2015)18-0160-06
10.13386/j.issn1002-0306.2015.18.024
2015-01-08
刁含文(1990-),男,硕士研究生,研究方向:食品生物技术,E-mail:2012108038@njau.edu.cn。
陆兆新(1957-),男,教授,研究方向:食品生物技术,E-mail:fmb@njau.edu.cn。
国家自然科学基金项目(31470095;31201423);国家863计划(2012AA022207);江苏省科技支撑计划(BE2011390)。

