斜纹夜蛾几丁质酶家族基因鉴定与时空表达分析
张晓娟,丁 洋,陈亚青,黄立华,郑思春
(华南师范大学生命科学学院,广州510631)
斜纹夜蛾几丁质酶家族基因鉴定与时空表达分析
张晓娟,丁洋,陈亚青,黄立华,郑思春*
(华南师范大学生命科学学院,广州510631)
昆虫GH18家族几丁质酶属于多基因家族,在昆虫的蜕皮与变态过程中发挥着至关重要的作用,它催化表皮几丁质的降解.斜纹夜蛾是一种重要的农业害虫,危害290多种植物,但对其几丁质酶未深入研究.该文通过斜纹夜蛾转录组学分析,发现了12种潜在的几丁质酶,分属于8类.对这些几丁质酶在斜纹夜蛾变态发育时在表皮、中肠以及脂肪体的时空表达分析结果表明,SlCht5,SlCht9和SlCht2的表达水平在幼虫转化为蛹时上调表达,说明这些几丁质酶可能参与了斜纹夜蛾变态时期的脱皮作用;而其他几丁质酶的表达具有组织特性,表明它们可能具有不同功能,如SlCht6仅在中肠和脂肪体中表达,SlCht11,SlCht12和SlCht16主要在中肠和表皮表达,SlIDGF2仅在表皮有表达,SlIDGF3和SlCht9在三大组织均有表达.本研究结果对斜纹夜蛾几丁质酶家族基因的鉴定和时空表达作了初步的分析,为研究它们在斜纹夜蛾发育中的功能与调控打下基础.
几丁质酶家族;时空表达;重组蛋白表达;变态发育;斜纹夜蛾
几丁质是N-乙酰氨基葡萄糖的聚合物,又名甲壳素或鞘多糖.几丁质是昆虫等节肢动物、线虫和真菌特有的一类生物多聚物,参与构成昆虫的表皮、中肠和围食膜的角质层[1].昆虫蜕皮变态发育过程中几丁质含量发生规律性变化,在蜕皮和化蛹过程中,旧的几丁质分解,新的几丁质合成.几丁质降解由几丁质酶催化.因此,针对昆虫几丁质酶开展功能与调控机制的研究,对发展有效的害虫防治的新策略具有重要的意义.目前,在基因组已完全测序的许多昆虫中,昆虫几丁质酶家族已经得到较为详细的分析.在果蝇、赤拟谷盗和冈比亚按蚊中,分别有16、22和20种几丁质酶被鉴定出来[2-3].然而,在鳞翅目昆虫中,只对家蚕开展部分研究[4].斜纹夜蛾作为鳞翅目重要农业害虫[5-6],其几丁质酶研究很少.目前在NCBI基因数据库中登记的斜纹夜蛾(Spodoptera litura)几丁质酶只有3个cDNA序列(Gen-Bank accession no.分别为AB032107.1、AY326456. 1和AY325497.1).研究发现,斜纹夜蛾几丁质酶基因SlChi(AB032107.1)在4龄到5龄幼虫的蜕皮过程中有表达[7].
在昆虫中,几丁质酶是一个大的家族,各基因的自功能可能不同.Zhu等[8]通过RNA干扰技术发现,几丁质酶与赤拟谷盗的蜕皮、化蛹、腹部发育以及翅膀的分化有关.但研究结果表明,在赤拟谷盗的16个几丁质酶同工酶中,只有TcCHI5、TcCHI7、Tc-CHI0和TcIDGF4被干扰后,幼虫显现出表征的变化;其它同工酶不直接影响幼虫的蜕皮.在斜纹夜蛾中,尚没有几丁质酶同工酶功能的研究报道.虽然大量研究表明,昆虫几丁质酶在蜕皮时期的表达是受蜕皮激素的调控,但其表达调控途径尚不清楚.
本研究通过分析斜纹夜蛾转录表达谱数据[9],发现了12种潜在的几丁质酶,对这些酶进行了序列比较以及时空表达的分析.同时,获得几丁质酶CHT5的重组蛋白,为进一步研究斜纹夜蛾几丁质酶在变态时的功能与表达奠定了基础.
1 材料与方法
1.1材料及主要试剂
供试斜纹夜蛾品系由华南师范大学昆虫分子生物学研究室饲养多年,饲养条件:温度(27±1)℃,相对湿度65%~75%,光周期12 h∶12 h(光∶暗).羽化前喂以适量培养基,羽化后用15%的蜂蜜饲养,以利于产卵.
提取RNA所用的Trizol,RNA酶抑制剂(RRI)、反转录用M-MLV及M-MLV缓冲液,PCR及克隆所需的 DNA聚合酶和 pMD 18T-simple载体,Real-Time PCR所用的SYBR®Premix Ex TaqTM(Perfect Real Time)和ROX Reference Dye(50×)等试剂均为TAKARA有限公司(大连)产品.pET-28a载体购自Novagen公司.
1.2转录组中GH18家族基因的鉴定和相关基因的克隆
从斜纹夜蛾的卵、1-6龄幼虫、蛹和成虫中提取RNA,制备成混合RNA样品,经华大基因测序,获得了斜纹夜蛾的转录组数据库,用SignalP软件(http://www.cbs.dtu.dk/services/SignalP-3.0/)在线分析斜纹夜蛾的转录组数据,注释可能的几丁质酶序列,分析其氨基酸结构及结构域,并利用DNASTAR(DNASTAR Inc.,Madison,WI)软件进行几丁质酶氨基酸序列的聚类分析.
对部分基因采用RACE方法进行克隆.反应参考 SMART RACE cDNA Amplification Kit试剂盒(Clontech)说明书,利用试剂盒cDNA 5'或3'端引物和斜纹夜蛾片段的特殊引物扩增几丁质酶cDNA. PCR反应条件:94℃ 2 min;94℃30 s,70℃30 s,72℃ 30 s,5个循环;94℃ 30 s,68℃30 s,72℃ 3 min,25个循环,72℃10 min.对所获得的DNA目的片段进行测序.
1.3RNA提取及cDNA合成
分别从斜纹夜蛾6龄第1天(6LD1)幼虫、6龄第3天(6LD3)幼虫、预蛹(PP)、蛹期第1天(P1)和蛹期第2天(P2)蛹,解剖出中肠、表皮以及脂肪体,迅速放入装有Trizol的1.5 mL的离心管中,置入液氮速冻,然后放入-80℃冰箱保存备用.按照RNA提取试剂盒(TAKARA有限公司)说明书进行RNA提取,并加入RNA酶抑制剂,用DNase I进行消化以去除基因组的影响.用反转录酶M-MLV按照试剂盒所述方法进行反应,用于反转录的RNA为3 μg,反转录体系是10 μL.
1.4GH18家族基因的半定量RT-PCR分析
以6LD1、6LD3、PP、P1、P2时期的不同组织的cDNA为模板,用各基因的特异性引物(表1)进行几丁质酶表达反转录 PCR(Reverse transcription PCR)分析.以β-actin基因作为内标.PCR反应程序为94℃3 min,94℃30 s,55℃30 s,72℃30 s,共27个循环,最后72℃延伸10 min.PCR产物用1%的琼脂糖凝胶电泳进行检测.
1.5SlCht5基因的Real-Time PCR分析
为保证碾压的刚性效果,应将初压以强振状态碾压2遍,并把初压区域的长度控制在20m以内。复压应紧跟在初压作业以后,同样以刚性碾振压2遍来保证路面碾压作业效果。终压只需刚性碾静压1遍来消除机械设备运行使用产生的轮迹。
从6龄(6L)幼虫、预蛹(PP)、蛹(P)3个时期中肠组织中提取RNA,反转录为cDNA.设计特异的引物,进行引物溶解曲线测定为单峰后,进行模板浓度的梯度稀释找到合适的反应浓度.用于对斜纹夜蛾SlCht5基因作实时定量 PCR(Real-Time PCR)分析.
1.6SlCHT5基因重组蛋白的表达
根据NCBI上的SlCht5基因序列设计特异引物,以经RT-PCR合成的cDNA为模板,扩增出大小为1 680 bp的 Slcht5 cDNA.PCR扩增反应条件94℃ 3 min;94℃30 s,55℃30 s,72℃90 s,35个循环;72℃10 min.扩增产物经1%琼脂糖凝胶电泳检测后,切胶回收,连入pMD18-Tvector后进行测序分析.把正确的目的序列经限制性内切酶EcoR I和Kpn I酶切后连入表达载体pET28a中,并转化大肠杆菌(BL21).用IPTG诱导目的蛋白的表达.蛋白表达情况用SDS-PAGE检测.

表1 本研究所用引物Table 1 Primers used in this study
2 结果与分析
2.1斜纹夜蛾几丁质酶家族cDNA序列分析
从斜纹夜蛾转录组数据中共鉴定出68个相关的几丁质酶cDNA片段,并对这些小片段的cDNA推导出的氨基酸分布进行了比较分析(图1),转录组中大部分的几丁质酶片段都集中在200个氨基酸左右.

图1 斜纹夜蛾转录组中几丁质酶多肽片段大小的分布Figure 1 Reduced polypepride distribution of chitinases identified from the transcriptome of Spodoptera litura
所获得的cDNA片段进行拼接后,对其中的SlCht2和SlCht9 cDNA用3'和5'RACE方法进行延伸克隆,分别获得了2 591 bp和1 871 bp全长的cDNA(图2).然后对所有12个可能的几丁质酶片段进行序列特征分析,发现这12个不同的基因cDNA片段具有不同的、长度为20个氨基酸左右的信号肽序列(图3),推测这些片段各代表一个完整的几丁质酶基因,也就是说斜纹夜蛾中至少有12种几丁质酶基因.SlCht8和SlCht10分别至少有3个和2个几丁质结合区,不同于其它物种的几丁质酶,在其它物种中,一个几丁质酶通常只有一个几丁质结合区.说明斜纹夜蛾几丁质酶可能有着更为复杂的多样化功能.

图2 SlCht2和SlCht9 cDNA延伸克隆示意图Figure 2 Cloning of SlCht2 and SlCht9 by cDNA extension
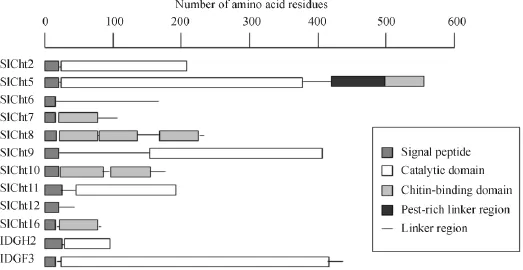
图3 斜纹夜蛾几丁质酶蛋白部分序列的结构图Figure 3 Structure map of Spodoptera litura chitinases
2.2GH18家族基因在斜纹夜蛾发育时期的表达
用RT-PCR技术分析了6LD1、6LD3、PP、P1、P2时期中,表皮、中肠和脂肪体3大组织中几丁质酶基因表达的变化(图4).SlCht2,SlCht5和SlCht9的表达水平在6龄幼虫的3种组织中表达水平均较低,但在化蛹时表达水平明显增加.SlCht6在表皮组织中不表达,仅在中肠和脂肪体中表达.SlCht7、SlCht8和SlCht9在各时期的3种组织中均有不同程度的表达.SlCht10、SlCht11、SlCht12和SlCht16主要在中肠和表皮表达,而在脂肪体中表达不明显;SlIDGF2仅在表皮有表达;SlIDGF3在3种组织中均有较高水平的表达.总体上看,这12个几丁质酶在3种组织中有不同的表达谱,除了SlCht5和SlIDGF3外,在表皮和中肠中的表达水平较在脂肪体中表达水平高;这些几丁质酶在幼虫、预蛹和蛹期均有不同程度的表达.
2.3SlCht5基因在中肠组织表达
2.4SlCHT5重组蛋白体外表达
上述研究表明,SlCht5在斜纹夜蛾变态时期高表达,猜测其在此期间发挥着重要的功能.为了研究斜纹夜蛾几丁质酶SlCHT5的功能,利用原核表达系统,将重组质粒SlCHT5-pET28a转化到大肠杆菌BL21中,经IPTG诱导后,收集菌液离心,用PBS重悬沉淀,并用超声波进行破碎,破碎后,离心分离沉淀和上清,SDS-PAGE检测蛋白是否表达及其可溶性(图6).
结果表明:重组细菌经IPTG诱导后,目的蛋白高水平表达.蛋白存在与沉淀和上清中,但在沉淀中蛋白的量更多,表明蛋白主要以包涵体形式存在.按蛋白氨基酸序列推测,SlCHT5预测相对分子量大小应为62×103,加上载体his-taq标签约4×103,重组蛋白相对分子量为66×103.重组表达的蛋白相对分子量约70×103,稍大于预测的相对分子量.

图4 斜纹夜蛾几丁质酶在不同组织和不同时期的表达分析Figure 4 Expression patterns of chitinases in different tissues of Spodoptera litura

图5 斜纹夜蛾SlCht5基因在中肠组织表达的RT-PCR定量分析Figure 5 RT-PCR analysis of expression of SlCht5 in the midgut of Spodoptera litura
3 讨论
昆虫几丁质酶家族是一个多基因家族[10],多达20多个成员.已知在果蝇有16个几丁质酶基因,赤拟谷盗有22个基因,冈比亚按蚊有20个基因[2-3].在家蚕中,只有几个几丁质酶有报道,在拟步行虫中有一个基因报道[11].在本研究中,通过转录组分析和克隆,获得了斜纹夜蛾12个几丁质酶的全长和部分片段cDNA,这是农业害虫所属的鳞翅目昆虫中至今获得最多几丁质酶的一个物种.

图6 SlCht5重组蛋白在细菌系统中的表达Figure 6 Expression of SlCht5 recombinant protein in a bacterial expression system
所有昆虫几丁质酶通常含有一个催化几丁质降解的结构域,个别的有2个或者以上的催化结构域.几丁质酶按进化关系被分成八大类,其中主要的是第一类和第二类几丁质酶[12-13].目前报道的各物种cht10有多个几丁质结合位点和催化结构域,参与昆虫早期蜕皮过程甚至以及整个的变态发育过程,作用范围最为广泛[14-16].其他类型的几丁质酶多为只含单一几丁质结合位点.本研究发现,斜纹夜蛾cht8和cht10分别含有3个和2个几丁质结合区(图2),这是否说明斜纹夜蛾这2个几丁质酶有着更强的降解几丁质能力,有待于进一步的实验证实.
斜纹夜蛾的SlCht5与其它已经报道的cht5相似,都有一个信号肽,一个几丁质结合区和一个催化结构域[13-14].SlCht5在表皮、中肠和脂肪体中均有较高水平的表达.半定量反转录PCR和定量实时PCR分析结果均表明,SlCht5在幼虫期表达水平很低,但幼虫进入预蛹期后,表达水平显著上调.这个结果与赤拟谷盗的Cht5的表达一致[17].赤拟谷盗的Cht5已被证明参与了变态发育过程.因此,作者推测Slcht5也可能在斜纹夜蛾化蛹变态时参与了几丁质的降解过程.
体外表达的玉米螟CHT5蛋白具有降解几丁质的活性[18].本研究拟获得斜纹夜蛾SlCHT5的重组蛋白,并成功地在细菌系统中表达出SlCHT5重组蛋白,但是,该蛋白主要以包涵体的形式存在,难以对其酶活性进行研究.下一步将优化诱导条件或变性及复性处理获得可溶性蛋白.
本研究结果显示,不同的几丁质酶在不同组织和发育时期有不同水平的表达(图3),说明它们可能起着不同的生理作用.赤拟谷盗cht10在幼虫蜕皮过程和化蛹变态时期都发挥功能,cht5只在变态的早期挥发作用,而cht7在赤拟谷盗变态的后期影响翅的发育[8].昆虫的几丁质主要集中在表皮和中肠围食膜.而本研究中发现,SlCht2、SlCht5-9和SlIDGF3在脂肪体中也有不同程度的表达,是否意味这些几丁质酶除降解几丁质以外,还起着其它的生理作用?另外,昆虫幼虫蜕皮和化蛹变态期需要几丁质酶降解几丁质,因此在蜕皮和化蛹时几丁质酶表达大量上升,表明这些酶在该时期起降解几丁质的作用,如 SlCht2、SlCht5和 SlCht9,其中以SlCht5变化最显著,显示了它的作用可能最大.而SlIDGF2、SlCht11、SlCht12和SlCht16在蜕皮间期(6龄幼虫第1和第3天在表皮和中肠也有高水平表达,表明这些时期的表皮和中肠也有几丁质的降解,或这些酶可能起着其它生理作用.
本研究通过对斜纹夜蛾不同组织中几丁质酶家族基因表达的分析,研究斜纹夜蛾几丁质酶与其它物种的共性与特性,为进一步深入研究斜纹夜蛾影响生长发育的关键几丁质酶的功能与调控奠定了基础.
[1]Kramer K J,Muthukrishnan S.Insect chitinases:Molecular biology and potential use as biopesticides[J].Insect Biochemistry and Molecular Biology,1997,27(11):887 -900.
[2]Zhang J,Zhang X,Arakane Y,et al.Comparative genomic analysis of chitinase and chitinase-like genes in the African Malaria Mosquito(Anopheles gambiae)[J]. PLoS ONE,2011,6(5):e19899.doi:10.1371/journal. pone.0019899.
[3]Shi L,Paskewitz S M.Identification and molecular characterization of two immune-responsive chitinase-like proteins from Anopheles gambiae[J].Insect Molecular Biology,2004,13(4):387-398.
[4]Takahashi M,Kiuchi M,Kamimura M.A new chitinaserelated gene,BmChiR1,is induced in the Bombyx mori anterior silk gland at molt and metamorphosis by ecdysteroid[J].Insect Biochemistry and Molecular Biology,2002,32(2):147-151.
[5]Huang S J,Han Z J.Mechanisms for multiple resistances in field populations of common cutworm,Spodoptera litura(Fabricius)in China[J].Pesticide Biochemistry and Physiology,2007,87:14-22.
[6]Ahmad M,Saleem M A,Sayyed A H.Efficacy of insectic idemixtures against pyrethroid and organophos phateresistant populations of Spodoptera litura(Lepidoptera: Noctuidae)[J].Pest Management Science,2009,65(3):266-274.
[7]Shinoda T,Kobayashi J,Matsui M,et al.Cloning and functional expression of a chitinase cDNA from the common cutworm,Spodoptera litura,using a recombinant baculovirus lacking the virus-encoded chitinase gene[J]. Insect Biochemistry and Molecular Biology,2001,31(6/ 7):521-532.
[8]Zhu Q S,Arakane Y,Beeman R W.Functional specialization among insect chitinase family genes revealed byRNA interference[J].PNAS,2008,105(18):6650-6655.
[9]Gu J,Huang L X,Gong Y J,et al.De novo characterization of transcriptome and gene expression dynamics in epidermis during the larval-pupal metamorphosis of common cutworm[J].Insect Biochemistry and Molecular Biology,2013,43:794-808.
[10]Zhu Q S,Arakane Y,Debarshi B.Domain organization and phylogenetic analysis of the chitinase-like family of proteins in three species of insects[J].Insect Biochemistry and Molecular Biology,2008,38(4):452-466.
[11]de la Vega H,Specht C A,Liu Y,et al.Chitinases are a multigene family in Aedes,Anopheles and Drosophila[J].Insect Molecular Biology,1998,7:233-239.
[12] Genta F A,Blanes L,Cristofoletti P T.Purification,characterization and molecular cloning of the major chitinase fromTenebrio molitor larval midgut[J].Insect Biochemistry and Molecular Biology,2006,36(10):789-800.
[13]Fitches E,Wilkinson H,Bell H.Cloning,expression and functional characterization of tomato moth(Lacanobia oleracea):A demonstration of the insecticidal activity of insect chitinase[J].Insect Biochemistry and Molecular Biology,2004,34(10):1037-1050.
[14]Bade M L,Wyatt G R.Metabolic conversions during pupation of The cecropia silkworm:1:Deposition and utilization of nutrient reserves[J].Biochemical Journal,1962,83(3):470-478.
[15]Zhu Q,Arakane Y,Banerjee D,et al.Domain organization and phylogenetic analysis of the chitinase-like family of proteins in three species of insects[J].Insect Biochemistry and Molecular Biology,2008,38(4):452-466.
[16]Arakane Y,Zhu Q S,Matsumiya M,et al.Properties of catalytic,linker and chitin-binding domains of insect chitinase[J].Insect Biochemistry and Molecular Biology,2003(33):631-648.
[17]Arakane Y,Muthukrishnan S.Insect chitinase and chitinase-like proteins[J].Cellular and Molecular Life Sciences,2010,67:201-216.
[18]Kramer K J,Corpuz L,Choi H K,et al.Sequence of a cDNA and expression of the gene encoding epidermal and gut chitinases of Manduca sexta[J].Insect Biochemistry and Molecular Biology,1993,23:691-701.
【中文责编:成文英文责编:李海航】
Identification and Expression Analysis of Chitinases in Common Cutworm,Spodoptera Litura
Zhang Xiaojuan,Ding Yang,Chen Yaqing,Huang Lihua,Zheng Sichun*
(School of Life Sciences,South China Normal University,Guangzhou 510631,China)
Insect chitinase,which belongs to the family 18 glycosylhydrolases,plays an key role during insect molting and metamorphosis.Spodoptera litura damages more than 290 species of plants,but chitinases in this species have not been clearly studied.In this study,12 putative chitinase-like proteins were identified in S.litura and classified into eight different groups.The expression patterns of these chitinase genes in the three tissues including midgut,fat body and epidermis during the metamorphosis were analyzed.The results showed that the expression levels of SlCht5,SlCht9 and SlCht2 increased during metamorphosis.SlCht6 expressed in the midgut and fat body;SlCht11,SlCht12 and SlCht16 expressed in the midgut and epidermis;SlIDGF2 expressed only in epidermis;while SlIDGF3 and SlCht9 expressed in the three tissues.The results suggest that different chitinases might play different roles during development in S.litura,SlCht5,SlCht9 and SlCht2 might be associated with metamorphosis.The results derived from this study set up a basis for further investigation of function and regulation of these genes in this insect.
chitinase family;spatial and temporal expression;expression of recombinant protein;metamorphosis;Spodoptera litura
Q786
A
1000-5463(2015)03-0100-07
2015-01-04《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
国家高技术研究发展计划(“863”计划)项目(2011AA10A204-3)
郑思春,教授,Email:sczheng@scnu.edu.cn.

