不同抑制剂脱除方法对玉米秸秆水解液发酵的影响
杨 敏, 田 磊, 张培玉*, 李小琳
(青岛大学 环境科学与工程学院,山东 青岛 266071)
化石燃料的枯竭和全球变暖正在把人们的视野转向生物燃料的研究,丁醇是产醇梭菌的代谢产物(Acetone,Butanol,Ethanol,ABE)之一,与乙醇相比,具有高燃值,与汽油混合使用,不易腐蚀管道,便于运输等优点。传统的丁醇发酵用的原料来源于粮食,既推高了丁醇价格,又造成了与人争粮的境况。农业副产物,如麦麸、秸秆、稻草等木质纤维素,以其分布广泛,简便易得的特点,成为近年来研究热点。木质纤维素类材料一般需经过预处理和纤维素酶的水解方能被产醇梭菌所利用,但众所周知,在高温、低pH的预处理过程中,一些发酵抑制剂随着产生,包括呋喃醛(糠醛和5-羟甲基糠醛(HMF))、脂族羧酸(如乙酸、甲酸和乙酰丙酸)以及酚类化合物[1]。因此,在微生物发酵之前,必须要去除发酵液中存在的抑制剂。
许多物理、化学和生物的方法被应用于木质纤维素类水解液中抑制剂的去除,可概括为以下几种[2-4]:加碱(NaOH,Ca(OH)2和NH4OH),离子交换树脂,加还原性物质(如亚硫酸钠,连二亚硫酸钠),加活性炭,酶处理(漆酶和过氧化物酶)。出于工业应用考虑,所采用的方法必须要高效廉价,且不能与发酵过程中其它步骤相冲突。国内外近年来对于抑制剂脱除的研究相当活跃,Dae Haeng Cho[5]利用过氧化氢的氧化能力,通过向水解液中投加0.01 mM的过氧化氢,即可100%的去除所有的抑制剂,丁醇的产量显著得到提高。Larsson[6]通过向产乙醇的酵母Saccharomyces cerevisiae体内导入编码漆酶的基因片段,获得突变株,漆酶的过量表达使新的菌株对酚醛具有很好的抗性。
本实验利用活性炭、Ca(OH)2、活性炭+Ca(OH)2、亚硫酸钠和连二亚硫酸钠对玉米水解液进行抑制剂的脱除,探究了不同处理方法对水解液中各组分(糖、抑制剂)及对发酵的影响,通过实验比较确定两株产醇梭菌发酵玉米秸秆水解液能力,利用耐抑制剂较好的Clostridium beijerincii 8052发酵脱除抑制剂后水解液,检测几种脱毒方法对发酵的影响。
1 实验
1.1 材料
玉米秸秆气爆预处理物主要成分为:水60%,纤维素16%,半纤维素10%,木质素及其它14%。
实验测得纤维素酶最适温度50℃,最适pH 4.8,滤纸酶活为39.60±1.52 U[7]。
拜氏梭菌(Clostridium beijerinckii NCIMB 8052),购自英国国家工业、海洋和食品菌种保藏中心。丙酮丁醇梭菌(Clostridium acetobutylicum 824),购自美国菌种保藏中心。
普通培养基(P2):葡萄糖70 g/L,酵母粉1 g/L,K2HPO40.5 g/L,KH2PO40.5 g/L,CH3COONH42.2 g/L,MgSO4·7H2O 0.2 g/L,MnSO4·H2O 0.01 g/L,FeSO4·7H2O 0.01g/L,NaCl 0.01 g/L,对氨基苯甲酸 0.001 g/L,维生素B1 0.001 g/L,生物素 0.000 1 g/L,115℃下灭菌20 min。水解液发酵培养基:将普通发酵培养基中的葡萄糖置换为秸秆水解液,总糖浓度为70 g/L左右。
1.2 秸秆预处理物的酶解方法
配制不同固液比(m/V)的气爆秸秆150 mL酶解体系,用5 M NaOH溶液调节pH至4.8,121 ℃下灭菌20 min,冷却至室温后,加入纤维素酶1.45 mL(0.05 mL/g干重),于110 r/min,50 ℃摇床中水解72~96 h,后将得到的水解液在4 000 r/min下离心分离15 min。
1.3 抑制剂脱除方法
Ca(OH)2法:用Ca(OH)2固体粉末调节水解液pH至11,于30 ℃,110 r/min摇床反应1 h。
活性炭法:向水解液中加入7.5%活性炭,于30 ℃,110 r/min摇床12 h。
Ca(OH)2+活性炭法:先用Ca(OH)2固体粉末调节水解液pH至11,后加入7.5%活性炭,于30℃,110 r/min摇床12 h。
亚硫酸钠法和连二亚硫酸钠法:向水解液中分别加入两种物质,使两种物质终浓度为10 mM,于30℃,110 r/min摇床12 h[1]。
1.4 培养方法
种子培养:15 mL厌氧管,培养基5 mL,接种孢子悬液量2%,70℃热激10 min,37℃厌氧恒温培养12~16 h。
发酵培养:250 mL厌氧瓶,装液量50 mL,接种量5%,37℃厌氧恒温培养。
1.5 细胞浓度测定
细胞浓度通过测量样品在可见光分光光度计600 nm波长条件吸光度值,同时以离心上清液做对照,吸光度值大于0.8即稀释。
1.6 水解液中抑制剂浓度的测定
取1 mL发酵液于1.5 mL EP 管中,12 000 r/min 离心5 min,得到的上清液以0.22 mm滤膜过滤进行液相色谱检测。检测方法:蒸发法光+紫外,色谱柱:Agilent SB-C 18,流动相:甲醇/水=0.2∶0.8,柱温:35℃。
1.7 可溶性木素的检测方法[8-9]
按公式(1)、(2)计算可溶性木素含量:

式中,SL为可溶性木素含量;ALIG280为水解液在280 nm下的吸光度;CF为糠醛体积浓度(g/L);CHMF为 HMF 体积浓度(g/L);eF=146.85;eHMF=114。
1.8 溶剂产量测定方法
取1 mL发酵液于1.5 mL EP 管中,12 000 r/min 离心5 min,得到的上清液转到新的1.5 mL EP 管中,用萃取剂(以乙酸乙酯为溶剂配制的5 g/L 异戊醇)萃取,上下翻转15次,取上层液体采用气相色谱法进行检测。色谱柱:InterCap WAX,柱长30 m×0.25 mm;检测器: FID;色谱条件:初始温度为35 ℃,第1次程序升温2℃/min至45℃;第2次程序升温40℃/min至150℃,维持1 min。注射器温度为280℃,载气为氮气,检测器温度为300℃,内标物为异戊醇[10]。
1.9 发酵液糖含量测定
采用DNS法测定发酵液中糖含量[11]。
2 结果与讨论
2.1 活性炭、Ca(OH)2及两种还原性物质对玉米秸秆水解液中各抑制剂的影响
一般说来,在确定抑制剂的脱除方法之前,需要先弄清水解液中主要抑制剂的成分,脱毒的方法必须简单高效,价格低廉,能够专一的去除水解液中的抑制剂。经液相色谱检测,在玉米秸秆水解液中,存在的主要抑制剂成分为糠醛、羟甲基糠醛以及一些无法检测出具体成分的可溶性木素(如图 1所示)。通过查看相关文献[12-15],发现活性炭吸附和Ca(OH)2以及一些还原性物质被广泛用于木质纤维素类水解液的抑制剂脱除。
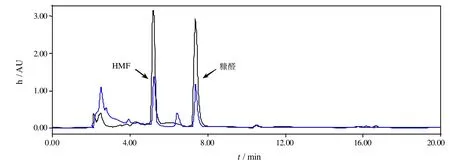
图1 抑制剂脱除前后水解液成分的检测
如表1所示,五种不同的脱毒方式被用于玉米秸秆水解液中抑制剂的脱除,结果发现在活性炭存在情况下,水解液中还原糖浓度下降明显,活性炭、活性炭+Ca(OH)2分别造成了 17.7%和 28.9%的糖损失,Ca(OH)2单独作用时只造成9.7%的糖损失。而相反的,Guo等[1]的实验发现Ca(OH)2脱毒对糖造成的损失比活性炭要大,这与Ca(OH)2、活性炭的添加量,以及后期的除去这两种物质的方式有关。在抑制剂的去除方面,有活性炭参与的脱毒效果最明显,活性炭+Ca(OH)2两者共同作用起到了很好的协同作用,抑制剂的去除率最高,糠醛(98.95%),HMF(99.6%),SL(77%),这比以前的一些结果略高[16];活性炭单独吸附次之,糠醛(97.1%),HMF(96.4%),SL(72.5%);Ca(OH)2脱除效率最后,糠醛(35.3%),HMF(26.9%),其中可溶性木素的含量没降低反而增加。可溶性木素是一类苯环数不定的有机化合物的总称,在酸解气爆的过程中,从木质素上脱落,Ca(OH)2的加入导致其含量的增加,是由于碱的加入使得木质素结构变得松散不稳定,原本的一些木素脱落溶解于水解液。与气爆秸秆水洗液相比,在酶解的过程中会有部分的糠醛和羟甲基糠醛产生,可溶性木素的量基本保持不变,Palmqvist和Hagerdal[16]的研究结果解释了这一现象,他们认为在一定温度和压力下,水解液中产生的葡萄糖和木糖会被分别降解为糠醛和羟甲基糠醛。亚硫酸钠和连二亚硫酸钠对水解液中还原糖以及抑制剂浓度均无太大影响,这与 Alriksson等[17]人的研究结果一致。

表1 添加物对水解液中各组分的影响
2.2 两种产溶剂梭菌发酵水解液的比较
工业上用于生物丁醇生产的菌株主要有两种,即拜氏梭菌和丙酮丁醇梭菌。对于以木质纤维素水解液为底物的厌氧发酵,文献中使用较多的为拜氏梭菌,但不同菌对于不同水解液、不同抑制剂的耐受度不一样,比如Alriksson和Cavka[18]就发现,在云杉水解液中,产乙醇酵母S. cerevisiae比产细菌纤维素菌G. xylinus更能耐受抑制剂。因此,通过实验希望选出一种比较合适用于玉米秸秆水解液发酵的菌株,从而来检验不同抑制剂脱除方法的效果。以酶解后未脱毒的水解液为底物,Clostridium beijerincii 8052和 Clostridium acetobutylicum 824分别发酵,发现两株菌的生长均受到抑制,其中Clostridium acetobutylicum 824细胞生长量很少,溶剂产量基本没有,生长完全被抑制。Clostridium beijerincii 8052细胞生长量明显较多,最高OD600nm达到2.3左右,溶剂产量分别为丁醇0.15 g/L、丙酮0.34 g/L、乙醇0.112 g/L。由此可见,在玉米秸秆水解液中,拜氏梭菌具有更高的抑制剂耐受浓度,更高的环境适应性,比较合适用于后续的实验。
2.3 Clostridium beijerincii 8052发酵不同抑制剂脱除方法的水解液比较
将脱毒后水解液pH调到6~6.5左右,补加各类营养元素,向每瓶培养基中接种5%种子液,置于37℃培养箱培养。
图2为不同抑制剂脱除方法对发酵过程的影响。由图2可知,从细胞量上看,活性炭单独处理最高,Ca(OH)2处理次之,活性炭+Ca(OH)2共处理最低。从溶剂(ABE)总产量上看,经 Ca(OH)2和活性炭单独处理的水解液中,ABE浓度接近,约为14.4 g/L,经Ca(OH)2和活性炭联合处理的水解液中,溶剂浓度为12.32 g/L,低14.5%。而抑制剂脱除率为:活性炭+Ca(OH)2>活性炭>Ca(OH)2,这其中产生了一些矛盾。活性炭和Ca(OH)2共处理产生的并不是简单的叠加效应,二者相互影响。Fox等[19]研究发现,在高pH条件下,活性炭对于水解液中一些未知组分,如酚类化合物,吸附能力与pH较低时相比明显降低,这些未知化合物对微生物生长的毒害更大。在实验中,活性炭和Ca(OH)2共处理是先通过Ca(OH)2固体先调节水解液pH至11,后加入活性炭,这就解释了共处理条件下溶剂产量不高。
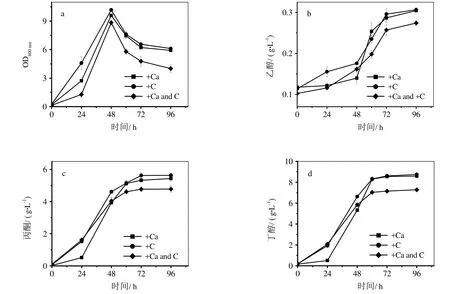
图2 不同抑制剂脱除方法对发酵过程的影响
从丁醇、丙酮和乙醇的产量变化上来看,Clostridium beijerincii 8052发酵Ca(OH)2处理过的水解液需要经过24 h的适应期,因为其水解液中还存在较高的抑制剂浓度。适应期后,溶剂产率迅速增加,这一点从24 h到60 h期间的丁醇产率就可看出。活性炭+Ca(OH)2、活性炭、Ca(OH)2丁醇产率分别为0.137g/L·h、0.177 g/L·h、0.216 g/L·h。48 h后,Ca(OH)2处理过的水解液中溶剂浓度超过活性炭+Ca(OH)2共处理,50 h左右,产量即和活性炭处理的水解液相当。
3 总结
本文利用活性炭、Ca(OH)2、活性炭+Ca(OH)2、亚硫酸钠和连二亚硫酸钠对玉米水解液进行抑制剂的脱除,探究了不同处理方法对水解液中各组分(糖、抑制剂)及对发酵的影响,取得以下结果:
1)对水解液中糠醛、HMF、可溶性木素三种主要抑制剂,抑制剂脱除率由高到底依次为:活性炭+Ca(OH)2>活性炭>Ca(OH)2>亚硫酸钠和连二亚硫酸钠,其中两种还原性物质亚硫酸钠和连二亚硫酸钠基本不起作用,这与对水解中还原糖造成的损失相一致。
2)抑制剂未脱除的玉米秸秆水解液,分别用 Clostridium beijerincii 8052和Clostridium acetobutylicum 824发酵,发现Clostridium acetobutylicum 824生长完全受到抑制,而Clostridium beijerincii 8052则表现出一定的生长和产溶剂能力。
3)上述脱除方法对Clostridium beijerincii 8052发酵水解液的影响,由好到差依次为:Ca(OH)2>活性炭>活性炭+Ca(OH)2>亚硫酸钠和连二亚硫酸钠,活性炭+Ca(OH)2的组合虽能最大程度去除抑制剂,但同时也对微生物发酵造成一定负面影响。
[1] Guo X, Cavka A, Jönsson L J, et al. Comparison of methods for detoxification of spruce hydrolysate for bacterial cellulose production[J]. Microbial Cell Factories, 2013, 12: 93.
[2] Sainio T, Turku I, Heinonen J. Adsorptive removal of fermentation inhibitors from concentrated acid hydrolyzates of lignocellulosic biomass[J]. Bioresource Technology, 2011, 102(10): 6048-6057.
[3] Mussatto S I, Roberto I C. Alternatives for detoxification of diluted-acid lignocellulosic hydrolyzates for use in fermentative processes: a review[J]. Bioresource Technology, 2004, 93(1): 1-10.
[4] Ezeji T, Qureshi N, Blaschek H P. Impact of degradation products on Clostridium beijerinckii growth and butanol fermentation[J]. Biotechnology and Bioengineering, 2007, 97(6): 6-14.
[5] Cho D H, Lee Y J, Um Y, et al. Detoxification of model phenolic compounds in lignocellulosic hydrolysates with peroxidase for butanol production from Clostridium beijerinckii[J]. Biotechnological Products and Process Engineering, 2009,83(6): 1035-1043.
[6] Larsson S, Cassland P, Jonsson L J. Development of a saccharomyces cerevisiae strain with enhanced resistance to phenolic fermentation inhibitors in lignocellulose hydrolysates by heterologous expression of laccase[J]. Applied and Environmental Microbiology, 2001, 67(3): 1163-1170.
[7] Zhang K D, Chen X H, Schwarz W H, et al. Synergism of glycoside hydrolase secretomes from two thermophilic bacteria cocultivated on lignocellulose[J]. Appl Environ Microbiol, 2014, 80(8): 2592-2601.
[8] Eduardo K, Paulo M, Alexandra C. Analysis of soluble lignin in sugarcane by ultrahigh performance liquid chromatography—tandem mass spectrometry with a Do-It-yourself oligomer database[J]. Anal Chem, 2012, 84(16): 7015-7020.
[9] Kaar W E, Brink D L. Simplified analysis of acid soluble lignin[J]. Journal of Wood Chemistry and Technology, 1991, 11(4):465-477.
[10] Guo T, Tang Y, Zhang Q Y, et al. Clostridium beijerinckii mutant with high inhibitor tolerance obtained by low-energy ion implantation[J]. J Ind Microbiol Biotechnol, 2012, 39(3): 401-407.
[11] Qureshi N, Saha B C, Hector R E, et al. Production of butanol (a biofuel) from agricultural residues: Part Ⅱ- Use of corn stover and switchgrass hydrolysates[J]. Biomass Bioenergy, 2010, 34(4): 566-571.
[12] Jönsson L J, Alriksson B, Nilvebrant N O. Bioconversion of lignocellulose:inhibitors and detoxification[J]. Biotechnol Biofuels,2013, 6: 10-16.
[13] Carvalheiro F, Duarte L C, Lopes S, et al. Evaluation of the detoxification of brewery’s spent grain hydrolysate for xylitol production by Debaryomyces hansenii CCMI 941[J]. Process Biochem, 2005, 40(3-4): 1215-1223.
[14] Larsson S, Reimann A, Nilvebrant N O, et al. Comparison of different methods for the detoxification of lignocellulose hydrolyzates of spruce[J]. Appl Biochem Biotechnol, 1999, 77(1-3): 91-103.
[15] Chandel A K, Kapoor R K, Singh A, et al. Detoxification of sugarcane bagasse hydrolysate improves ethanol production by Candida shehatae NCIM 3501[J]. Bioresour Technol, 2007, 98(10): 1947-1950.
[16] Palmqvist E, Hagerdal H B. Fermentation of lignocellulosic hydrolysates. Ⅱ. Inhibitors and mechanisms of inhibition[J].Bioresour Technol, 2000, 74(1): 25-33.
[17] Alriksson B, Cavka A, Jönsson L J. Improving the fermentability of enzymatic hydrolysates of lignocellulose through chemical in-situ detoxification with reducing agents[J]. Bioresour Technol, 2011, 102(2): 1254-1263.
[18] Fox C R, Kennedy D C. Conceptual design of adsorption systems.In:Slejko,F.L.(Ed.), Adsorption Technology: A Step-by-Step Approach to Process Evaluation and Application[M]. New York, 1985, 3: 91-166.

