氯胺酮复合异丙酚麻醉对抑郁大鼠电休克后海马谷氨酸受体亚基1和亚基2的影响☆
秦珮珮 闵苏 张帆 任力 郝学超 朱贤林
氯胺酮复合异丙酚麻醉对抑郁大鼠电休克后海马谷氨酸受体亚基1和亚基2的影响☆
秦珮珮*闵苏*张帆*任力*郝学超*朱贤林*
目的 评价小剂量氯胺酮复合异丙酚麻醉对抑郁大鼠电休克(electroconvulsive therapy,ECT)后海马谷氨酸受体亚基1(glutamate receptor subunit 1,GluR1)及亚基2(glutamate receptor subunit 2,GluR2)的影响。方法 健康成年雄性SD大鼠32只,采用孤养与慢性轻度不可预见性应激(chronic unpredictable mild stress,CUMS)建立抑郁模型,建模成功后随机分为抑郁组(A组)、ECT组(B组)、ECT+异丙酚组(C组)和ECT+异丙酚+氯胺酮组(D组)4组,每组8只;另取8只正常大鼠作为对照组。对照组不做任何处理;A组腹腔注射生理盐水8 mL/kg后给予伪ECT处理;B、C、D组分别腹腔注射生理盐水8 mL/kg、异丙酚80 mg/kg、异丙酚80 mg/kg+氯胺酮10 mg/kg后行ECT处理,上述处理连续7 d。分别采用糖水偏好实验和Morris水迷宫实验评价大鼠抑郁状态和学习记忆功能,Western-blot及RT-PCR检测大鼠海马GluR1和GluR2及其mRNA表达。结果 ECT处理后,B、C、D组糖水偏好百分比变化均较A组和对照组明显,其中D组升高最为明显(均P<0.05);B组逃避潜伏期延长且变化值与其他组均具有统计学差异,而D组逃避潜伏期缩短最为明显,其次为A组(均P<0.05);B组空间探索时间缩短且变化值均大于其他组,D组空间探索时间延长最为明显(均P<0.05)。ECT处理后,B、C、D组GluR1表达较A组高,其中D组最高(均P<0.05);GluR1mRNA表达在组间无统计学差异B、C组GluR2及其mRNA表达较其余组低,其中B组最低(均P<0.05),A、D组和对照组间GluR2及其mRNA差异无统计学意义(P>0.05)。结论 小剂量氯胺酮复合异丙酚麻醉在协同ECT抗抑郁效果的同时,能够更大程度地改善ECT后学习记忆功能,其机制可能与上调海马GluR1和GluR2表达相关。
抑郁 电休克 异丙酚 氯胺酮 谷氨酸受体
电休克治疗(electroconvulsive therapy,ECT)能够快速有效地治疗重度抑郁症,但对学习记忆有损害[1]。异丙酚麻醉下ECT,即改良电休克治疗(modified electroconvulsive therapy,MECT),虽可减轻学习记忆损害,但有可能干扰ECT的抗抑郁疗效。而小剂量氯胺酮联合MECT具有协同抗抑郁效果,并能进一步改善MECT后学习记忆功能[2-3]。研究发现,谷氨酸受体(glutamate receptor,GluR)是ECT、异丙酚和氯胺酮的共同潜在作用靶点[4-6]。其中谷氨酸受体亚基1(glutamate receptor subunit 1,GluR1)表达或转运异常会损害突触可塑性[7-8];而GluR2表达异常与认知功能障碍密切相关[9]。本研究拟观察小剂量氯胺酮复合异丙酚麻醉对抑郁大鼠ECT后的抗抑郁效果和对学习记忆的影响,以及海马GluR1和GluR2表达的变化,以进一步探讨此种复合麻醉改善抑郁大鼠ECT后抗抑郁效果和认知功能的分子机制。
1 材料与方法
1.1动物与建模40只清洁级健康成年雄性Sprague-Dawley(SD)大鼠,体重200~250 g,2~3月龄,由重庆医科大学实验动物中心提供。实验前适应性饲养7 d。随机选取32只大鼠采用孤养与慢性轻度不可预见性应激(chronic unpredictable mild stress,CUMS)建立抑郁模型。大鼠单笼饲养,每天随机给予1种刺激:明暗颠倒24 h,4℃冰水游泳5 min,45℃热水游泳5 min,禁饮24 h,禁食24 h,夹尾1 min,1次/s水平摇晃鼠笼10 min,潮湿垫料24 h,45°鼠笼倾斜24 h。2 d不连续使用同种刺激,连续28 d。
1.2分组与处理 建模成功后32只大鼠随机分为抑郁组(A组)、ECT组(B组)、ECT+异丙酚组(C组)、ECT+异丙酚+氯胺酮组(D组),每组8只;剩余8只正常大鼠作为对照组。对照组不做任何处理;A组腹腔注射生理盐水8 mL/kg,给予伪ECT处理,即两耳夹电极但不予通电;B、C、D组分别腹腔注射生理盐水8 mL/kg、异丙酚80 mg/kg(批号:GV461,AstraZeneca公司,意大利)、异丙酚80 mg/kg+氯胺酮10 mg/kg(批号:H32022820,江苏恒瑞医药股份有限公司)后,B组直接行ECT,C组和D组待大鼠翻正反射消失后行ECT(Niviqure-SA型电休克治疗仪,Niviqure公司,印度),电量为120 mC,以引发大鼠强直—阵挛抽搐作为ECT诱发成功标准。上述处理1次/d,连续7 d。ECT处理期间,C组和D组大鼠吸入50%O2,维持其正常呼吸功能。
1.3行为学检测 分别于建模前、后和ECT后第1天行糖水偏好实验检测大鼠抑郁状态。首先进行糖水适应,每只鼠笼放置2瓶1%蔗糖溶液24 h后,将其中1瓶糖水换为纯水适应24 h。禁食、禁饮23 h后,同时放置1瓶糖水和1瓶纯水,30 min后将2瓶水位置对调,继续实验30 min。分别测量每只大鼠糖水和纯水的消耗量,计算糖水偏好百分比(sucrose preference percentage,SPP):SPP=糖水消耗量/(糖水消耗量+纯水消耗量)×100%。
分别于建模后、ECT后第4天行Morris水迷宫实验评价大鼠学习记忆功能。水迷宫实验第1~5天行定位巡航实验,评估大鼠学习功能。平台置于Ⅰ象限中央位置,按Ⅰ~Ⅳ象限的顺序将大鼠投入水中,记录其自入水到上平台的时间,计为逃避潜伏期。若大鼠60 s内未上平台,将其引上平台,并计逃避潜伏期为60 s。大鼠每日训练4次,取第3~5天平均时间作为学习成绩。第6天行空间探索实验,评估大鼠记忆功能。实验方法为:撤去平台,将大鼠自原平台所在象限的对侧象限投入水中,记录60 s内大鼠在原平台象限的游泳时间,计为空间探索时间。
1.4海马区GluR1和GluR2及其mRNA表达检测采用Western-blot法检测海马GluR1和GluR2水平。每组随机选取4只大鼠,冰浴上分离海马组织后提取蛋白。使用BCA法检测蛋白浓度。每组取等量蛋白电泳分离,转印至PVDF膜上,封闭2 h后孵育兔抗GluR1抗体(1:500)、小鼠抗GluR2抗体(1:500)及小鼠抗GAPDH(1:500)4℃过夜。洗膜后分别滴加辣根过氧化物酶标记的山羊抗兔及山羊抗小鼠IgG二抗(1:1000),37℃孵育2 h。采用ECL化学发光法检测蛋白条带信号,通过Quantity One软件进行图像分析,目的蛋白与内参蛋白GAPDH的比值代表目的蛋白相对含量。
采用逆转录PCR(reverse transcription PCR,RT-PCR)法检测海马GluR1和GluR2的mRNA水平。每组剩余4只大鼠冰上分离海马称重。使用Trizol试剂盒提取RNA,逆转录试剂盒进行逆转录。根据基因库GluR1、GluR2及GAPDH的编码序列,设计GluR1的上游引物为5′-TCCCTTGACCATAACC TTGG-3′,下游引物为5′-GCTTGGACTTCTGTGGC TTC-3′(扩增产物104 bp);GluR2的上游引物为5′-AGTGAAGGAGGGCATCTCTG-3′,下游引物为5′-GCACAAGGAAGGCTGAAGTA-3′(扩增产物201 bp);GAPDH的上游引物为5′-GAAGGTCGGAG TCAACGGA-3′,下游引物为5′-TGAGTCCTTCCAC GATACCAA-3′(扩增产物512 bp)。将逆转录产物进行扩增,扩增条件:94℃预变性2 min,94℃变性30 s,55℃退火30 s,47℃延伸30 s,31个循环后72℃补充延伸3 min。取等量扩增产物电泳,使用凝胶发光图像分析系统显影,目的mRNA与内参GAPDH mRNA比值即为目的mRNA相对表达水平。
1.5统计学方法 采用SPSS 17.0进行统计分析。各组大鼠SPP、逃避潜伏期、空间探索时间及其相应变化值、GluR1和GluR2及其mRNA采用单因素方差分析进行比较,两两组间比较采用Bonferroni法。检验水准α为0.05,双侧检验。
2 结果
2.1行为学指标 各组大鼠建模前SPP无统计学差异(F=0.39,P=0.82)。各组建模后SPP(F=260.80,P<0.01)、建模前后SPP变化值(F=160.28,P<0.01)、建模后逃避潜伏期(F=43.97,P<0.01)及空间探索时间(F=38.77,P<0.01)均有统计学差异。其中,与对照组相比,A、B、C、D组SPP降低且变化值均较对照组大,逃避潜伏期延长,空间探索时间缩短(均P<0.05),但A、B、C、D组间无统计学差异(P>0.05)。见表1与图1。
ECT处理前后各组SPP变化值有统计学差异(F=65.55,P<0.01),与对照组和A组相比,B、C、D组变化值均较大(P<0.05),并且D组大于B组和C组(P<0.05)。处理前后各组逃避潜伏期变化值的差异有统计学意义(F=59.52,P<0.01),其中仅B组逃避潜伏期延长且变化值与其他组均具有统计学差异(P<0.05),对照组与A组变化值无统计学差异(P>0.05),C组变化值较A组小(P<0.05),而D组变化值较其他组均较大(P<0.05)。处理前后各组大鼠空间探索时间的变化值有统计学差异(F=92.99,P<0.01),其中B组空间探索时间缩短且变化值均大于其他4组(P<0.05),C组变化值较小且与对照组无统计学差异(P>0.05),而与其他组均有差异(P<0.05),D组空间探索时间延长最为明显且变化值与其他4组均具有统计学差异(均P<0.05)。见表1与图1。
表1 5组大鼠不同时间点糖水偏好比和学习记忆指标(±s)

表1 5组大鼠不同时间点糖水偏好比和学习记忆指标(±s)
1)与对照组比较,经Bonferroni检验,P<0.05;2)与A组比较,经Bonferroni检验,P<0.05;3)与B组比较,经Bonferroni检验,P<0.05;4)与C组比较,经Bonferroni检验,P<0.05
组别对照组A组B组C组D组n 8 8 8 8 8 SPP建模前89.9%±3.1% 91.4%±4.2% 89.6%±2.6% 90.2%±3.2% 90.7%±2.8%建模后89.6%±2.1% 56.3%±4.0%1)55.2%±2.6%1)56.0%±1.8%1)55.7%±2.2%1)建模前后变化值-0.2%±4.3% -35.1%±2.7%1)-34.4%±2.0%1)-34.2%±3.7%1)-34.9%±3.9%1)处理后90.8%±1.5% 55.7%±4.0%1)66.2%±1.9%1)2)66.0%±1.8%1)2)80.0%±1.5%1)2)3)4)处理前后变化值1.1%±2.5% -0.6%±5.5% 11.0%±3.0%1)2)10.0%±1.6%1)2)23.8%±3.1%1)2)3)4)组别对照组A组B组C组D组逃避潜伏期(s)建模后15.7±1.3 23.9±1.81)22.8±1.61)24.2±1.31)23.0±1.41)处理后11.2±1.4 17.1±1.01)25.3±1.31)2)20.8±1.51)2)3)13.7±1.61)2)3)4)处理前后变化值-4.5±1.4 -6.8±1.8 2.5±1.81)2)-3.4±1.62)3)-9.2±1.31)2)3)4)空间探索时间(s)建模后30.5±1.4 23.0±1.81)24.0±1.31)22.9±1.31)23.0±1.51)处理后32.2±1.0 25.8±1.11)15.7±1.01)2)22.2±1.51)2)3)30.0±1.01)2)3)4)处理前后变化值1.8±1.9 2.8±2.0 -8.4±1.21)2)-0.7±1.52)3)7.0±1.71)2)3)4)
2.2GluR1、GluR2及其mRNA表达情况 各组大鼠海马GluR1表达有统计学差异(F=382.94,P<0.01),与对照组相比,A、B、C、D组GluR1表达水平较低(P<0.05),与A组相比,B、C及D组GluR1较高(P<0.05),其中D组最高(P<0.05),而B组与C组无统计学差异(P>0.05)。各组GluR1的mRNA表达水平无统计学差异(F=0.26,P=0.90)。各组GluR2(F=889.90,P<0.01)及其mRNA表达水平(F= 54.56,P<0.05)有统计学差异,与对照组和A组相比,B、C组GluR2及其mRNA较低(P<0.05),其中B组最低(P<0.05),D组较B、C组表达高(P<0.05),A、D组和对照组GluR2及其mRNA表达两两间无统计学差异(P>0.05)。见表2及图2~4。
表2 5组大鼠海马GluR1、GluR2及其mRNA表达水平(±s)

表2 5组大鼠海马GluR1、GluR2及其mRNA表达水平(±s)
1)与对照组比较,经Bonferroni检验,P<0.05;2)与A组比较,经Bonferroni检验,P<0.05;3)与B组比较,经Bonferroni检验,P<0.05;4)与C组比较,经Bonferroni检验,P<0.05
组别对照组A组B组C组D组n4 4 4 4 4 GluR10.91±0.01 0.49±0.011)0.82±0.021)2)0.81±0.011)2)0.88±0.021)2)3)4)GluR1mRNA 0.94±0.30 0.77±0.32 0.96±0.19 0.89±0.22 0.94±0.28 GluR20.074±0.002 0.073±0.002 0.022±0.0011)2)0.037±0.0021)2)3)0.073±0.0023)4)GluR2mRNA 0.37±0.31 0.37±0.28 0.14±0.091)2)0.22±0.021)2)3)0.38±0.033)4)
3 讨论
目前普遍采用CUMS建模研究抑郁症发病机制等。抑郁症的核心症状为“快感缺失”,本研究采用糖水偏好实验评价大鼠抑郁样行为[10],CUMS建模后大鼠较对照组SPP明显下降,说明建模成功。临床ECT治疗抑郁症周期一般为7 d,因而本研究将ECT处理周期设置为7 d。本课题组前期研究发现,异丙酚麻醉下ECT电量为120 mC与180 mC时,大鼠抑郁样行为改善较明显[11],考虑到ECT电量越大,对大鼠学习记忆损害可能越重,因而本研究选择120 mC的电量。根据药物剂量换算原理,大鼠腹腔注射氯胺酮10 mg/kg相当于人类静脉注射0.5 mg/kg,该剂量氯胺酮能够发挥良好的抗抑郁效果,同时无明显精神副作用[12-13],故本研究选用10 mg/kg氯胺酮与异丙酚复合麻醉。

图1 5组大鼠不同时间点SPP和学习记忆指标柱形图 1)与同时间点对照组比较,经Bonferroni检验,P<0.05;2)与同时间点A组比较,经Bonferroni检验,P<0.05;3)与同时间点B组比较,经Bonferroni检验,P<0.05;4)与同时间点C组比较,经Bonferroni检验,P<0.05
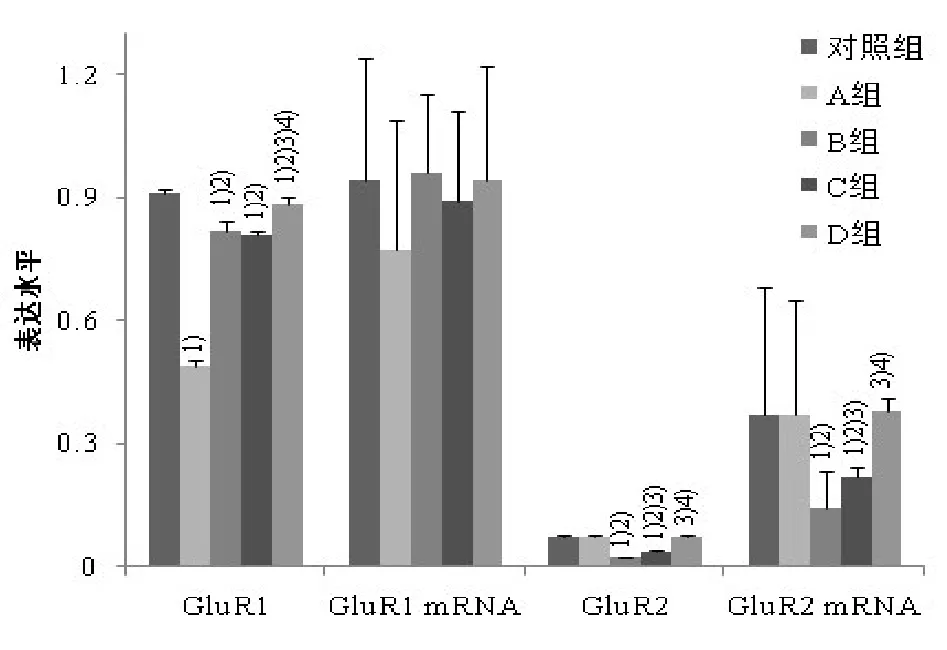
图2 5组大鼠海马GluR1、GluR2及其mRNA表达水平柱形图 1)与对照组比较,经Bonferroni检验,P<0.05;2)与A组比较,经Bonferroni检验,P<0.05;3)与B组比较,经Bonferroni检验,P<0.05;4)与C组比较,经Bonferroni检验,P<0.05

图3 抑郁大鼠海马区GluR1及GluR2表达(Western-blot法)

图4 抑郁大鼠海马区GluR1及GluR2的mRNA表达(RT-PCR法)
本研究发现,ECT具有抗抑郁作用,但会损害学习记忆;MECT保护学习记忆功能,对ECT抗抑郁效果未见明显影响;而小剂量氯胺酮复合MECT在增强ECT抗抑郁作用的同时,能进一步改善抑郁大鼠学习记忆功能。不同的麻醉用药对ECT后大鼠抑郁样行为和学习记忆的影响存在差异。
α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionic acid receptor,AMPAR)由GluR1~4两两构成异四聚体[14]。成年海马神经元中GluR1和GluR2组成体介导80%的AMPAR突触传递功能[15],AMPAR参与神经精神疾病的病理生理过程。其中GluR1表达或调控异常可能是抑郁症发病机制之一[16]。国外相关研究与本研究结果均显示ECT可能通过调节GluR1发挥抗抑郁作用[17]。氯胺酮抗抑郁的机制与其调节m-TOR信号通路及上下游蛋白进而增加GluR1表达有关[18-19],与本研究结果部分相似。故推测氯胺酮增强MECT抗抑郁效果可能与氯胺酮协同增加GluR1表达有关。本研究发现处理后各组大鼠海马GluR1的mRNA表达无明显差异,提示GluR1的表达变化可能主要发生在转录后翻译的过程中。
Greger等[20]发现AMPAR对Ca2+的通透性取决于GluR2的含量,然而癫痫患者海马GluR2mRNA的表达下降,Ca2+内流增加引起钙超载,诱发兴奋性毒性损害,介导认知功能障碍[9]。因而ECT损害学习记忆可能与其减少GluR2的表达,介导兴奋性毒性损害有关。相似的是,Nordgren等[21]亦发现单次ECT后12 h时大鼠GluR2表达下降。本研究发现复合异丙酚与氯胺酮后能够不同程度增加GluR2的表达,减轻学习记忆的损害。本研究亦发现抑郁大鼠学习记忆功能受损,但海马内GluR2未见明显降低,故推测抑郁症与ECT损害学习记忆的机制可能不同。
本研究主要不足之处在于未单独设计氯胺酮与异丙酚组,无法明确单纯麻醉药物对抑郁大鼠行为学和上述受体的影响;其次本研究仅从现象上观察到小剂量氯胺酮复合MECT增强ECT抗抑郁作用和保护学习记忆的机制可能与GluR1和GluR2有关,但具体的信号通路尚不明确,深入研究GluR在ECT疗效和副作用中的作用,能够为临床采取针对性的干预措施提供参考。
综上所述,ECT、MECT及小剂量氯胺酮复合MECT均能上调GluR1的表达,同时后两者能够上调GluR2的表达,而前者下调GluR2的表达。说明小剂量氯胺酮复合异丙酚麻醉在协同ECT抗抑郁效果的同时,能够更大程度地改善ECT后学习记忆功能,其机制可能与上调海马GluR1和GluR2表达相关。
[1]Pigot M,Andrade C,Loo C.Pharmacological attenuation of electroconvulsive therapy-induced cognitive deficits:theoretical background and clinical findings[J].J ECT,2008,24(1):57-67.
[2]Zhu X,Hao C,Luo J,et al.Propofol inhibits inflammatory cytokine-mediated glutamate uptake dysfunction to alleviate learning/memory impairment in depressed rats undergoing electroconvulsive shock[J].Brain Res,2015,1595:101-109.
[3]陈婧,闵苏,罗洁,等.小剂量氯胺酮复合异丙酚麻醉对抑郁大鼠电休克后海马谷氨酸受体1和γ-氨基丁酸A受体表达的影响[J].中华麻醉学杂志,2013,33(12):1434-1438.
[4]Nordgren M,Karlsson T,Svensson M,et al.Orchestrated regulation of Nogo receptors,LOTUS,AMPA receptors and BDNF in an ECT model suggests opening and closure of a window of synaptic plasticity[J].PLoS One,2013,8(11):e78778.
[5]Mao LM,Hastings JM,Fibuch EE,et al.Propofol selectively alters GluA1 AMPA receptor phosphorylation in the hippocampus but not prefrontal cortex in young and aged mice[J].Eur J Pharmacol,2014,738:237-244.
[6]Koike H,Chaki S.Requirement of AMPA receptor stimulation for the sustained antidepressant activity of ketamine and LY341495 during the forced swim test in rats[J].Behav Brain Res,2014,1(271):111-115.
[7]Dachtler J,Hardingham NR,Glazewski S,et al.Experience-dependent plasticity acts via GluR1 and a novel neuronal nitric oxide synthase-dependent synaptic mechanism in adult cortex[J]. J Neurosci,2011,31(31):11220-11230.
[8]Lee HK,Takamiya K,Han JS,et al.Phosphorylation of the AMPA receptor GluR1 subunit is required for synaptic plasticity and retention of spatial memory[J].Cell,2003,112(5):631-643.
[9]Wright A,Vissel B.The essential role of AMPA receptor GluR2 subunit RNA editing in the normal and diseased brain[J].Front Mol Neurosci,2012,5:34.
[10]Luo KR,Hong CJ,Liou YJ,et al.Different regulation of neurotrophin S100B and BDNF in two rat models of depression[J]. ProgNeuropsrchopharmaeolBiolPsychiatry,2010,34(8): 1433-1439.
[11]Luo J,Min S,Wei K,et al.Propofol interacts with stimulus intensities of electroconvulsive shock to regulate behavior and hippocampal BDNF in a rat model of depression[J].Psychiatry Res,2012,198(2):300-306.
[12]Zarate CA Jr,Singh JB,Carlson PJ,et al.A randomized trial of an N-methyl-D-aspartate antagonist in treatment-resistant major depression[J].Arch Gen Psychiatry,2006,63(8):856-864.
[13]Berman RM,Cappiello A,Anand A,et al.Antidepressanteffects of ketamine in depressedpatients[J].Biol Psychiatry,2000,47(4):351-354.
[14]Meador-Woodruff JH,Hogg AJ Jr,Smith RE.Striatal ionotropic glutamate receptor expression in schizophrenia,bipolar disorder,and major depressive disorder[J].Brain Res Bull,2001,55(5):631-640.
[15]Henley JM,Barker EA,Glebov OO.Routes,destinations and delays:recent advances in AMPA receptor trafficking[J].Trends Neurosci,2011,34(5):258-268.
[16]Duric V,Banasr M,Stockmeier CA,et al.Altered expression of synapse and glutamate related genes in post-mortem hippocampus of depressed subjects[J].Int J Neuropsychopharmacol,2013,16(1):69-82.
[17]Thompson SM,Kallarackal AJ,Kvarta MD,et al.An excitatory synapse hypothesis of depression[J].Trends Neurosci,2015,38(5):279-294.
[18]Li N,Lee B,Liu RJ,et al.mTOR-dependent synapse formation underlies the rapid antidepressant effects of NMDA antagonists[J].Science,2010,329(5994):959-964.
[19]Maeng S,Zarate CA Jr,Du J,et al.Cellular mechanisms underlying the antidepressant effects of ketamine:role of alpha-amino-3-hydroxy-5-methylisoxazole-4-propionicacidreceptors[J].Biol Psychiatry,2008,63(4):349-352.
[20]Greger IH,Khatri L,Kong X,et al.AMPA receptor tetramerization is mediated by Q/R editing[J].Neuron,2003,40(4): 763-774.
[21]Nordgren M,Karlsson T,Svensson M,et al.Orchestrated regulation of Nogo receptors,LOTUS,AMPA receptors and BDNF in an ECT model suggests opening and closure of a window of synaptic plasticity[J].PLoS One,2013,8(11):e78778.
(责任编辑:肖雅妮)
第十八届国际神经病学中山高峰论坛Neuroscience Day·青年科研人员有奖征文通知
由中山大学附属第一医院期刊中心《中国神经精神疾病杂志》编辑部举办的“第十八届国际神经病学中山高峰论坛”将于2015年11月28日-29日召开。本次大会将邀请国内外著名专家进行主题演讲,主要内容有脑血管病、STEPS培训项目、脑血管介入治疗、神经系统退行变性疾病、神经科学基础研究、疑难病例讨论与论文交流。
同时,为鼓励青年神经内、外科和相关学科医生、科研人员或硕士、博士研究生的临床和基础研究,本次会议特设了有奖征文,并组织专家小组进行现场提问及评分,评选出优秀论文,颁发证书并以资奖励,欢迎踊跃投稿,稿件将择优在《中国神经精神疾病杂志》发表。
征文要求:
1.第一作者必须是神经内、外科或精神科医务工作者,或硕士、博士研究生,年龄在40周岁以下;2.研究内容未曾公开发表,内容为神经内、外科及精神科临床和基础研究(不接收综述);3.征文要求为4000字以内全文一份,格式应包括摘要及正文,具体格式请参考《中国神经精神疾病杂志》稿约(http://www.zgsjjs.cn);4.请注明所有作者姓名、作者单位、邮政编码,必须提供第一作者和通讯作者电子邮箱及联系电话;5.论文可以邮寄或发送电子邮件于2015年10月30日之前发送到本期刊编辑部(地址如下),逾期不接收投稿;6.请注明“有奖征文投稿”。来稿恕不退还,请自留底稿。
会议论文截稿日期:2015年10月30日
地址:广州市中山二路74号《中国神经精神疾病杂志》(邮编510089)
E-mail:zgsjjs@126.com网址:http://www.zgsjjs.cn(最新消息请登陆网页查询)
联系人:彭老师联系电话:020-87332686
中山大学附属第一医院期刊中心
《中国神经精神疾病杂志》编辑部
2015年9月
Effect of ketamine combined with propofol anesthesia on expression of glutamine receptor subunit 1 and 2in the hippocampus of depressed rats after electroconvulsive therapy.
QIN Peipei,MIN Su,ZHANG Fan,REN Li,HAO Xuechao,ZHU Xianlin.Department of Anesthesiology,the First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China.Tel:023-89011068.
Objective To explore the effect of low-dose ketamine combined with propofol anesthesia on expression of glutamine receptor subunit 1(GluR1)and 2(GluR2)in the hippocampus of depressed rats after electroconvulsive therapy.Methods Healthy adult male Sprague-Dawley rats,weighing 200~250 g,were used in this study.Mental depression was induced by chronic unpredictable mild stress.Thirty-two depressed rats were randomly divided into 4 groups(n=8):metal depression group(group A),ECT group(group B),ECT+propofol group(group C)and ECT+propofol+ketamine group(group D).Eight normal rats served as control group.Control group received no treatment.Group A receivedintraperitoneal injection of normal saline 8 mL/kg plus sham ECT.Group B,C and D received ECT once a day for 7 consecutive days following intraperitoneal injection of normal saline 8 mL/kg,propofol 80 mg/kg and propofol 80 mg/kg+ ketamine 10mg/kg,respectively.Sucrose preference test and Morris water maze were performed to assess depressed behavior and learning and memory function,respectively.RT-PCR and Western-blot assay were used to detect the expression of GluR1,GluR2and their mRNA expression.Results After ECT,compared with control group and group A,changes of SPP in group B,C and D were obvious.The change of SPP in group D was much higher than all other groups(P<0.05).Rats in group B showed prolonged escape latency and shortened space exploration time,which were significantly different from all other groups(P<0.05).Rats in group D showed the most shortened escape latency and prolonged space exploration time(P<0.05).The expression of GluR1was significantly increased in group B,C and D compared with group A(P<0.05).The expression of GluR2and mRNA was significantly decreased in group B and C(P<0.05).The difference in GluR2and mRNA expression was not significant among group A,D and control group(P>0.05).Conclusion Low-dose ketamine combined with propofol anesthesia exert effective antidepressive action and improve learning and memory function of depressed rats after electroconvulsive therapy.The beneficial effects of the ketamine combined with propofol anesthesia may be related to up-regulation expression of GluR1and GluR2in hippocampus.
Depression Electroconvulsive Propofol Ketamine Glutamine receptor

R749.4
A
2015-04-25)
10.3969/j.issn.1002-0152.2015.09.003
☆国家自然科学基金面上项目(编号:81271501);国家临床重点专科建设项目经费资助(编号:财社(2011)170号);重庆市科委应用开发项目经费资助(编号:cstc2014yykfA110028)
*重庆医科大学附属第一医院麻醉科(重庆 400016)

